EDUCAZIONE CONTINUA in medicina
l’ARTICOLO
Importanti complicanze della malattia renale cronica
I van der WaltI; C R SwanepoelII; B MahalaIII; M MeyersIV
Corrispondenza
ABSTRACT
Le complicanze della malattia renale cronica (CKD) sono dislipidemia iperkaliemia, acidosi metabolica, anemia, e osseo e minerale disturbi. La dislipidemia può essere trattata con agenti che riducono le lipoproteine a bassa densità. Le statine sono inefficaci negli stadi 4 e 5 CKD, ma sono indicate per prevenire la progressione della malattia nelle fasi precedenti. L’acidosi cronica ha recentemente dimostrato di essere un fattore di rischio nella progressione della disfunzione renale CKD. Pertanto, il trattamento è obbligatorio. Praticamente, questo dovrebbe consistere in 1 – 2 cucchiaini colmi di bicarbonato di sodio 2 – 3 volte al giorno, che è una terapia economica e sicura che non aumenta la pressione sanguigna nonostante l’aumento del livello di sodio. I livelli target di emoglobina, secondo le linee guida internazionali, sono compresi tra 10 g / dL e 12 g/dL. Il livello di fosfato sierico è aumentato nella CKD di stadio 4, e specialmente nella CKD di stadio 5, che è associata a carotide coronarica e altre calcificazioni vascolari e può causare cardiopatia ischemica, infarto miocardico e ictus. Un aumento dei livelli di ormone paratiroideo (iperparatiroidismo secondario) è anche un importante fattore di rischio per le malattie cardiovascolari ed è associato ad un aumento dell’ipertensione e resistenza al trattamento dell’anemia associata a CKD.
Dislipidemia
La malattia renale cronica (CKD) è associata ad alterazioni della struttura e della funzione delle lipoproteine, tra cui:
- riduzione del colesterolo lipoproteico ad alta densità
- aumento della lipoproteina a densità intermedia
- aumento delle particelle lipidiche proatherogeniche.
Significato del controllo della dislipidemia
- È noto che un trattamento efficace della dislipidemia riduce il rischio di malattie cardiovascolari (CVD) e deve anche ritardare il declino della funzionalità renale.
- Poiché è stato dimostrato che le statine riducono l’escrezione urinaria di proteine o albumina, sono raccomandate per la CKD con proteinuria.
- Le osservazioni sull’uso delle statine negli stadi 3 – 5 della CKD sono riportate nella Tabella 1.
- L’uso concomitante di statine e fibrati aumenta il rischio di rabdomiolisi.
Target per il colesterolo lipoproteico a bassa densità
- Le linee guida della Kidney Disease Outcomes Quality Initiative (KDOQI) raccomandano quanto segue per la terapia con dislipidemia nella CKD: nei casi di colesterolo lipoproteico a bassa densità (LDL-C) <3.5 mmol / L, il primo passo è la modifica dello stile di vita; nei casi di LDL-C >3,5 mmol/L, la terapia farmacologica deve essere contemplata in aggiunta alla modifica dello stile di vita, compresa la terapia dietetica, il controllo del peso e l’esercizio fisico.
- È essenziale che il C-LDL sia abbassato a <1,8 mmol/L.
Linee guida KDOQI per l’abbassamento del colesterolo nei pazienti affetti da CKD(2013):
- I pazienti di età >50 anni devono ricevere una statina.
- I pazienti di età compresa tra 18 e 49 anni devono ricevere una statina se è presente un’altra comorbilità.
- I pazienti sottoposti a trapianto di rene devono ricevere una statina.
Trattamento dell ‘iperkaliemia e dell’ acidosi metabolica
Iperkaliemia
- Con il progredire della CKD, si osservano acidosi e iperkaliemia. L ‘iperkaliemia è definita come un livello sierico di potassio >5,5 mmol/L. L’ iperkaliemia >7 mmol/L può potenzialmente causare arresto cardiaco; tali casi devono essere trattati come emergenze.
- Se si osserva iperkaliemia grave, nonostante l ‘assenza di ridotta funzionalità renale, si deve prendere in considerazione la pseudoiperkaliemia, un artefatto dovuto all’ emolisi del campione di sangue.
- L’iperkaliemia è un fattore di rischio per le aritmie. Nei casi di iperkaliemia grave, i livelli di emergenza devono essere confermati da anomalie dell’ECG come la tentazione delle onde T, il prolungamento dei tempi di PQ, seguito dalla scomparsa dell’onda P e dall’allargamento del complesso QRS. I pazienti con risultati ECG pericolosi per la vita, bradicardia e ipotensione devono essere trattati tempestivamente, seguiti da un trattamento in associazione con un nefrologo.
- L’iperkaliemia indotta da farmaci nella CKD è principalmente causata da inibitori della renina-angiotensina-aldosterone come ACE inibitori, bloccanti del recettore dell’angiotensina II (ARB) e spironolattone o assunzione eccessiva di alimenti contenenti potassio. Altre cause includono la somministrazione di β-bloccanti, digossina, farmaci antinfiammatori non steroidei (FANS), trimetoprim o pentamidina.
- La CKD causata da nefropatia diabetica può essere associata ad ipoaldosteronismo iporeninemico, che può causare iperkaliemia nonostante una funzionalità renale relativamente ben conservata. Questo è noto come acidosi tubulare renale di tipo IV.
Trattamento di emergenza
- Il primo passo è stabilizzare il miocardio. La somministrazione endovenosa di gluconato di calcio non modifica il potassio plasmatico, ma migliora transitoriamente l’ECG. La somministrazione di gluconato di calcio 20 mL per via endovenosa in 1 minuto può essere ripetuta se non vi è alcun miglioramento dell’ECG entro 3 – 5 minuti.
- Il secondo passo è spostare il potassio dal compartimento extracellulare a quello intracellulare per cercare di ridurre rapidamente il livello di potassio sierico. Questo può essere fatto in tre modi diversi:
- Insulina endovenosa combinata con glucosio. Somministrare 10 U di insulina ad azione breve in associazione con 50 ml di destrosio al 50% in bolo, seguita da un’infusione endovenosa di destrosio al 5% per prevenire l’ipoglicemia.
- β2-agonista. Somministrare 20 mg di salbutamolo, un β2-agonista, per inalazione nell’arco di 10 minuti, con inizio d’azione di circa 30 minuti. (Questo di solito non è richiesto.)
- Bicarbonato di sodio in pazienti affetti da insufficienza renale cronica che non sono ancora in dialisi. La somministrazione di bicarbonato può ridurre il potassio sierico aumentando l’escrezione renale di potassio. L’effetto è molto lento e non utile in una situazione acuta a meno che il paziente non abbia una grave acidosi metabolica che necessita di un trattamento con bicarbonato.
- Una volta eseguite le precedenti misure temporanee, vengono intrapresi ulteriori interventi per rimuovere il potassio dal corpo.
- I diuretici dell’ansa hanno successo solo in pazienti con funzionalità renale adeguata.
- Lo scambiatore di resina sodio polistirene solfonato (Kexelato) rimuove il potassio dal sangue nell’intestino in cambio di una quantità uguale di sodio. Agisce lentamente e il potassio plasmatico inizia a diminuire solo entro 1 – 2 ore. Può essere somministrato per via orale o come clistere di ritenzione. La quantità data varia da 30 g a 60 g. Questo può essere ripetuto, ma tende a causare stitichezza.
- L’emodialisi è il trattamento di scelta per i pazienti con insufficienza renale cronica avanzata e iperkaliemia grave.
Prevenzione
- Consulenza dietetica sulla restrizione del potassio.
- Evitare farmaci che interferiscono con l’escrezione renale di potassio, ad esempio diuretici risparmiatori di potassio, FANS, ACE inibitori, ARB.
- Evitare farmaci che interferiscono con gli spostamenti del potassio dai compartimenti intracellulari a quelli extracellulari, ad esempio β-bloccanti non selettivi.
- In pazienti selezionati con sufficiente funzionalità renale residua può essere usato un trattamento con un diuretico dell ‘ansa per stimolare l’ escrezione urinaria di potassio.
Acidosi metabolica
L’acidosi metabolica è caratterizzata da:
- basso pH del sangue arterioso (acidemia) (<7.35)
- ridotta concentrazione sierica di HCO3
- ridotta pCO2 (da compensazione respiratoria).
Effetti sistemici
L’acidosi metabolica può portare a vari cambiamenti nei tessuti e negli organi, ad es.:
- alterazioni cardiovascolari quali tachicardia, bradicardia, ipotensione e insufficienza cardiaca
- iperkaliemia pericolosa per la vita
- nausea, vomito e dolore addominale
- confusione, con depressione del sistema nervoso centrale.
I sintomi e i segni associati dipenderanno dalla velocità e dall’entità della caduta del pH e della patologia sottostante.
Acidosi uremica
L’acidosi metabolica si verifica nell’insufficienza renale a causa della ridotta capacità di espellere H+ o dell’incapacità di produrre ammoniaca.
Nelle fasi iniziali di CKD (GFR <40 ml/min), l’acidosi metabolica con un gap anionico normale (AG) può diventare evidente. Con il progredire della CKD (GFR <20 mL/min), può verificarsi un’acidosi metabolica AG elevata.
Nella CKD avanzata, un aumento di AG è tipico a causa della presenza di acidi trattenuti come solfati, fosfati, urato e ippurato.
Principi di trattamento
I pazienti con acidosi metabolica sono spesso molto malati e la loro condizione tende a deteriorarsi rapidamente.
La somministrazione di routine di bicarbonato di sodio è controversa, sebbene debba essere eseguita per correggere l’acidosi grave.
Le potenziali complicanze della somministrazione di bicarbonato di sodio includono sovraccarico di volume, specialmente nei pazienti con compromissione della funzionalità renale o cardiaca, ipernatriemia, ipopotassiemia, ipocalcemia e alcalosi.
La quantità di bicarbonato richiesta (mmol) può essere stimata come segue:
plasma bersaglio HCO3- (mmol/L) – plasma corrente HCO3- (mmol/L) x 40% peso corporeo (kg).
Anemia nella CKD
L’anemia è la complicanza più comune della CKD ed è associata a una qualità di vita notevolmente ridotta. Un trattamento efficace dell ‘ anemia nella malattia renale può ridurre il declino della funzionalità renale. I livelli target di emoglobina sono 10-12 g/dL nel trattamento dell’anemia nella insufficienza renale cronica. Il trattamento è costoso e quindi la considerazione razionale è obbligatoria.
Anemia renale
L’anemia renale è tipicamente normocromica normocitica. È causata principalmente dalla ridotta produzione di eritropoietina a livello renale e in parte da tossine uremiche. Altre cause che possono svolgere un ruolo nella CKD, specialmente nei pazienti in dialisi, sono:
- resistenza all ‘ eritropoietina (più significativa)
- tossine del midollo osseo (nessuna è stata ancora isolata)
- fibrosi del midollo osseo, secondaria a iperparatiroidismo
- processi infiammatori in corso, ad es. infezioni non trattate
- carenza ematinica (ferro, folato e vitamina B12)
- aumento della distruzione degli eritrociti
- membrane anormali degli eritrociti, che causano una maggiore fragilità osmotica
- aumento della perdita di sangue da sanguinamento gastrointestinale occulto e prelievo di sangue e durante l’emodialisi
- inibizione dell ‘ ACE.
L ‘eritropoietina è un ormone glicoproteico che stimola la produzione di globuli rossi legandosi ai recettori dell’ eritropoietina, localizzati sulle cellule progenitrici eritroidi precoci del midollo osseo.
Il legame dell ‘eritropoietina con queste cellule progenitrici le salva dall’ apoptosi e permette quindi la divisione cellulare e la maturazione in globuli rossi. Nella insufficienza renale cronica, i livelli di eritropoietina possono essere normali, ma inadeguati per il grado di anemia. I meccanismi che compromettono la produzione di eritropoietina nei reni malati rimangono poco conosciuti. L ‘inibizione dell’ eritropoiesi da parte degli inibitori uremici è inoltre possibile e può contribuire notevolmente all ‘ anemia della CKD; tali fattori non sono stati identificati. La dialisi può migliorare l ‘anemia renale e l’ efficacia degli agenti stimolanti l ‘ eritropoietina. I pazienti con malattia renale possono sviluppare infezioni croniche e altre malattie croniche. In questi casi la malattia cronica contribuisce all’anemia. L ‘anemia della malattia cronica è mediata da citochine infiammatorie attraverso l’ inibizione della produzione e dell ‘efficacia dell’ eritropoietina e una ridotta disponibilità di ferro.
Hepcidin è il mediatore chiave del metabolismo del ferro. Negli stati infiammatori l’epcidina blocca l’assorbimento del ferro nell’intestino e promuove il sequestro del ferro nei macrofagi.
Altre cause
L ‘ anemia associata a insufficienza renale cronica è più probabile anemia renale; tuttavia, il differenziale per altre malattie deve essere considerato vero per gli stadi 1-3 CKD.
La valutazione dell ‘ anemia nei pazienti affetti da insufficienza renale cronica deve includere un esame emocromocitometrico completo con indici eritrocitari (concentrazione emoglobinica corpuscolare media, volume corpuscolare medio). L’anemia renale è solitamente normocromica e normocitica. La carenza di vitamina B12 e di folati può portare a macrocitosi, mentre la carenza di ferro o disturbi ereditari dell’emoglobina possono produrre microcitosi. Devono essere effettuati studi sul ferro per valutare il livello di ferro nelle riserve tissutali o l’adeguatezza della fornitura di ferro per l’eritropoiesi.
L ‘ anemia può indicare la presenza di malnutrizione o di malattie sistemiche. È un fattore di rischio indipendente per ospedalizzazione, CVD e mortalità. Gli ACE-inibitori possono esacerbare l’anemia.
Trattamento dell ‘anemia protegge il cuore
L’ anemia aggrava l ‘ insufficienza cardiaca. Il trattamento dell’anemia è benefico per l’aspettativa di vita e può anche migliorare la prognosi della CVD. La qualità della vita è migliorata per quelli con un livello di emoglobina entro il range target.
Livello target di emoglobina
Le linee guida KDIGO (Kidney Disease Improving Global Outcome) indicano che il livello di emoglobina deve variare da 10,0 g/dL a 12 g/dL nei pazienti affetti da insufficienza renale cronica in dialisi. I livelli pre-dialisi devono essere di 10 g / dL.
Condivisione dei ruoli tra nefrologi e medici di base
Si consiglia di rivolgersi tempestivamente a un nefrologo. Una volta decisa la strategia di trattamento, i nefrologi e i medici di base continuano la gestione in collaborazione.
Valutazione della carenza di ferro
La valutazione della carenza di ferro e del corretto apporto di ferro è importante nel trattamento dell ‘ anemia. L ‘anemia può migliorare con la somministrazione di integratori di ferro, anche quando il paziente non è apparentemente carente di ferro, poiché l’ uso di eritropoietina ricombinante può causare una relativa carenza di ferro.
Le linee guida di KDOQI per l’eritropoietina umana ricombinante nella CKD sono:
- ferritina sierica > 100 ng/mL prima della dialisi
- ferritina sierica > 200 ng / mL in pazienti dializzati
- saturazione della transferrina > 20%.
Il ferro può essere somministrato per via endovenosa o orale. Il ferro per via endovenosa è più efficace, specialmente per i pazienti in dialisi e quelli in trattamento con eritropoietina.
Uso di eritropoietine esogene
Attualmente è disponibile un certo numero di agenti stimolanti l ‘ eritropoietina, compresi farmaci più vecchi, ad azione più breve e nuovi, ad azione più lunga. L’agente e la dose appropriati dipendono da una serie di fattori, tra cui costo, efficacia e convenienza. Poiché questi farmaci sono costosi e hanno effetti collaterali, la loro gestione è meglio lasciare a un nefrologo.
Disturbi ossei e minerali
L’iperfosfatemia è l’anomalia chiave che scatena una cascata di eventi metabolici, con conseguente densità minerale ossea di CKD.
Il fosfato viene trattenuto quando la funzionalità renale si deteriora-più o meno come la creatinina viene mantenuta. Questa ritenzione diventa evidente quando viene raggiunto lo stadio 3b CKD. Peggiorerà progressivamente man mano che si avvicina lo stadio finale e deve essere abbassato entro i limiti normali.
Una dieta ad alto contenuto di fosfati stimola gli osteociti a produrre il fattore di crescita dei fibroblasti 23 che, a sua volta, inibisce l’idrossilazione della vitamina D all’attiva vitamina 1,25 D3. Senza vitamina D3, l’assorbimento del calcio e il rimodellamento osseo sono diminuiti. L’ipocalcemia risultante è uno stimolo importante per il rilascio dell’ormone paratiroideo (PTH), con il conseguente sviluppo della malattia ossea renale. La fosfatasi alcalina sierica è un marker di aumento del turnover osseo. Pertanto, alti livelli ematici mostrano attività PTH.
Da notare, sia l’iperfosfatemia che la carenza di vitamina D3 determinano un aumento della secrezione di PTH.
Inizialmente lo stimolo per la secrezione di PTH può essere controllato aumentando il calcio sierico, riducendo i livelli di fosfato nel sangue e prescrivendo vitamina D3. Questo è lo stadio iperparatiroidismo secondario (Tabella 2). Tuttavia, con il tempo e la stimolazione incontrollata e prolungata della secrezione di PTH, gli ormoni paratiroidei diventano autonomi e viene raggiunto lo stadio di iperparatiroidismo autonomo (Tabella 3). La paratiroidectomia può ora essere necessaria o devono essere somministrati costosi farmaci calcimimetici per cercare di ripristinare l’ambiente metabolico disordinato.


C’è incertezza sull’interpretazione delle misurazioni del livello di vitamina D3. Se devono essere misurati, i livelli di 25-OH-vitamina D3 sono raccomandati per la valutazione.
Terapia
Le fasi della terapia sono riportate nella Tabella 4. Si raccomandano leganti del fosfato non contenenti calcio in presenza di calcificazione metastatica significativa e / o in presenza di ipercalcemia.
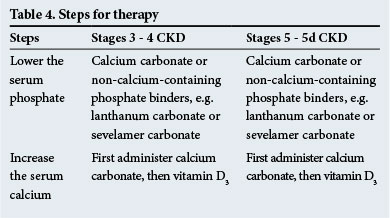
I calcimimetici, che sensibilizzano le ghiandole paratiroidi al calcio sierico, sono utili per prescrivere nell’iperparatiroidismo quando i livelli sierici di PTH sono elevati (2 – 9 volte al di sopra del range normale-verificare con il laboratorio per intervalli normali). Essi hanno un ruolo da svolgere nel diminuire i livelli di PTH in una qualsiasi delle situazioni cliniche che si verificano in CKD.
Misurazioni del sangue di follow-up
Queste sono riportate nella Tabella 5.
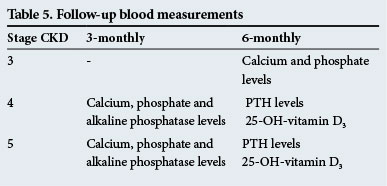
Questi tempi di follow – up sono solo linee guida e le prove devono essere eseguite più frequentemente se ci sono anomalie significative.
Punti speciali da notare
- Coinvolgono un nefrologo all’inizio del corso di CKD.
- Evitare l’eccessiva soppressione delle ghiandole paratiroidi, in quanto ciò porterà a una malattia ossea dinamica.
- Il livello esatto di PTH a cui viene diagnosticato l’iperparatiroidismo secondario e autonomo è incerto, a causa di saggi diversi. La biochimica, come sopra descritto (insieme alle radiografie delle ossa), deve quindi essere utilizzata per aiutare nella diagnosi.
- Essere consapevoli delle tendenze nei livelli di fosfatasi alcalina sierica; il livello può essere nel range di normalità, ma può essere raddoppiato rispetto alla lettura precedente.
- L’osteoporosi accompagna la malattia ossea che si verifica nella CKD. I bifosfonati non devono essere usati nei pazienti con CKD in stadio 3 – 5.