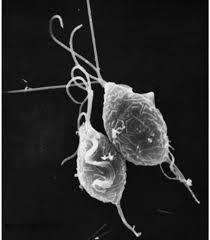
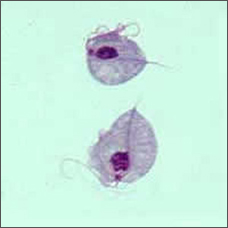
ten Dziwacznie wyglądający organizm w kształcie gruszki to Trichomonas vaginalis, jednokomórkowy pasożyt odpowiedzialny za najczęstszą chorobę przenoszoną drogą płciową na świecie, rzęsistkowicę.
ludzie są jedynym żywicielem T. vaginalis i bezpośrednia transmisja następuje z osoby na osobę podczas stosunku płciowego. Pasożyt rozmnaża się przez rozszczepienie binarne i nie ma dowodów na powstawanie torbieli. Jest beztlenowy, pozbawiony mitochondrium i jest pasożytem obligatoryjnym zamieszkującym drogi moczowo-płciowe samców i samic, gdzie porusza się przy użyciu czterech nitkowatych włókien zwanych flagellą.
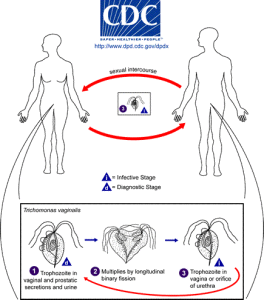
w 2008 roku Światowa Organizacja Zdrowia oszacowała, że na całym świecie zakażonych zostało 276 milionów ludzi. Aby ująć to w kontekście, w samych Stanach Zjednoczonych 3,1% kobiet w wieku od 14 do 45 lat jest zakażonych. Chociaż większość tych zakażeń jest bezobjawowa, zakażenie może prowadzić do zapalenia pochwy, zapalenia szyjki macicy lub zapalenia gruczołu krokowego i wiąże się ze zwiększonym ryzykiem zakażenia HIV oraz raka szyjki macicy lub prostaty. Może również negatywnie wpłynąć na wynik ciąży.
Jak to powoduje patologię?
T. vaginalis przyłącza się do kilku typów komórek gospodarza, takich jak te wyściełające pochwę i prostatę (komórki nabłonkowe). Komórki następnie lyse uwalniając składniki odżywcze dla pasożyta. Sposób, w jaki przyłącza się do komórek i powoduje ich lizę, jest słabo poznany, chociaż kontakt z komórkami gospodarza jest znany jako wymagany do ich lizy.
jeśli przyleganie komórek jest początkowym etapem ewentualnej lizy komórek, jest prawdopodobne, że cząsteczki na powierzchni pasożyta są zaangażowane w ten proces. Wiemy, że pasożyt jest pokryty cząsteczkami lipofosfoglikanu (LPG), które wiążą się z białkiem ssaków na powierzchni komórki zwanym galektyną-1. Ale jeśli produkcja galektyny jest powalona w komórkach ssaków, Wiązanie pasożytów jest zmniejszone tylko w niewielkiej ilości. Więc to nie jest cała historia.
wykazano również, że T. vaginalis przylega specjalnie do komórki nabłonka pochwy za pomocą białek zwanych adhezynami, a enzymy proteazy cysteinowej również biorą udział w cytoadherencji i innych aspektach patogenezy.
w 2010 Patricia Johnson podeszła do problemu, przyglądając się białkom pasożytów. Jej zespół zidentyfikował białka na powierzchni sześciu szczepów T. vaginalis o różnej zdolności przylegania do komórek gospodarza. Znaleziono 11 białek, które były bardziej obfite w szczepach bardziej adhezyjnych, a gdy dwa z nich były nadmiernie ekspresji w szczepach mniej adhezyjnych, przyczepność wzrosła.
rola białek romboidalnych
Ostatnio Grupa Johnsona zwróciła uwagę na dwa białka romboidalne T. vaginalis. Te białka romboidalne są proteazami serynowymi zlokalizowanymi na błonach komórkowych, z ich aktywnymi miejscami w obrębie dwuwarstwy lipidowej. Rozszczepiają inne białka transbłonowe, a produkty rozszczepiania są zwykle uwalniane na zewnątrz komórki. Regulują one wiele funkcji biologicznych, a u innych pierwotniaków wykazano, że rozszczepiają cząsteczki adhezyjne.
Analiza Bioinformatyczna wykazała, że 4 białka romboidalne mogą być aktywnymi proteazami w T. vaginalis. Jeden z nich, TvROM1 został pokazany na powierzchni komórki. TvROM2 i 3 znajdowały się w aparacie Golgiego, a TvROM4 nie mógł być zlokalizowany i został usunięty z badania.
w celu ustalenia, czy białka romboidalne faktycznie uczestniczyły w adhezji i lizie komórek gospodarza, zastosowano monowarstwy komórek ektocerwialnych. T. pasożyty pochwy umieszczano w systemie hodowli w obecności romboidalnego inhibitora proteazy. Zarówno przywiązanie do komórek, jak i ich liza zostały zahamowane w sposób zależny od dawki, co sugeruje, że proteazy romboidalne rzeczywiście odgrywają rolę zarówno w przywiązaniu pasożyta do komórek gospodarza, jak i w ich zniszczeniu.
Jednakże, gdy te trzy proteazy romboidalne były nadmiernie ekspresyjne u transfekowanych pasożytów, tylko tvrom1, proteaza romboidalna znajdująca się na powierzchni komórki, powodowała wzrost przyczepności i lizy komórek.
poszukiwanie substratów dla TvROM1
vaginalis, Grupa Johnsona zebrała cząsteczki uwolnione z transfekowanych pasożytów do pożywki hodowlanej w obecności lub braku inhibitora proteazy serynowej i poddała je spektrometrii masowej. Ilościowe podejście proteomiki i bioinformatyki zidentyfikowało dwa podobne białka jako substraty TvROM1 z małymi aminokwasami otaczającymi potencjalne miejsca rozszczepiania, które mogą znajdować się w domenie przezbłonowej. Białka te nie mogły być rozszczepiane przez TvROM3.
TvROM1 mógł rozszczepiać domenę transbłonową tylko jednego substratu, rozszczepienie występujące na zewnętrznej powierzchni domeny transbłonowej lub w jej pobliżu.
poprzez transfekcję T. vaginalis tak, że miejsce rozszczepiania tego substratu zostało wyłączone i nie mogło być rozszczepione przez TvROM1, Grupa wykazała gromadzenie się substratu na powierzchni pasożyta. Przywiązanie zmutowanych pasożytów do komórek gospodarza zostało znacznie zwiększone, co sugeruje bezpośrednią rolę tego substratu w przywiązaniu. Jednak Liza nie wzrosła, co wskazuje na udział dodatkowych czynników w lizie komórek gospodarza.
ta elegancka seria badań potwierdza pogląd, że białko romboidalne znajdujące się w błonie osocza T. vaginalis i jego substrat mają do odegrania rolę w patologii rzęsistkowicy. Autorzy sugerują, że rozszczepienie TvROM1 jego substratu może sygnalizować wzrost przylegających białek na powierzchni komórki pasożyta lub gospodarza podczas początkowej fazy wiązania.
Przydatne informacje
adhezja i liza komórek gospodarza jest oczywiście złożonym procesem wymagającym wielu czynników pochodzenia pasożyta. Dodanie białek romboidalnych do tej listy zwiększyło liczbę cząsteczek kandydujących, które mogłyby być celem wieloaspektowych szczepionek skierowanych przeciwko T. vaginalis. Do tej pory produkcja szczepionki przeciwko pasożytom pierwotniakom wymknęła się naszej społeczności, ale być może doprowadziło to nas o jeden mały krok dalej w kierunku tego celu.