fortsatt medicinsk utbildning
artikel
viktiga komplikationer av kronisk njursjukdom
i van der WaltI; C R SwanepoelII; B MahalaIII; A M MeyersIV
korrespondens
abstrakt
komplikationerna vid kronisk njursjukdom (CKD) är dyslipidemi hyperkalemi, metabolisk acidos, anemi samt ben-och mineralstörningar. Dyslipidemi kan behandlas med lågdensitetslipoproteinsänkande medel. Statiner är ineffektiva i steg 4 och 5 CKD, men indikeras för att förhindra sjukdomsprogression i de tidigare stadierna. Kronisk acidos har nyligen visat sig vara en riskfaktor i utvecklingen av CKD-njurdysfunktion. Därför är behandling obligatorisk. Praktiskt taget bör detta bestå av 1 – 2 upplagda teskedar natriumbikarbonat 2 – 3 gånger per dag, vilket är en billig och säker behandling som inte höjer blodtrycket trots den ökade natriumnivån. Målnivåerna för hemoglobin är enligt internationella riktlinjer mellan 10 g/dL och 12 g/dL. Serumfosfatnivån höjs i steg 4 CKD, och särskilt i steg 5 CKD, som är associerad med koronar carotid och andra vaskulära förkalkningar och kan leda till ischemisk hjärtsjukdom, hjärtinfarkt och stroke. En förhöjd nivå av paratyroidhormon (sekundär hyperparatyreoidism) är också en viktig riskfaktor för hjärt-kärlsjukdom och är förknippad med ökad hypertoni och resistens mot behandling av CKD-associerad anemi.
dyslipidemi
kronisk njursjukdom (CKD) är associerad med förändringar i lipoproteins struktur och funktion, inklusive:
- minskat lipoproteinkolesterol med hög densitet
- ökat mellandensitetslipoprotein
- ökade proaterogena lipidpartiklar.
betydelsen av kontroll av dyslipidemi
- framgångsrik behandling av dyslipidemi är känd för att sänka risken för kardiovaskulär sjukdom (CVD) och bör också fördröja minskningen av njurfunktionen.
- eftersom statiner har visat sig minska utsöndringen av urinprotein eller albumin rekommenderas de för CKD med proteinuri.
- Anmärkningar om statin användning i steg 3-5 CKD ges i Tabell 1.
- samtidig användning av statiner och fibrater ökar risken för rabdomyolys.
mål för lågdensitetslipoproteinkolesterol
- riktlinjerna för Njursjukdomsresultat Quality Initiative (KDOQI) rekommenderar följande för dyslipidemi-behandling i CKD: i fall av lågdensitetslipoproteinkolesterol (LDL-C) <3.5 mmol/L, det första steget är livsstilsmodifiering; i fall av LDL-C >3, 5 mmol / L, bör läkemedelsbehandling övervägas utöver livsstilsmodifiering, inklusive dietterapi, viktkontroll och motion.
- det är viktigt att LDL-C sänks till < 1, 8 mmol / L.
kdoqi riktlinjer för kolesterolsänkning hos CKD-patienter (2013):
- patienter >50 år ska få statin.
- patienter i åldern 18-49 år bör få statin om en annan komorbiditet föreligger.
- Njurtransplantatmottagare ska få statin.
behandling av hyperkalemi och metabolisk acidos
hyperkalemi
- när CKD fortskrider i stadium observeras acidos och hyperkalemi. Hyperkalemi definieras som en serumkaliumnivå >5, 5 mmol/L. hyperkalemi >7 mmol/L kan potentiellt orsaka hjärtstillestånd; sådana fall bör behandlas som nödsituationer.
- om allvarlig hyperkalemi observeras, trots frånvaro av nedsatt njurfunktion, bör pseudohyperkalemi, en artefakt på grund av hemolys av blodprovet, övervägas.
- hyperkalemi är en riskfaktor för arytmier. I fall av allvarlig hyperkalemi bör nödnivåer bekräftas av EKG-avvikelser såsom tältvågor, förlängning av PQ-tider, följt av försvinnande av P-vågen och utvidgning av QRS-komplexet. Patienter med livshotande EKG-fynd, bradykardi och hypotoni bör behandlas omedelbart, följt av behandling i samband med en nefrolog.
- läkemedelsinducerad hyperkalemi i CKD orsakas mest av renin-angiotensin-aldosteron-hämmare såsom ACE-hämmare, angiotensin II-receptorblockerare (arb) och spironolakton eller överdrivet intag av kaliuminnehållande livsmedel. Andra orsaker är att ta emot-blockerare, digoxin, icke-steroida antiinflammatoriska läkemedel (NSAID), trimetoprim eller pentamidin.
- CKD orsakad av diabetisk nefropati kan vara associerad med hyporeninemisk hypoaldosteronism, vilket kan orsaka hyperkalemi trots relativt välbevarad njurfunktion. Detta kallas typ IV renal tubulär acidos.
akutbehandling
- det första steget är att stabilisera myokardiet. Den intravenösa administreringen av kalciumglukonat förändrar inte plasmakalium, men förbättrar tillfälligt EKG. Administreringen av kalciumglukonat 20 mL intravenöst under 1 minut kan upprepas om det inte finns någon förbättring av EKG inom 3 – 5 minuter.
- det andra steget är att flytta kalium från det extracellulära till det intracellulära facket för att försöka snabbt minska serumkaliumnivån. Detta kan göras på tre olika sätt:
- intravenöst insulin kombinerat med glukos. Administrera 10 e kortverkande insulin kombinerat med 50 mL 50% dextros som bolus, följt av en intravenös infusion av 5% dextros för att förhindra hypoglykemi.
- 2-agonist. Administrera 20 mg salbutamol, en 2-agonist, genom inhalation under 10 minuter, med verkan ca 30 minuter. (Detta krävs vanligtvis inte.)
- natriumbikarbonat hos CKD-patienter som ännu inte är i dialys. Bikarbonatadministration kan sänka serumkalium genom att öka utsöndringen av renal kalium. Effekten är mycket långsam och används inte i en akut situation om inte patienten har svår metabolisk acidos som behöver bikarbonatbehandling.
- när de tidigare tillfälliga åtgärderna har utförts vidtas ytterligare åtgärder för att avlägsna kalium från kroppen.
- loopdiuretika är endast framgångsrika hos patienter med adekvat njurfunktion.
- hartsbytaren natriumpolystyrensulfonat (Kexelat) tar bort kalium från blodet i tarmen i utbyte mot lika mycket natrium. Det är långsamt verkande och plasmakaliumet börjar bara minska inom 1 – 2 timmar. Det kan ges oralt eller som en retentionema. Den angivna mängden varierar från 30 g till 60 g. Detta kan upprepas, men tenderar att orsaka förstoppning.
- hemodialys är valfri behandling för patienter med avancerad CKD och svår hyperkalemi.
förebyggande
- kostrådgivning om kaliumbegränsning.
- Undvik läkemedel som stör renal utsöndring av kalium, t.ex. kaliumsparande diuretika, NSAID, ACE-hämmare, arb.
- Undvik läkemedel som stör kaliumförskjutningar från det intracellulära till det extracellulära facket, t.ex. icke-selektiva pankreasblockerare.
- hos utvalda patienter med tillräcklig kvarvarande njurfunktion kan behandling med loopdiuretikum användas för att stimulera urinutsöndring av kalium.
metabolisk acidos
metabolisk acidos kännetecknas av:
- lågt arteriellt pH (acidemi) (<7.35)
- minskad serum HCO3-koncentration
- minskad pCO2 (från andningskompensation).
systemiska effekter
metabolisk acidos kan leda till olika förändringar i vävnader och organ, t. ex.:
- kardiovaskulära förändringar såsom takykardi, bradykardi, hypotension och hjärtsvikt
- livshotande hyperkalemi
- illamående, kräkningar och buksmärta
- förvirring, med depression av centrala nervsystemet.
de associerade symtomen och tecknen beror på hastigheten och storleken på fallet i pH och den underliggande patologin.
uremisk acidos
metabolisk acidos uppträder vid njursvikt på grund av minskad förmåga att utsöndra H+ eller oförmåga att producera ammoniak.
i de tidiga stadierna av CKD (GFR <40 mL/min) kan metabolisk acidos med ett normalt anjongap (AG) bli uppenbart. När CKD fortskrider (GFR <20 mL/min) kan en hög AG metabolisk acidos uppstå.
i avancerad CKD är en ökad AG typisk på grund av närvaron av kvarhållna syror såsom sulfater, fosfater, urat och hippurat.
behandlingsprinciper
patienter med metabolisk acidos är ofta mycket sjuka och deras tillstånd tenderar att försämras snabbt.
den rutinmässiga administreringen av natriumbikarbonat är kontroversiell, även om det måste göras för att korrigera svår acidos.
de potentiella komplikationerna vid administrering av natriumbikarbonat inkluderar volymöverbelastning, särskilt hos patienter med nedsatt njur-eller hjärtfunktion, hypernatremi, hypokalemi, hypokalcemi och alkalos.
mängden bikarbonat som krävs (mmol) kan uppskattas enligt följande:
målplasma HCO3- (mmol/L) – nuvarande plasma HCO3- (mmol/L) x 40% kroppsvikt (kg).
anemi vid CKD
anemi är den vanligaste komplikationen av CKD och är förknippad med kraftigt nedsatt livskvalitet. Framgångsrik behandling av anemi vid njursjukdom kan minska nedsatt njurfunktion. Målvärdet för hemoglobinnivåer är 10 – 12 g/dL vid behandling av anemi vid kronisk njursjukdom. Behandlingen är kostsam och därför är rationell övervägning obligatorisk.
Renal anemi
Renal anemi är typiskt normokrom normocytisk. Det orsakas främst av nedsatt produktion av erytropoietin i njurarna och delvis av uremiska toxiner. Andra orsaker som kan spela en roll i CKD, särskilt hos dialyspatienter, är:
- erytropoietinresistens (mest signifikant)
- benmärgstoxiner (ingen har isolerats ännu)
- benmärgsfibros, sekundär till hyperparatyreoidism
- pågående inflammatoriska processer, t. ex. obehandlade infektioner
- hematinbrist (järn, folat och vitamin B12)
- ökad förstörelse av röda blodkroppar
- onormala röda cellmembran, vilket orsakar ökad osmotisk bräcklighet
- ökad blodförlust från ockult gastrointestinal blödning och blodprovtagning och under hemodialys
- ACE-hämning.
erytropoietin är ett glykoproteinhormon som stimulerar produktionen av röda blodkroppar genom att binda till erytropoietinreceptorer, belägna på tidiga erytroida stamceller i benmärgen.
bindningen av erytropoietin till dessa stamceller sparar dem från apoptos och tillåter därför celldelning och mognad i röda blodkroppar. Vid CKD kan erytropoietinnivåerna vara normala, men otillräckliga för graden av anemi. Mekanismerna som försämrar erytropoietinproduktionen i sjuka njurar förblir dåligt förstådda. Hämning av erytropoes av uremiska hämmare är också möjlig och kan i hög grad bidra till anemin av CKD; sådana faktorer har inte identifierats. Dialys kan förbättra renal anemi och effekten av erytropoietin-stimulerande medel. Patienter med njursjukdom kan utveckla kroniska infektioner och andra kroniska sjukdomar. Kronisk sjukdom bidrar till anemi i sådana fall. Anemin vid kronisk sjukdom medieras av inflammatoriska cytokiner genom hämning av erytropoietinproduktion och effekt och minskad järntillgänglighet.
Hepcidin är den viktigaste medlaren för järnmetabolism. I inflammatoriska tillstånd blockerar hepcidin järnabsorption i tarmen och främjar järnbindning i makrofager.
andra orsaker
anemi associerad med CKD är troligen renal anemi; skillnaden för andra sjukdomar måste dock anses vara sann för steg 1 – 3 CKD.
utvärderingen av anemi hos CKD-patienter bör inkludera ett fullständigt blodtal med röda cellindex (Genomsnittlig korpuskulär hemoglobinkoncentration, Genomsnittlig korpuskulär volym). Renal anemi är vanligtvis normokrom och normocytisk. Vitamin B12 och folatbrist kan leda till makrocytos, medan järnbrist eller ärftliga hemoglobinrubbningar kan ge mikrocytos. Järnstudier bör utföras för att bedöma järnnivån i vävnadsbutiker eller tillräckligheten för järntillförsel för erytropoies.
anemi kan indikera förekomst av undernäring eller systemisk sjukdom. Det är en oberoende riskfaktor för sjukhusvistelse, CVD och dödlighet. ACE-hämmare kan förvärra anemi.
behandling av anemi skyddar hjärtat
anemi förvärrar hjärtsvikt. Behandling av anemi är fördelaktig för förväntad livslängd och kan också förbättra prognosen för CVD. Livskvaliteten förbättras för dem med en hemoglobinnivå inom målområdet.
målnivå för hemoglobin
riktlinjerna för Njursjukdomsförbättrande globalt utfall (Kdigo) anger att hemoglobinnivån bör sträcka sig från 10, 0 g/dL till 12 g/dL hos patienter med kronisk njursjukdom i dialys. Fördialysnivåerna bör vara 10 g / dL.
Rolldelning mellan nefrologer och primärvårdsläkare
tidig remiss till en nefrolog rekommenderas. När behandlingsstrategin har beslutats fortsätter nephrologists och primärvårdsläkare ledningen i partnerskap.
utvärdering av järnbrist
utvärdering av järnunderskottet och korrekt järntillförsel är viktigt vid behandling av anemi. Anemi kan förbättras vid administrering av järntillskott, även om patienten uppenbarligen inte har järnbrist, eftersom användning av rekombinant erytropoietin kan orsaka relativ järnbrist.
kdoqi: s riktlinjer för rekombinant humant erytropoietin i CKD är:
- serumferritin >100 ng/mL före dialys
- serumferritin >200 ng/mL hos dialyspatienter
- transferrinmättnad >20%.
järn kan ges antingen intravenöst eller oralt. Intravenöst järn är mer effektivt, särskilt för dialyspatienter och de som behandlas med erytropoietin.
användning av exogena erytropoietiner
det finns för närvarande ett antal erytropoietinstimulerande medel tillgängliga, inklusive äldre, kortare verkande läkemedel och nya, längre verkande. Lämpligt medel och dos beror på ett antal faktorer, inklusive kostnad, effektivitet och bekvämlighet. Eftersom dessa läkemedel är dyra och har biverkningar, är deras hantering bäst avgörs av en nephrologist.
ben-och mineralstörningar
hyperfosfatemi är den viktigaste avvikelsen som utlöser en kaskad av metaboliska händelser, vilket resulterar i bentäthet av CKD.
fosfat behålls när njurfunktionen försämras – ungefär samma som kreatinin behålls. Denna retention blir uppenbar när steg 3B CKD uppnås. Det kommer gradvis att förvärras när slutstadiet närmar sig och måste sänkas till inom normala gränser.
en högfosfatdiet stimulerar osteocyter att producera fibroblasttillväxtfaktor 23 som i sin tur hämmar hydroxyleringen av vitamin D till aktivt 1,25-vitamin D3. Utan vitamin D3 minskar kalciumabsorptionen och Benremodelleringen. Den resulterande hypokalcemi är en viktig stimulans för frisättning av parathyroidhormon (PTH), med följd av utveckling av njurbenssjukdom. Serum alkaliskt fosfatas är en markör för ökad benomsättning. Därför visar höga blodnivåer PTH-aktivitet.
Observera att både hyperfosfatemi och vitamin D3-brist resulterar i ökad PTH-utsöndring.
initialt kan stimulansen för PTH-utsöndring kontrolleras genom att öka serumkalciumet, minska fosfatnivåerna i blodet och förskriva vitamin D3. Detta är det sekundära hyperparathyroidism-steget (Tabell 2). Men med tiden och okontrollerad, långvarig stimulering av PTH-utsöndring blir parathyroidhormonerna autonoma och scenen för autonom hyperparathyroidism uppnås (tabell 3). Parathyroidektomi kan nu vara nödvändigt eller dyra kalcimimetiska läkemedel måste administreras för att försöka återställa den störda metaboliska miljön.


det finns osäkerhet om tolkningen av vitamin D3-nivåmätningar. Om de ska mätas rekommenderas 25-OH-vitamin D3-nivåer för bedömning.
Terapi
stegen för behandling visas i Tabell 4. Icke-kalciuminnehållande fosfatbindemedel rekommenderas när det finns signifikant metastatisk förkalkning och/eller när hyperkalcemi förekommer.
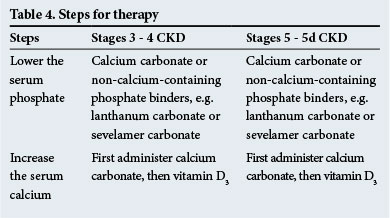
Kalcimimetika, som sensibiliserar bisköldkörtlarna för serumkalcium, är användbara för att förskriva vid hyperparatyreoidism när serumets PTH – nivåer är höga (2 – 9 gånger över det normala intervallet-kontrollera med laboratoriet för normala intervall). De har en roll att spela i minskande PTH-nivåer i någon av de kliniska situationer som uppstår i CKD.
Uppföljningsblodmätningar
dessa ges i Tabell 5.
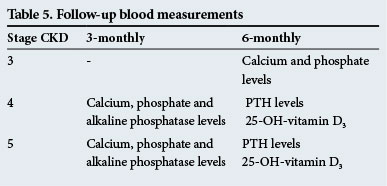
dessa uppföljningstider är endast riktlinjer och testerna bör utföras oftare om det finns betydande avvikelser.
särskilda punkter att notera
- involvera en nephrologist tidigt under CKD.
- Undvik överundertryckning av bisköldkörtlarna, eftersom detta kommer att leda till dynamisk bensjukdom.
- den exakta PTH-nivån vid vilken sekundär och autonom hyperparathyroidism diagnostiseras är osäker på grund av olika analyser. Biokemi, som beskrivs ovan (tillsammans med röntgenbilder av ben), måste sedan användas för att hjälpa till med diagnosen.
- var medveten om trender i alkaliska fosfatasnivåer i serum; nivån kan ligga inom det normala intervallet men kan ha fördubblats från föregående avläsning.
- osteoporos åtföljer bensjukdom som förekommer i CKD. Bisfosfonater får inte användas i steg 3 – 5 CKD-patienter.