Vzdělávací Cíle
na konci této části, budete moci:
- Napište Lewis symboly pro neutrální atomy a ionty
- Nakreslit Lewis struktury znázorňující vazby v jednoduchých molekulách
Diskutovali jsme různé typy dluhopisů, které se tvoří mezi atomy a/nebo iontů. Ve všech případech tyto vazby zahrnují sdílení nebo přenos valenčních elektronů mezi atomy. V této části, prozkoumáme typickou metodu pro zobrazení valenčních elektronů a chemických vazeb, jmenovitě Lewisovy symboly a Lewisovy struktury.
Lewis Symboly
používáme Lewis symboly k popisu valenční elektronové konfigurace atomů a monoatomární ionty. Lewis symbol se skládá z elementární symbol obklopen jeden bod za každé ze svých valenčních elektronů:
Obrázek 1 ukazuje Lewis symboly pro prvky třetí periody periodické tabulky.

Obrázek 1. Lewis symboly znázorňující počet valenčních elektronů pro každý prvek ve třetím období periodické tabulky.
Lewis symboly mohou být také použity k ilustraci vzniku kationtů z atomů, jak je znázorněno zde pro sodík a vápník:

Podobně, mohou být použity k ukázat tvorbu aniontů z atomů, jak je uvedeno níže pro chlór a síru:

Obrázek 2 demonstruje použití Lewis symboly ukázat přenosu elektronů při vzniku iontových sloučenin.

Obrázek 2. Kationty se tvoří, když atomy ztrácejí elektrony, reprezentované méně Lewisovými tečkami, zatímco anionty jsou tvořeny atomy získávajícími elektrony. Celkový počet elektronů se nemění.
Lewis Struktury
používáme také Lewis symboly, uvádět tvorbu kovalentní vazby, které jsou zobrazeny v Lewis struktury, kresby, které popisují spojování molekul a iontů polyatomic. Například, když dva atomy chloru tvoří molekulu chloru, sdílejí jeden pár elektronů:

Lewis struktura znamená, že každý atom Cl má tři páry elektronů, které nejsou použity v lepení (tzv. osamělé páry) a jeden sdílený elektronový pár (napsáno mezi atomy). POMLČKA (nebo čára) se někdy používá k označení sdíleného páru elektronů:

jeden sdílený pár elektronů se nazývá jediná vazba. Každý atom Cl interaguje s osmi valenčními elektrony: šest v osamělých párech a dva v jediné vazbě.
Octet Pravidlo
ostatní halogenové molekuly (F2, Br2, I2, a At2) tvoří dluhopisy jako ty v chlór molekuly: jedna jednoduchá vazba mezi atomy a tři osamělé páry elektronů na atom. To umožňuje, aby každý atom halogenu měl konfiguraci elektronů vzácných plynů. Tendence atomů hlavní skupiny vytvářet dostatečné vazby k získání osmi valenčních elektronů je známá jako oktetové pravidlo.
počet vazeb, které atom může tvořit může být často předpověděl, z je počet elektronů potřebných k dosažení oktet (osm valenčních elektronů); zvláště to platí kožišiny druhém období periodické tabulky prvků (C, N, O a F). Například každý atom prvku skupiny 14 má ve svém nejvzdálenějším plášti čtyři elektrony, a proto vyžaduje další čtyři elektrony k dosažení oktetu. Tyto čtyři elektrony lze získat vytvořením čtyř kovalentních vazeb, jak je zde znázorněno pro uhlík v CCl4 (tetrachlormethan) a křemík v SiH4 (silan). Protože vodík potřebuje pouze dva elektrony, aby naplnil svůj valenční obal, jedná se o výjimku z oktetového pravidla. Přechod prvky a vnitřní přechod prvků také nemusí dodržovat pravidlo oktet:

Skupina 15 prvků, jako je dusík mají pět valenčních elektronů v atomovém Lewis symbol: jeden osamělý pár a tři nepárové elektrony. K získání oktetu tvoří tyto atomy tři kovalentní vazby, jako v NH3 (amoniak). Kyslík a další atomy ve skupině 16 získají oktet vytvořením dvou kovalentních vazeb:
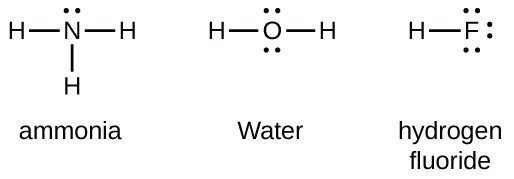
Dvoulůžkové a Třílůžkové Dluhopisy
Jak jsem zmínil dříve, když pár atomy sdílí jeden pár elektronů, říkáme to jediné pouto. Nicméně, pár atomů může potřebovat sdílet více než jeden pár elektronů, aby se dosáhlo požadovaného oktetu. Dvojná vazba se tvoří, když dva páry elektronů, které jsou sdíleny mezi dvojice atomů, jako mezi uhlíku a atomy kyslíku v CH2O (formaldehyd) a mezi dvěma atomy uhlíku v C2H4 (ethylen):
trojnou vazbou se tvoří, když tři elektronové páry jsou sdíleny dvojicí atomů, jako v dusíku (N2):
Psaní Lewis Struktury s Oktet Pravidlo
Pro velmi jednoduché molekuly a molekulární ionty, můžeme psát Lewis struktury pouze tím, že párování nepárové elektrony na základní atomy. Viz tyto příklady:

u složitějších molekul a molekulárních iontů je užitečné postupovat krok za krokem popsaným zde:
- Určete celkový počet valenčních (vnějších) elektronů.
- nakreslete kostrovou strukturu molekuly a uspořádejte atomy kolem centrálního atomu. (Obecně by měl být nejméně elektronegativní prvek umístěn ve středu.) Připojte každý atom k centrálnímu atomu jedinou vazbou(jeden elektronový pár).
- Distribuovat zbývající elektrony jako osamělé páry na terminálu atomy (kromě vodíku), dokončení oktet kolem každého atomu.
- umístěte všechny zbývající elektrony na centrální atom.
- Uspořádejte elektrony vnějších atomů tak, aby vytvořily více vazeb s centrálním atomem, aby se všude, kde je to možné, získaly oktety.
Pojďme určit Lewis struktura PBr3 pomocí výše uvedených kroků:
- Krok 1: Určit celkový počet valenčních (vnější plášť) elektrony.
\velké \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{PBr}}_{3}\\ \phantom{\rule{0.8 em}{0ex}}\text{P: 5 valenčních elektronů/atom}\times \text{1 atom}=5\\ \underline{+\text{Br: 7 valenčních elektronů/atom}\times \text{3 atomy}=21}\\ \\ \phantom{\rule{15.95em}{0ex}}=\text{26 valenční elektrony}\end{array}
- Krok 2: Nakreslete kostru struktury molekuly, uspořádání atomů kolem centrálního atomu. (Obecně by měl být nejméně elektronegativní prvek umístěn ve středu.) Připojte každý atom k centrálnímu atomu jedinou vazbou(jeden elektronový pár).

- Krok 3: Distribuovat zbývající elektrony jako osamělé páry na terminálu atomy (kromě vodíku), dokončení oktet kolem každého atomu.
-
 Krok 4: Umístěte všechny zbývající elektrony na centrální atom.
Krok 4: Umístěte všechny zbývající elektrony na centrální atom.

Poznámka: Krok 5: není potřeba, protože všechny atomy mají oktet.
Pojďme určit Lewis struktura CH2O.
- Krok 1: Určete celkový počet valenčních (vnějších) elektronů.
\velké \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{H}_{2}}\text{CO}\\ \phantom{\rule{0.8 em}{0ex}}\text{H: 1 valenční elektron/atom}\times \text{2 atom}=2\\\text{C: 4 valenční elektrony/atom}\times \text{1 atom}=4\\ \underline{+\text{O: 6 valenčních elektronů/atom}\times \text{1 atomy}=6}\\ \\ \phantom{\rule{15.95 em}{0ex}}=\text{12 valenčních elektronů}\end{array}
- Krok 2: Nakreslete kostru struktury molekuly, uspořádání atomů kolem centrálního atomu. (Obecně by měl být nejméně elektronegativní prvek umístěn ve středu.) Připojte každý atom k centrálnímu atomu jedinou vazbou(jeden elektronový pár).

- Krok 3: Distribuovat zbývající elektrony jako osamělé páry na terminálu atomy (kromě vodíku), dokončení oktet kolem každého atomu.

- Krok 4: není potřeba, protože byly umístěny všechny elektrony. Uhlík však nemá oktet,
- Krok 5: Uspořádejte elektrony vnějších atomů a vytvořte více vazeb s centrálním atomem, abyste získali oktety, kdykoli je to možné.

Příklad 1: Psaní Lewis Struktury
NASA Cassini-Huygens mise zjištěn velký mrak toxického kyanovodíku (HCN) na Titan, jeden ze saturnových měsíců. Jaké jsou Lewisovy struktury těchto molekul?
Zkontrolujte, zda Vaše Učení
Oxid uhličitý, CO2, je produktem spalování fosilních paliv. CO2 se podílí na globální změně klimatu. Jaká je Lewisova struktura CO2?
Klíčové Pojmy a Shrnutí
elektronický Valenční struktury mohou být zobrazeny pomocí kreslení Lewis symboly (pro atomy a monoatomární ionty) a Lewis struktur (molekul a iontů polyatomic). Osamělé páry, nepárové elektrony, a single, double, nebo triple dluhopisy se používají k označení, kde valenční elektrony jsou umístěny kolem každého atomu v Lewis struktury. Většina struktur—zejména těch, které obsahují prvky druhé řady-se řídí oktetovým pravidlem, ve kterém je každý atom (kromě H) obklopen osmi elektrony. Výjimky z pravidla oktetu se vyskytují u molekul lichých elektronů (volných radikálů), molekul s nedostatkem elektronů a hypervalentních molekul.
cvičení
- napište Lewisovy symboly pro každý z následujících iontů:
- As3–
- –
- Be2+
- O2–
- Ga3+
- Li+
- N3–
- Mnoho monoatomární ionty se nacházejí v mořské vodě, včetně ionty tvoří z následujícího seznamu prvků. Napište Lewisovy symboly pro monatomické ionty vytvořené z následujících prvků:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- Napište Lewis symboly iontů v každé z následujících iontové sloučeniny a Lewis symboly atomu, z něhož jsou tvořeny:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- V Lewis struktury uvedené níže, M a X představují různé prvky ve třetím období periodické tabulky. Napište vzorec každé sloučeniny pomocí chemických symbolů každého prvku:
- Napište Lewis struktura pro dvouatomová molekula P2, nestabilní forma fosforu nalézt v high-teplota fosfor par.
- Napsat Lewis struktury pro následující:
- H2
- HBr
- PCl3
- Napište Lewis struktury pro následující:
- O2
- H2CO
- AsF3
- SiCl4
Glosář
dvojné vazby: kovalentní vazba, ve které dva páry elektronů, které jsou sdíleny mezi dvěma atomy
volný radikál: molekula, která obsahuje lichý počet elektronů
hypervalent molekul: molekula obsahující alespoň jeden hlavní skupiny prvek, který má více než osm elektronů ve své valenční vrstvě.
Lewis struktura: diagram zobrazující osamělé páry a lepení párů elektronů v molekule nebo iontu
Lewis symbol: symbol pro prvek nebo monoatomární ionty, které se používá tečka zastupovat každý valenční elektron v prvku nebo ion
elektronové páry: dva (pár) valenční elektrony, které nejsou používány k vytvoření kovalentní vazby
octet pravidlo: obecné zásady, že státy, hlavní skupiny atomů bude tvořit struktury, v nichž osm valenčních elektronů komunikovat s každé jádro, počítání lepení elektrony jako interakci s oběma atomy spojeny pouto
single bond: dluhopisů, ve které jeden pár elektronů je sdílí dva atomy,
trojné vazby: vazba, ve které jsou tři páry elektronů sdíleny mezi dvěma atomy


 HCN: žádné elektrony zůstávají
HCN: žádné elektrony zůstávají




















