Reakce sazby
změny sazby při změně halogenové
Reakce sazby zvýšit v řádu HF – HCl – HBr – HI. Fluorovodík reaguje mnohem pomaleji než ostatní tři a je obvykle ignorován při mluvení o těchto reakcích.
když halogenovodíky reagují s alkeny, musí být vazba vodík-halogen přerušena. Síla vazby klesá při přechodu z HF na HI a vazba vodík-fluor je obzvláště silná. Protože je obtížné přerušit vazbu mezi vodíkem a fluorem, přidání HF je vázáno na pomalé.
Změna rychlosti při změně alkenu
to platí pro nesymetrické alkeny i pro symetrické alkeny. Pro jednoduchost jsou níže uvedené příklady všechny symetrické – ale nemusí být.
reakční rychlosti se zvyšují s tím, jak se Alken komplikuje – ve smyslu počtu alkylových skupin (jako jsou methylové skupiny) připojených k atomům uhlíku na obou koncích dvojné vazby. Například:
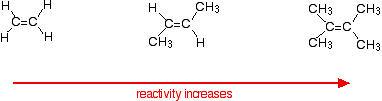
existují dva způsoby, jak se podívat na důvody pro toto-oba které potřebujete vědět o mechanismu reakcí.
alkeny reagují, protože elektrony v vazbě pi přitahují věci s jakýmkoli stupněm kladného náboje. Cokoliv, co zvyšuje hustotu elektronů kolem dvojné vazby, to pomůže.
alkylové skupiny mají tendenci“ tlačit “ elektrony od sebe směrem k dvojné vazbě. Čím více alkylových skupin máte, tím negativnější je oblast kolem dvojných vazeb.
čím více se tato oblast negativně nabije, tím více bude přitahovat molekuly, jako je chlorovodík.
důležitější důvod však spočívá ve stabilitě meziproduktu iontu vytvořeného během reakce. Tři výše uvedené příklady produkují tyto karbokace (ionty uhlíku) v polovině reakce:
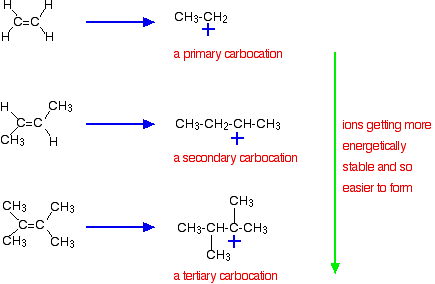
stabilita mezilehlých iontů řídí aktivační energii pro reakci. Jak jdete směrem ke složitějším alkenům, aktivační energie pro reakci klesá. To znamená, že reakce se zrychlují.