Úvod
Napětí-gated draslíkové kanály tvoří velkou a různorodou rodinu, která je evolučně konzervovaným. Existují 40 lidské napěťově řízené geny draslíkových kanálů patřící do 12 podrodiny. Tyto KV kanály vykazují široké distribuce v nervovém systému a dalších tkáních. U excitabilních buněk, jako jsou neurony, kardiomyocyty a svaly, KV kanály regulují průběh a vzorec střelby akčních potenciálů. KV kanály mohou také regulovat objem buněk, proliferaci a migraci široké škály typů buněk.
napěťově řízené draslíkové (KV) kanály patří do jedné z největších a vysoce evolučně konzervovaných rodin iontových kanálů . Každý KV kanál obsahuje čtyři podobné nebo identické α-podjednotky tvořící póry a může také obsahovat pomocné β-podjednotky, které by mohly ovlivnit funkci kanálu a / nebo lokalizaci . Každého póru tvoří podjednotku KV kanálů obsahuje šest transmembránových segmentů (S1-S6), přičemž první čtyři transmembránové segmenty (S1-S4), které tvoří napěťový senzor a poslední dva transmembránové segmenty doprovodných kapilární smyčky (S5-P-S6) jako kapilární domény. Kromě chromozomu umístění jednotlivých KV kanál genu u člověka, myši a potkana, fyziologické a farmakologické vlastnosti kanálu, a jeho distribuce v tkáních a patofyziologie poskytl Iontový Kanál Databáze Podvýboru pro Napětí-gated draslíkové kanály Nomenklatury Výboru Mezinárodní Unie Farmakologie (NC-IUPHAR). Tento článek představuje úvod do rozmanitosti a funkcí napěťově řízených draslíkových kanálů.
evoluční konzervace draslíkových kanálů
k + – selektivita, která vznikla u prokaryot, je zachována ve velkém počtu draslíkových kanálů s pozoruhodnou rozmanitostí . Jak je znázorněno na Obrázku 1, evoluční strom napětí-gated kationtový kanál nadčeleď může být navržena na základě srovnání kanál genů v lidském genomu s genomy jiných metazoans včetně myši, kuřecí maso, ryby puffer, tunicate, octomilky, komáry, hlístice a sasanky . Tento evoluční strom představuje jeden původ K+-selektivita pro vnitřně rektifikační draslíku (Kir) programy, napětí-gated draslíkové (KV) kanály, a dva-pórů draslíku (K2P) programy. Je však důležité poznamenat, že zřetelná selektivita k+je pravděpodobně spojena s evolučně konzervovaným kanálem organely K+, který se nachází v endosomech a lysozomech .
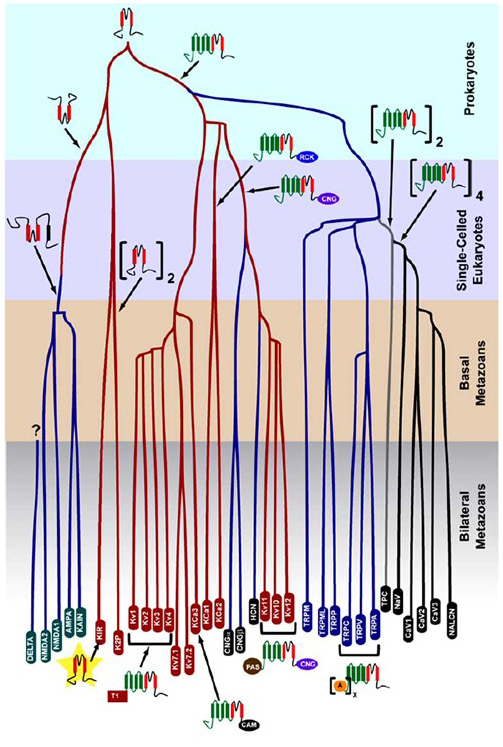
Obrázek 1. Evoluční strom pro vznik napěťově řízeného kationtového kanálu nadrodina. Na základě celogenomových analýz iontové kanály z cnidarians a bilaterální metazoans , tento evoluční strom líčí společný původ pro K+-selektivita draslíkových kanálů (s rodinou jména v červené ovály), které se vztahují k tetrameric cyklických nukleotidů řízených kation (CNG) kanálů, hyperpolarizace-gated kation (HCN) programy a TRP kanálů, dimerní TPC programy, a monomerní Na+, Ca2+, a NALCN programy. Délky větví neodrážejí čas. Rodová jména v dolní části označují jednotlivé větve. Ionotropní glutamátové receptory jsou zahrnuty na základě hypotézy, že pochází z inverze z draselných kanálů pórů-tvoří domény s dva transmembránové segmenty (červená). Doména snímače napětí má čtyři transmembránové segmenty (zelená). A: ankryin opakuje; CAM: doména vázající kalmodulin; CNG: doména vázající cyklický nukleotid; PAS: doména Per-ARNT-Sim; RCK: regulátor vodivosti domény k+; T1: tetramerizační doména.
Rozmanitost napětí-gated draslíkové kanály
lidský genom obsahuje ~80 draselného kanálu genů, z nichž 40 geny kódují napětí-gated draslíkové kanál pórů, které tvoří podjednotky, které spadají do 12 podčeledí (Obr. 2). Fyziologicky rozděleny na draslíkové kanály typu a, které vykazují rychlou inaktivaci a zpožděné usměrňovací draslíkové kanály bez rychlé inaktivace, jsou tyto KV kanály molekulárně a funkčně rozmanité. Rychlá inaktivace, která může ovlivnit dobu trvání akčního potenciálu během opakovaného odpalování, je patrná v kanálech KV1 obsahujících KV1.4 nebo kanály KVß1, KV3 a KV4 . Zpožděný usměrňovač draslíku aktuální původně vyznačuje Hodgkin a Huxley pro jeho roli v akční potenciál zřejmě odpovídá chobotnice KV1 programy, které mohou spoléhat na to, RNA pro úpravy k dosažení flexibilní funkční rozmanitost jako mnoho malých axony obří vlákna laloku neurony pojistka tvořit chobotnice obří axon s větší akční potenciál, vedení vzruchu, rychlost .
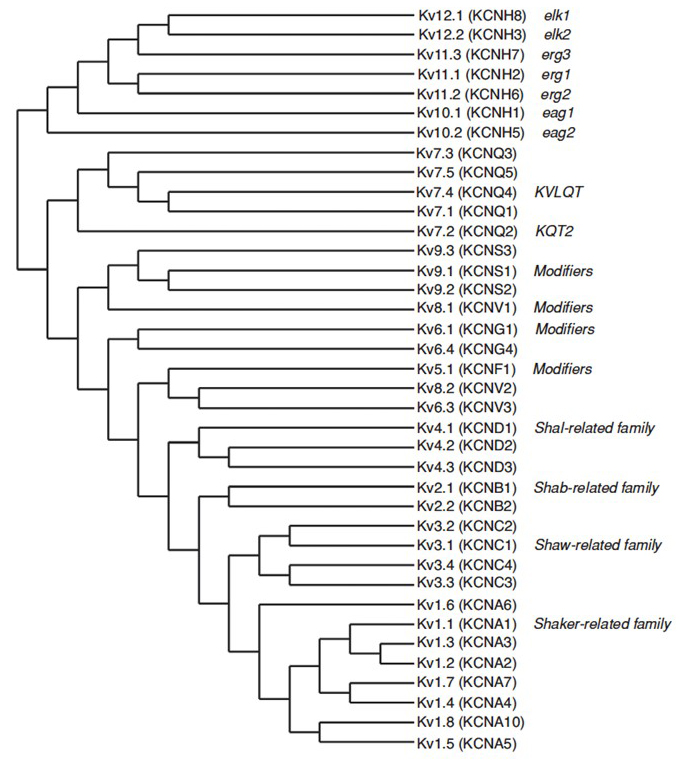
Obrázek 2. Fylogenetický strom pro rodiny KV1-12. Tento fylogenetický strom je generován na základě analýz hydrofobní domény obsahující šest transmembránových segmentů (S1-S6). Oba názvy IUPHAR a HGNC (v závorce) jsou uvedeny, spolu s dalšími běžně používanými názvy pro tyto napěťově řízené draslíkové kanály.
pozoruhodné rozmanitosti KV kanálů lze dosáhnout díky kombinaci a shodě KV kanálových podjednotek. V každé z rodin KV1, KV2, KV3, KV4 a KV7 se mohou vytvářet homomerní a heteromerní kanály s řadou funkčních vlastností . KV2 členové rodiny mohou také sestavit s KV5, KV6, KV8 nebo KV9 členy rodiny s více omezené exprese vzory v nervovém systému a hladkého svalstva , jak je znázorněno schematicky na Obr. 3.

obrázek 3. KV kanál rozmanitost přes mix a zápas pórů tvořících kanálových podjednotek. (A) tetrameric KV kanály s různými vlastnostmi a distribuce zahrnují homomeric KV1, KV2, KV3, KV4, a KV7 programy, heteromeric programy tvořeny jednotlivými členy v rámci každé z těchto KV kanálu rodiny, a heteromeric programy vytvořené sestavy z KV2 členy rodiny s KV5, KV6, KV8, nebo KV9 členy rodiny . Rodiny KV5, KV6, KV8 a KV9 dávají vznik homomerním kanálům, které jsou elektricky tiché pravděpodobně kvůli jejich zadržení v endoplazmatickém retikulu, proto jsou označovány jako KVS. (B) sestavení členů rodiny KV2 a KVS zahrnuje jejich cytoplazmatické N-A C-terminální domény. (C, D) Shromáždění KV2 a KVS členů rodiny vede k heteromeric programy s různými napětí závislost (C) a vtokové mechanismy (D) ve srovnání s homomeric kanály, vytvořené KV2 členy rodiny .
funkční rozdíly v závislosti na napětí a kinetice KV kanálů jsou základem jejich diferenciálního příspěvku k modulaci akčního potenciálu (obr. 4). Zatímco kanály KV1, KV4 a KV7 vyžadují pro svou aktivaci nízké úrovně depolarizace membrány, kanály KV2 a KV3 jsou aktivovány větší depolarizací. První, nízkonapěťové aktivované, KV kanály mohou ovlivnit práh pro generování akčního potenciálu a počet akčních potenciálů generovaných během depolarizace nebo excitačních synaptických potenciálů. Naproti tomu vysokonapěťově aktivované KV kanály mohou modulovat trvání akčního potenciálu a vzor střelby . Kinetika KV kanálů také ovlivňuje způsoby, jak přispívají k vytváření akčního potenciálu. Vzhledem k tomu, že nízké napětí aktivován KV1 kanály s rychlým aktivace může mít vliv na akční potenciál, práh a křivky, vysoké napětí aktivován KV3 programy a KV2 kanály mohou být aktivovány postupně v průběhu akčního potenciálu v důsledku rozdílu v jejich aktivační kinetiky, a KV2 programy mohou mít více dlouhodobé účinky, protože jejich pomalé kinetiky inaktivace. Navíc, KV4 kanály s rychlým inaktivace může přispívat k rozdílu akčního potenciálu křivky během opakované střelby, vzhledem k potlačení kanál KV4 činnosti depolarizace .
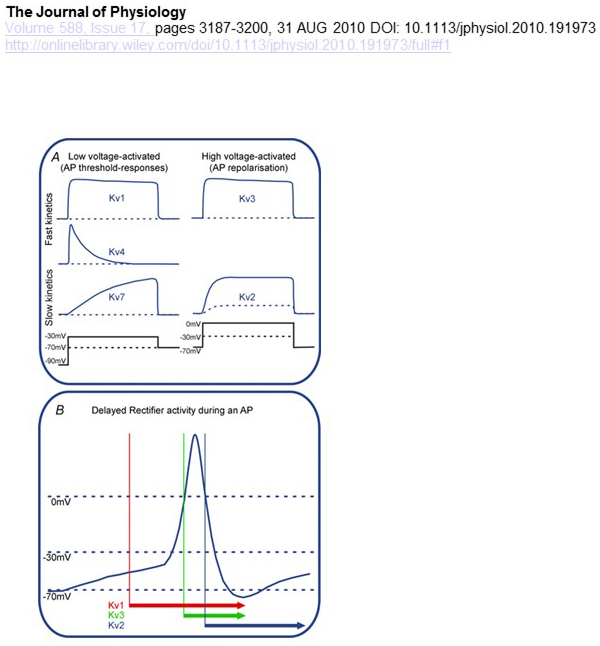
obrázek 4. Funkční rozdíly KV kanálů a jejich přínos k akčnímu potenciálu. A) různé KV kanály mají různou napěťovou závislost pro aktivaci a odlišnou kinetiku . (B) nízké napětí aktivován KV1 kanály s rychlou kinetiku otevřít jako buňky depolarizované směrem práh pro akční potenciál generace. Zatímco oba kanály KV2 a KV3 jsou aktivovány vysokým napětím, kanály KV3 se během akčního potenciálu otevírají dříve než kanály KV2. KV2 kanály mohou také trvat déle, než se uzavřou po akčním potenciálu .
Potenciální terapeutické aplikace draslíku kanál modulátory
schopnost draselného kanálu modulátory ke změně akčního potenciálu vzorů popravčí nastolil otázku, zda by mohly být terapeutickou hodnotu . Jak je uvedeno na obr. 5, různé neurologické a psychologické poruchy mohou zahrnovat změny ve vzorcích střelby akčního potenciálu, které by mohly být modulovány aktivátory a blokátory KV kanálu . Napěťově řízené draslíkové kanály mohou také hrát roli v buněčné proliferaci a migraci; Modulátory kanálů KV byly proto zvažovány pro potenciální léčbu růstu rakoviny a metastáz . Na Obr. 6, KV1.2 kanál se používá struktura schematicky ilustrovat, že KV kanál modulátory mohou inhibovat kanálu aktivity, buď tím, že umístím kanálu propustnost dráhy, stejně jako v případě vnější-pórů-blokuje toxiny, a vnitřní pórů blokátory, nebo prostřednictvím jejich interakce s napětím snímač stabilizovaný v uzavřeném stavu kanálu, stejně jako v případě vtokové modifikátor toxiny. Alternativně, některé malé molekuly působí prostřednictvím vazby na vtokové stroje jako vtokové modifikátory, nebo v interakci s rozhraní mezi α – a β-podjednotek změnit kanál aktivitu .
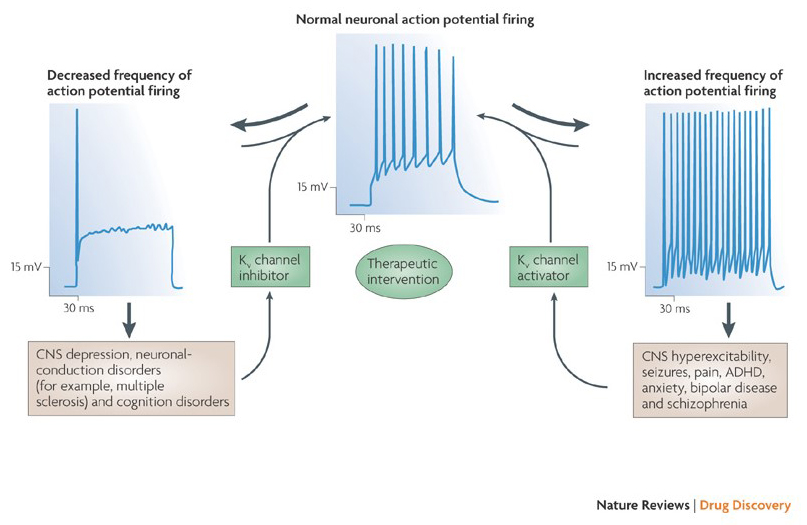
obrázek 5. Potenciální aplikace modulátorů KV kanálů. Protože abnormální akční potenciál střílet vzory byly spojeny s nemocí, jako je epilepsie a roztroušené sklerózy, KV kanál aktivátory a inhibitory byly považovány za potenciální terapeutické léčby nemocí, které zahrnují změny neuronální dráždivost .
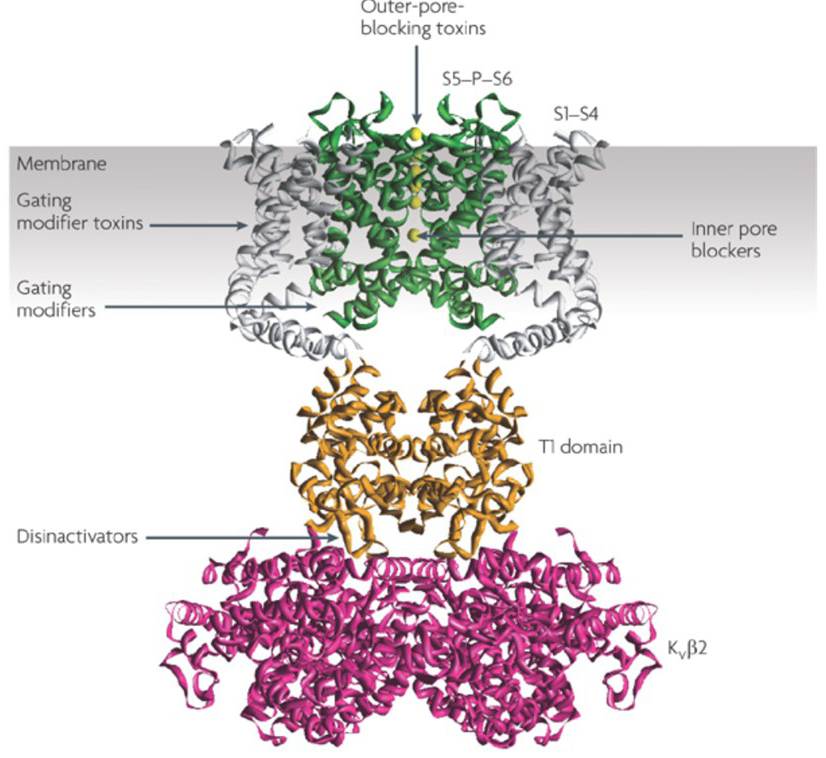
obrázek 6. Příklady způsobů působení modulátorů KV kanálů. Existuje několik různých způsobů, jak peptidové toxiny a malé molekuly modulovat aktivitu KV kanálu. Na KV1.2 struktura je znázorněna s pórové domény (S5-P-S6) v zelené, napětí snímače domén (S1-S4) v šedé, T1 tetramerization domén v oranžové, a KVß2 pomocné podjednotky v purpurové barvě . Toxiny blokující vnější póry ze škorpiónů, mořské sasanky, hadi, a kuželové hlemýždi se mohou vázat na vnější vestibul a blokovat pronikání iontů. Gating modifikátor toxiny z pavouků, jako je hanatoxin může interagovat se snímačem napětí pro zvýšení stability uzavřeného stavu, což způsobuje posunutí křivky závislosti napětí pro aktivaci kanálu doprava. Tam jsou také malé molekuly kanál modulátory, které se vážou na vnitřní kapilární (vnitřní pórů blokátory), vtokové panty (hradlování modifikátory), nebo rozhraní mezi α – a β-podjednotek (disinactivators) .
napěťově řízených draslíkových kanálů struktura
pozoruhodné selektivity draslíkových kanálů, což umožňuje K+ ionty procházejí kanálem pórů s řádově větší lehkostí než menší ionty Na+ a s téměř diffusion-limited rate , připadá na schopnost páteř carbonyls selektivity filtru pro koordinaci K+ ionty, které jsou do značné míry zbaven jejich hydrataci skořápky , tak, že více než jedna K+ ion se bude pohybovat přes to nejužší část póru v tandemu (Obr. 7) – dlouhý pór pro permeaci jednoho souboru k + iontů, jak je predikováno .
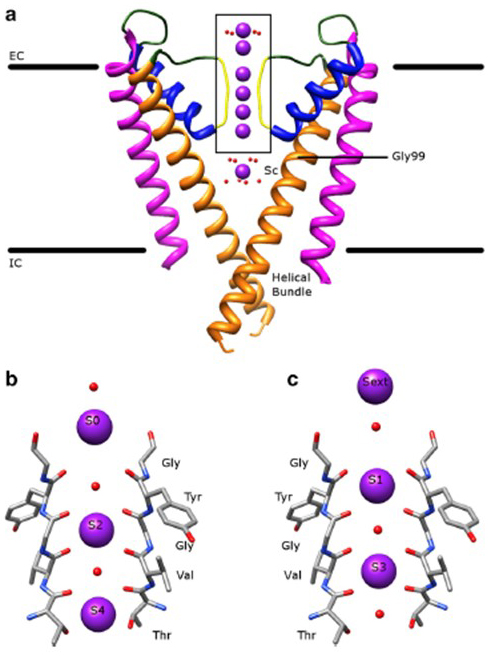
Obrázek 7. Pórová doména draslíkových kanálů. (a) struktura KcsA ve vodivém stavu (PDB: 1K4C), s vnějšími šroubovice v purpurové, vnitřní šroubovice v oranžové, pórové šroubovice v modré a selektivní filtr ve žluté. Ionty K+ jsou fialové, zatímco okolní molekuly vody jsou červené. EC: extracelulární; IC: intracelulární. (b, c) selektivita filtru v krabicové regionu KcsA struktura je znázorněna s K+ ionty zabírat buď S2 a S4 pozice (b) nebo S1 a S3 pozice (c), pro ilustraci K+ iontů prostupnost v jediném souboru .
napěťová závislost aktivace KV kanálu je odvozena z jejich domén senzorů napětí . Jak je znázorněno na obr. 8, KV programy a související programy, jako napěťově řízených sodíkových kanálů a TRPV1 kanály ve stejné nadčeledi mají podobné uspořádání jejich pórů domén a napětí snímače domén. Napětí snímače domény z jednoho podjednotka interaguje s pórové domény sousední podjednotky v doméně swap konfigurace, a v napětí snímače kladně nabité zbytky argininu na S4 mohou interagovat s negativně nabitými kyselými zbytky v sousedních spirál (Obr. 9).
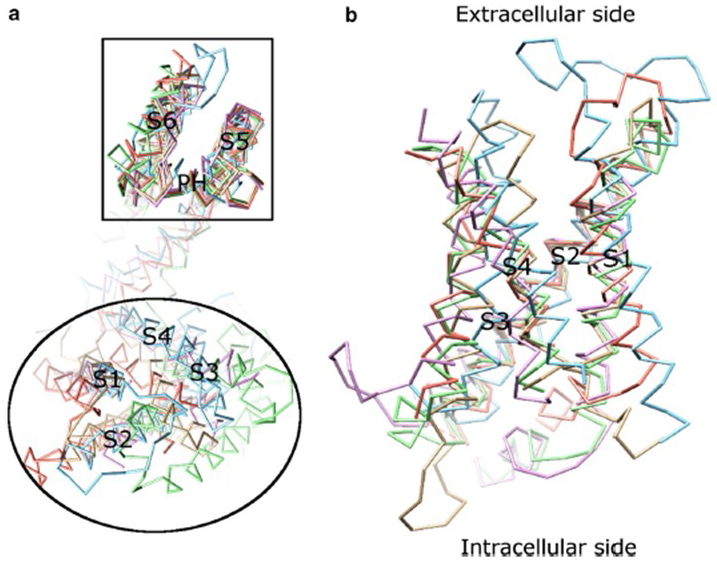
Obrázek 8. Napěťová senzorová doména napěťově řízených draslíkových kanálů. (a) zarovnání domény pórů (S5-P-S6) různých iontových kanálů ukazuje, že jejich domény senzorů napětí (S1-S4)mohou nabývat různých orientací (při pohledu z extracelulární strany). (b) Superpozice napětí snímače domény KV1.2 (PDB: 3LUT, světle purpurová) s napětí snímače domény MlotiK1 (PDB: 3BEH, světle hnědá) , Nawab (PDB: 3RVY, světle zelená) , NaVRh (PDB: 4DXW, světle oranžová) a TRPV1 (PDB: 3J5P, světle modrá) (z pohledu membrány) .
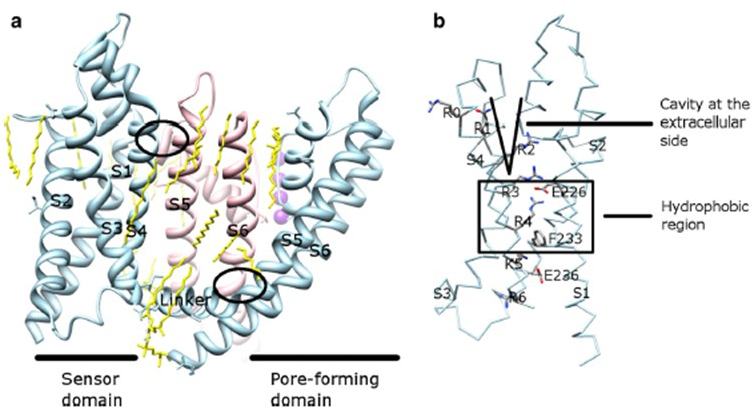
obrázek 9. Kontakty mezi doménou pórů a doménou snímače napětí KV kanálů. (a) chiméra KV1.2-KV2.1 (PDB: 2R9R) s doménou snímače napětí jedné podjednotky (Světle modrá) kontaktující doménu pórů sousední podjednotky (růžová). Kontakty na intracelulární straně zahrnují interakci linker S4-S5 se S6 a kontakty na extracelulární straně zahrnují interakci mezi S1 a šroubovice pórů . Lipidy (žluté) obklopující kanál a mezi doménou pórů a doménou snímače napětí jsou detekovatelné v krystalové struktuře. b) bazické zbytky S4 a kyselé zbytky v jejich blízkosti v doméně snímače napětí .
Channelopathies spojena s Napětí-gated draslíkové kanály
Napětí-gated draslíkové kanály jsou obecně vyjádřeny v různých tkáních. V neuronech jsou zaměřeny na různé subcelulární kompartmenty (obr. 10) a kanály různých podjednotkových kompozic mohou být přítomny v různých subpopulacích neuronů . Mutace genů kanálu KV mohou způsobit neurologická onemocnění, jako je epizodická ataxie a epilepsie, srdeční choroby a hluchota . Evoluční zachování funkce KV kanálu je patrné například z podobných pohybových poruch způsobených mutací KV1 ortologů u člověka, myši a octomilky .
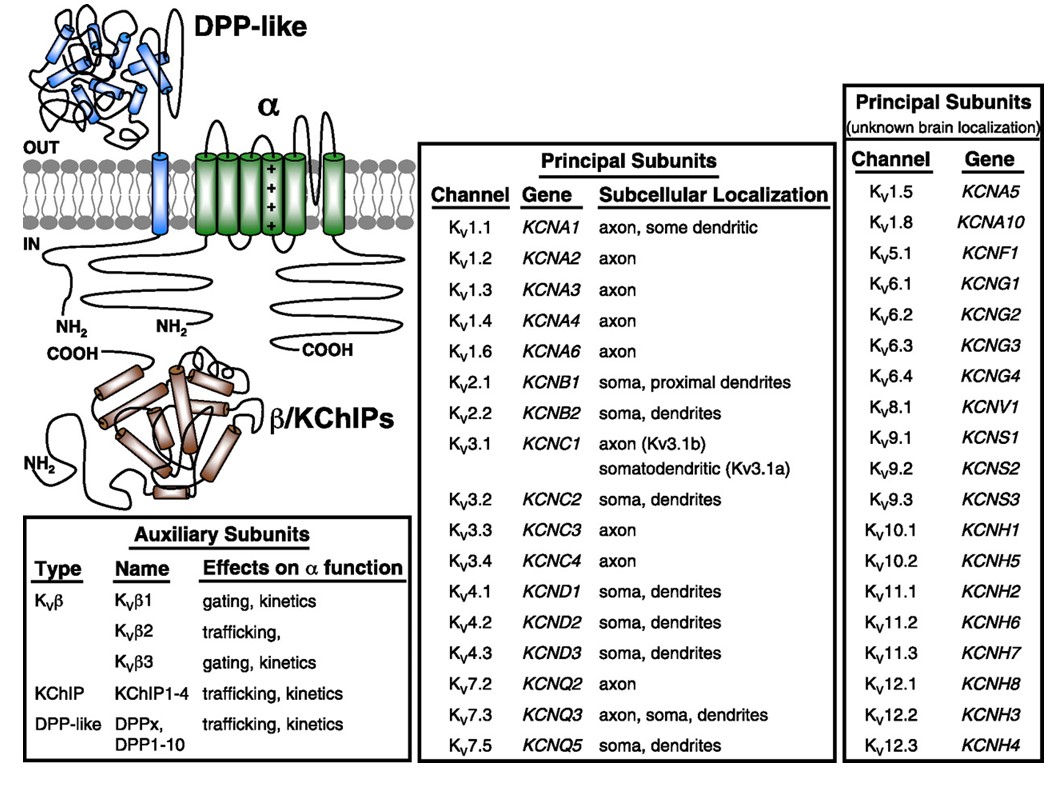
obrázek 10. Subcelulární distribuce napěťově řízených draslíkových kanálů. Schéma vlevo nahoře zobrazuje kanál KV4 se dvěma různými pomocnými podjednotkami. Subcelulární lokalizace různých KV kanálů v savčích centrálních neuronech je uvedena ve středním poli .
odkazy a poznámky
1.Hille, B., iontové kanály excitabilních membrán, 3., ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K (+) kanály: Funkce-strukturální přehled. Compr Physiol, 2012. 2(3): s. 2087-149.
3.Vacher, H., D. P. Mohapatra a J. S. Trimmer, lokalizace a cílení napěťově závislých iontových kanálů v savčích centrálních neuronech. Physiol Rev, 2008. 88 (4): s. 1407-47.
4.Jegla, T. J. a kol., Vývoj množiny lidských iontových kanálů. Comb Chem High Throughput Screen, 2009. 12(1): s. 2-23.
5.Cang, C., et al., TMEM175 je organela k (+) kanál regulující lysozomální funkci. Cela, 2015. 162 (5): s. 1101-12.
6.Hodgkin, a. L. A A. F. Huxley, proudy nesené ionty sodíku a draslíku přes membránu Obřího axonu Loligo. Jaroslav, 1952. 116 (4): s. 449-72.
7.Rosenthal, J. J., T. I. Liu a W. F. Gilly, rodina zpožděných usměrňovačů KV1 cDNA vykazující expresi specifickou pro buněčný typ v komplexu chobotnice stellate ganglion / giant fiber lalok. Jaromír Jágr, 1997. 17 (13): s. 5070-9.
8.Young, J. Z., fúzované neurony a synaptické kontakty v obřích nervových vláknech hlavonožců. Phil Trans R Soc Lond B, 1939. 229: s. 465-503.
9.Rosenthal, J. J. A F. Bezanilla, rozsáhlá editace mRNA pro olihně zpožděný usměrňovač k + kanál reguluje tetramerizaci podjednotky. Neuron, 2002. 34 (5): s. 743-57.
10.Jan, L. Y. a Y. N. Jan, napěťově řízené draslíkové kanály a rozmanitost elektrické signalizace. Jaromír Jágr, 2012. 590 (11): s. 2591-9.
11.Johnston, J., I. d. Forsythe a C. Kopp-Scheinpflug, nativní: napěťově řízené draslíkové kanály ovládající excitabilitu neuronů. J Physiol, 2010. 588 (bod 17): s. 3187-200.
12.Bocksteins, e., KV5, KV6, KV8 a KV9 podjednotky: žádné jednoduché tiché přihlížející. J Gen Physiol, 2016. 147 (2): s. 105-25.
13.Wulff, h., N. A. Castle a L. A. Pardo, napěťově řízené draslíkové kanály jako terapeutické cíle. Nat Rev Drug Discover, 2009. 8 (12): s. 982-1001.
14.Bates, E., Iontové kanály ve vývoji a rakovině. Annu Rev Cell Dev Biol, 2015. 31: 231-47.
15.Huang, X. a L. Y. Jan, zaměřující se na draslíkové kanály v rakovině. Jiří Biol, 2014. 206(2): s. 151-62.
16.Huang, X. a kol., EAG2 draselný kanál s evolučně konzervovanou funkcí jako cíl nádoru na mozku. Nat Neurosci, 2015. 18 (9): s. 1236-46.
17.Kunzelmann, k., iontové kanály a rakovina. J Membr Biol, 2005. 205(3): s. 159-73.
18.Li, M. A Z. G. Xiong, iontové kanály jako cíle pro léčbu rakoviny. Int J Physiol Patophysiol Pharmacol, 2011. 3(2): s. 156-66.
19.Pardo, L. A., Napěťově řízené draslíkové kanály v buněčné proliferaci. Fyziologie (Bethesda), 2004. 19: s. 285-92.
20.Urrego, D., et al., Draslíkové kanály v buněčném cyklu a proliferace buněk. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): s. 20130094.
21.Zhou, y. a kol., Chemie iontové koordinace a hydratace odhalená komplexem k + channel-Fab v rozlišení 2.0 a. Příroda, 2001. 414 (6859): s. 43-8.
22.MacKinnon, R., draslíkové kanály. FEBS Lett, 2003. 555 (1): s. 62-5.
23.Kuang, Q., P. Purhonen a H. Hebert, struktura draslíkových kanálů. Cell Mol Life Sci, 2015. 72 (19): s. 3677-93.
24.Isacoff, E. Y., L. Y. Jan, a D. L. Minor, Jr., Potrubí životní jiskra: pohled na iontový kanál výzkum od narození neuron. Neuron, 2013. 80(3): s. 658-74.
25.Swartz, K. J., snímání napětí přes lipidové membrány. Příroda, 2008. 456 (7224): s. 891-7.
26.Nusser, z., diferenciální subcelulární distribuce iontových kanálů a rozmanitost neuronálních funkcí. Curr Opin Neurobiol, 2012. 22(3): s. 366-71.
27.Lujan, R., organizace draslíkových kanálů na povrchu neuronů. J Chem Neuroanat, 2010. 40(1): s. 1-20.
28.Abriel, H. A E. v. Zaklyazminskaya, srdeční kanálpatie: genetické a molekulární mechanismy. Gene, 2013. 517 (1): s. 1-11.
29.Kullmann, D. M. a. M. G. Hanna, Neurologické poruchy způsobené zdědil ion-channel mutace. Lancet Neurol, 2002. 1(3): s. 157-66.
30.Lehmann-Horn, F. A K. Jurkat-Rott, napěťově řízené iontové kanály a dědičné onemocnění. Physiol Rev, 1999. 79 (4): s. 1317-72.
31.Villa, C. A R. Combi, draslíkové kanály a lidské epileptické fenotypy: aktualizovaný přehled. Neurosci Předních Buněk, 2016. 10: 81.
32.Long, S. B., E. B. Campbell a R. Mackinnon, krystalová struktura savčí napěťově závislé rodiny třepaček k + kanál. Věda, 2005. 309 (5736): s. 897-903.
33.Chen, X. a kol., Struktura full-délka Shaker draslíkového kanálu KV1.2 v normálním režimu-based X-ray krystalografické upřesnění. Proc Natl Acad Sci U S A, 2010. 107 (25): s. 11352-7.
34.Clayton, G. M., et al., Struktura transmembránových oblastí bakteriálního cyklického nukleotidy regulovaného kanálu. Proc Natl Acad Sci U S A, 2008. 105 (5): s. 1511-5.
35.Payandeh, J., et al., Krystalová struktura napěťově řízeného sodíkového kanálu. Příroda, 2011. 475 (7356): s. 353-8.
36.Zhang, X. a kol., Krystalová struktura orthologa napěťově řízeného sodíkového kanálu NaChBac. Příroda, 2012. 486 (7401): s. 130-4.
37.Liao, m. a kol., Struktura TRPV1 iontového kanálu určená elektronovou kryo-mikroskopií. Příroda, 2013. 504 (7478): s. 107-12.
38.Long, S. B., et al., Atomová struktura napěťově závislého k + kanálu v prostředí podobném lipidové membráně. Příroda, 2007. 450 (7168): s. 376-82.