Úvod
Peyronieho choroba (PD) je lokalizovaná, hojení ran, porucha pojivové tkáně penisu vyznačuje zjizvení tunica albuginea. Tato vláknitá nepružná jizva vede k bolesti penisu, deformitě penisu a erektilní dysfunkci (ED) s obtížemi při provádění soulože. Francois de La Peyronie poprvé popsal stav v roce 1743, když byl chirurgem Ludvíka XIV Francie. I když dřívější studie uvádějí výskyt 0,3–0,7%, a nedávné publikace ukázaly, celkový výskyt 3.2–8.9%, s více než 75% případů vyskytuje u mužů mezi 45 a 65 let (1,2). Je třeba poznamenat, že u 10% pacientů dochází k nástupu příznaků před 40 lety (2). Dále, výskyt PD po radikální prostatektomii je údajně stejně vysoká jako o 15,9%, a nedávná studie ukázala, že zakřivení penisu je běžný nález (38.6%) v době, nafukovací penilní protézy implantace operace pro ED po léčby rakoviny prostaty (3,4).
léčba PD začíná zaměřenou historií a fyzickým vyšetřením. Podrobná historie by měla posoudit informace o nástupu a trvání onemocnění, související traumatické etiologii, stupni zakřivení penisu, ztrátě délky během erekce a subjektivní úrovni sexuální funkce. S ohledem na subjektivní sexuální hodnocení, standardizované dotazníky, např. Mezinárodní Index Erektilní Funkce (IIEF) umožňují objektivní a subjektivní počáteční hodnocení a nástroj pro měření účinnosti během léčby. Fyzikální vyšetření genitourinárního systému by mělo zahrnovat délku penisu při natažení, umístění plaku a velikost. Stupeň zakřivení může být hodnocen pacientem, který fotografuje vztyčený falus nebo vazoaktivními injekcemi v kombinaci s duplexním dopplerovským ultrazvukem.
pochopení přirozené historie a patogeneze PD je důležité pro výběr vhodných léčebných režimů. Zatímco patofyziologie není zcela pochopena, předpokládá se, že podněcující událostí je subklinická traumatická slza na tunica albuginea. Slza vede k proliferativní fibrotické reakci, která vede k nepružné jizvě. Léčba PD je rozdělena na ty v akutní fázi a na ty v chronické stabilizační fázi. Doba akutní fáze je volně definována jako méně než 12 měsíců od nástupu příznaků. Během této doby se jizva pacienta stále mění a mění. Chronická fáze se stanoví, jakmile zakřivení pacienta zůstane stabilní po dobu nejméně 6 měsíců. Zatímco chirurgická léčba zůstává zlatým standardem pro PD, je většinou nabízena mužům v chronické fázi onemocnění. U pacientů v akutní fázi poskytuje farmakoterapie potenciál ke zlepšení funkce, snížení deformity a stabilizaci progrese jizev (5). Zde přezkoumáváme aktuální dostupné znalosti týkající se možností perorální léčby PD. Je důležité si uvědomit, že zatímco některá uvedená doporučení jsou založena na zjištěních založených na důkazech; ostatní zrcadlí názor odborníka (Tabulka 1).

Plné tabulky
Draslíku para-aminobenxoate (POTABA)
POTABA je sloučenina, známý pro jeho antifibrotic a anti-pobuřující vlastnosti, které pomáhají při léčbě fibrózní poruchy, jako dermatomyozitida a sklerodermie. Předpokládá se, že jeho účinnost je způsobena snížením tvorby kolagenu snížením hladin serotoninu, zvýšením aktivity monoaminooxidázy a inhibicí sekrece fibroblastů glykosaminoglykanu (6). První navrhované použití přípravku POTABA k léčbě PD bylo v roce 1959 Zarafonetisem a Horraxem (7). V roce 2005 Weidner et al. provádí multi centrum, randomizované, dvojitě zaslepené, placebem kontrolované studii POTABA (51 pacientů) v porovnání s placebem (52 pacientů) v léčbě dosud neléčených PD pacientů s non-kalcifikované plaku. Zkušební rameno dostalo 3 g POTABA perorálně, 4krát denně po dobu 12 měsíců. Po 12 měsících došlo u pacientů užívajících přípravek POTABA k významnému zlepšení velikosti plaku penisu ve srovnání s pacienty užívajícími placebo. U pacientů užívajících placebo bylo navíc zjištěno zhoršení jejich zakřivení. Autoři dospěli k závěru, že POTABA může pomoci při stabilizaci jizvy, což by zabránilo progresi zakřivení (6). Nebyly provedeny žádné další randomizované kontrolní studie k vyhodnocení účinnosti přípravku POTABA. To je možná způsobeno jeho profilem vedlejších účinků, který zahrnuje gastrointestinální potíže, průjem, akutní hepatitidu a hypoglykémii (8).
Vitamin E
Vitamin E, tuk-rozpustný antioxidant, inaktivuje volné radikály, které nasycení dusnatého (no), a tím udržet aktivní ŽÁDNÉ úrovně zvýšené umožnit správné hojení ran. Omezením oxidačního stresu nabízí potenciálně také protizánětlivý účinek. Poprvé byl popsán pro léčbu PD v roce 1948 (9) a vzhledem ke své nízké ceně a dostupnosti zůstává nejčastěji předepsaným perorálním přípravkem pro PD (10). I přes jeho použití v průběhu posledních sedmi desetiletích více placebem kontrolovaných návrhy nebyly zjištěny žádné významné zlepšení bolesti, stupeň zakřivení, deska velikost, nebo schopnost mít pohlavní styk. V roce 1983 Pryor a Farrell dokončili dvojitě zaslepenou, placebem kontrolovanou studii vitaminu E u 40 pacientů s PD a nezjistili žádné významné zlepšení velikosti plaku nebo zakřivení penisu (11). Dále novější studie v roce 2007 od Safarinejad et al. poskytl dosud největší studii hodnotící vitamín E pro PD. Autoři oproti vitaminu E, samotného nebo v kombinaci s L-karnitinu s placebem v 236 mužů s časným chronické PD; klasifikován jako pacient s bolestí během erekce, zakřivení penisu není narušuje vaginální penetrace, non-bolestivé hmatatelná jizva, hyperechogenní léze na penisu ultrazvuk, absence kalcifikace, a celkem plaku oblasti <2 cm2. Skupina 1 (58 mužů) dostávala vitamín E 300 mg perorálně dvakrát denně. Skupina 2 (59 mužů) dostávala propionyl-L-karnitin, 1 g perorálně dvakrát denně. Skupina 3 (60 mužů) dostávala vitamín E 300 mg perorálně dvakrát denně a propionyl-L-karnitin 1 g perorálně dvakrát denně. Nakonec skupina 4 dostávala podobný režim placeba během 6měsíčního zkušebního období. Po terapii, tam byl žádné významné změny v snížení zakřivení penisu mezi čtyřmi skupinami (P=0.9), ani žádné snížení plaku velikost (P=0.1) (12).
navzdory nedostatku důkazů prokazujících účinnost vitaminu E je stále často předepisován a často podáván souběžně s jinými způsoby léčby s nadějí na synergickou roli. Mezi běžné nežádoucí účinky užívání vitaminu E patří nevolnost, zvracení, průjem a zvýšené riziko rakoviny prostaty a cerebrovaskulárních příhod (13).
kolchicin
přestože je kolchicin většinou známý pro léčbu dny, vykazuje také vlastnosti, které pomáhají při léčbě PD. Kolchicin depolymeruje tubulin, čímž inhibuje buněčnou mitózu, adhezi leukocytů a transport kolagenu. Při použití této vlastnosti by měl kolchicin teoreticky snížit kontrakci rány inhibicí ukládání kolagenu (14). Většina studií hodnotících kolchicin popsali některé zlepšení v zakřivení, ale tyto studie nebyly randomizované, ani se poskytovat objektivní měření pro definici zlepšení. Safarinejad et al. jako jeden z mála studií, které hodnotí léčebné účinky kolchicin vyplněním jednoho centra, randomizované, dvojitě zaslepené, placebem kontrolované studii 84 PD pacientů bez kalcifikované plaky (15). Pacienti v rameni s kolchicinem byli léčeni 0, 5-2, 5 mg kolchicinu denně po dobu 4 měsíců. Na konci studie skupina kolchicinů neprokázala objektivní zlepšení zakřivení penisu nebo velikosti plaku. Jiné studie hodnotily synergické účinky kolchicinu s vitamínem E. Prieto Castro et al. hlášeno významné zlepšení velikosti plaku a zakřivení penisu u pacientů užívajících denní vitamín E a kolchicin ve srovnání se samotným ibuprofenem (16). Je třeba poznamenat, že v této studii bylo pouze 45 pacientů a neexistovalo rameno s placebem. Nicméně, následné retrospektivní studii se 100 muži vystaveny žádné statisticky významné rozdíly v účinnosti pro úlevu od bolesti, zakřivení penisu, nebo deska velikost mezi a kolchicin kolchicin v kombinaci s vitaminem E (17).
Tamoxifen
Tamoxifen je nesteroidní antagonista estrogenového receptoru. V léčbě PD, bylo prokázáno, že snižují fibrogenesis v tunica albuginea přes modulaci uvolňování TGF-β propuštěn z fibroblastů (18). Ralph et al. nejprve navrhl jeho léčbu v roce 1992 v důsledku nekontrolované studie, která prokázala zlepšení deformity penisu u 11 z 31 mužů. Nicméně, tyto nálezy nebyly reprodukovatelné, když tamoxifen byl hodnocen v prospektivní, placebem kontrolované studii u 25 pacientů s PD bez kalcifikované plaky. Navzdory použití 20 mg tamoxifenu dvakrát denně nedošlo ve srovnání s placebem k významnému zlepšení bolesti, zakřivení nebo velikosti plaku (19).
Karnitin
Karnitin je inhibitor acetyl koenzym-A, která umožňuje snížení tvorbě volných radikálů během buněčného stresu. V roce 2001 Biagiotti et al. provedl randomizovanou studii 96 pacientů s PD na L-karnitin versus tamoxifen. Výsledky ukázaly významné zlepšení zakřivení penisu ve skupině L karnitinu (20). Jak bylo zmíněno výše, Safarinejad 2007 4-paže soudu (vitamín E, karnitin, vitamin E a karnitinu, a placebo) ukázal žádné významné zlepšení v zakřivení penisu, deska velikost, nebo bolest (12).
Omega 3 mastná kyselina
podobně jako u jiných perorálních látek byly omega-3 mastné kyseliny hodnoceny při léčbě PD kvůli svým známým protizánětlivým vlastnostem. V roce 2009, Safarinejad et al. publikovali své výsledky na prospektivní, randomizované dvojitě zaslepené omega-3 mastné kyseliny versus placebo studie. Celkem 224 pacientů s časným chronickým stadiem PD bylo randomizováno do 1.84 g denní suplementace omega-3 versus placebo po dobu 6 měsíců. Pacienti byli hodnoceni pomocí IIEF-5 a PDDU před a po 6 měsících léčby. Bohužel nedošlo k významnému zlepšení, pokud jde o objem plaku, zakřivení penisu, bolest během erekce a erektilní funkci (21). V současné době chybí údaje na podporu příznivého účinku suplementace omega-3 v časném chronickém stadiu PD.
Prokarbazin
Prokarbazin je alkylační chemoterapie lék se často používá k léčbě CNS lymfom, Hodgkinův lymfom, a high-grade gliomy. V roce 1968 Aron et al. poznamenal regresi Dupuytrenovy choroby u pacientů podstupujících léčbu Hodgkinovy choroby prokarbazinem, což naznačuje jeho použití u onemocnění s proliferací pojivové tkáně (22). S tímto předpokladem navrhl Byström v sedmdesátých letech prokarbazin pro léčbu PD, ale následné studie neodhalily žádný objektivní přínos. Kromě toho studie odhalily významné vedlejší účinky cytotoxických léků a bylo doporučeno nepoužívat při benigním onemocnění PD. Nežádoucí účinky zahrnují myelosupresi, hepatotoxicitu, únavu, GI úzkost a poruchy CNS (23,24).
inhibitory Fosfodiesterázy typu 5 (PDE-5 inhibitory)
i když PDE-5 inhibitory jsou obyčejně myšlenka jako lék na ED, nedávné studie ukázaly, jeho potenciální využití v léčbě PD se u pacientů s nebo bez ED. Inhibitory PDE-5 zvyšují cyklický guanosin monofosfát (cGMP) inhibicí degradace cGMP na GMP. Se zvýšením cGMP a NO se inhibuje syntéza a depozice kolagenu a dochází k apoptóze fibroblastů a myofibroblastů (25). Díky této vlastnosti se inhibitory PDE-5 mohou ukázat jako výhodné pro remodelaci jizev. U potkaního modelu PD bylo prokázáno, že sildenafil způsobuje významné snížení poměru kolagenu k fibroblastům v tunica albuginea a také velikost plaku (25). Chung a jeho kolegové studují použití tadalafilu k léčbě PD u lidských subjektů. Uvedli, že 2.5 mg tadalafilu denně po dobu 6 měsíců vedlo k ústupu septální jizvy u 69% (24/35) pacientů bez hmatného plaku penisu. Pouze 10% neléčeného ramene zaznamenalo rozlišení jizvy. Je důležité zmínit, že septální jizva nebyla klinicky hmatatelná a většina pacientů v této studii neměla zakřivení (26). Nedávno studie z roku 2014 uváděla výsledky léčby pacientů s PD užívajících 50 mg sildenafilu denně nebo 400 IU vitaminu E po dobu 3 měsíců. Po 12 týdnech vykazovaly obě skupiny podobné snížení objemu plaku a zakřivení penisu, které bylo statisticky významné. Rozdíly mezi oběma skupinami však nebyly statisticky významné. Kohorta sildenafilu vykazovala statisticky významné zlepšení skóre IIEF a snížení bolesti ve srovnání se samotným vitamínem E (27). Rozsáhlé dvojitě zaslepené placebo studii by bylo třeba udělat a ověřit klinický přínos inhibitor PDE-5, ale současný výzkum je slibný (Tabulka 2).
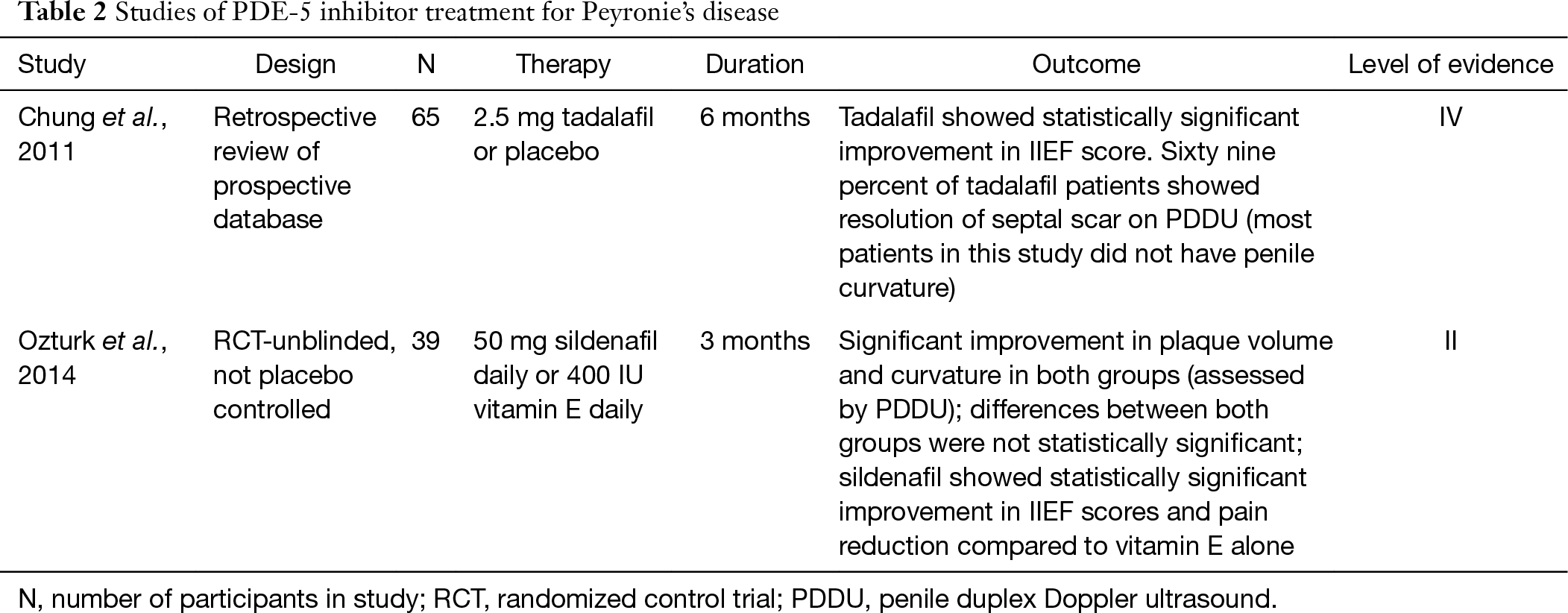
Plné tabulky
L-arginin
L-arginin je NE předzvěst, že stimuluje syntázu. To způsobuje zvýšení NO, stejně jako snížení fibroblastů v důsledku apoptózy. Tyto dvě vlastnosti jsou považovány za mechanismy za L-argininem jako antifibrotickým činidlem (25). Jak již bylo zmíněno, Valente et al. hodnocené penilní plaky u potkaních modelů léčených inhibitory PDE-5, ale také l-argininem. Podobně jako inhibitory PDE-5 vykazoval L-arginin významné snížení velikosti plaku a také poměr kolagenu k fibroblastům (25). Pozdější studie Medeiros et al. prokázal, že arginin má také ochranný účinek proti tvorbě jizev při podání penisu potkanů pánevnímu záření (28). V roce 2012 abern et al. zaznamenali tendenci k zakřivení zlepšení v PD pacientů léčených penisu trakční terapie ve spojení s intralezionální verapamil, oral L-arginin a příjmu pentoxifylin (PTX) (29). I když tato studie má řadu proměnných, které by mohly přispět ke zlepšení zakřivení, ukázalo se, že je to jedna z mála lidských studií, ve kterých byl L-arginin použit k léčbě PD. Vzhledem k těmto zjištěním se L-arginin může ukázat jako cenná možnost léčby PD, ale jsou zapotřebí další studie na lidech.
Pentoxifylin (PTX)
i když většina z ústní léky zkoumány pro léčbu PD ukázaly, chudí nebo neurčitých výsledků v kontrolovaných studiích, PTX se dařilo mnohem lépe. PTX je derivát xanthinu, který funguje jako nespecifický inhibitor fosfodiesterázy se známými protizánětlivými a antifibrogenními vlastnostmi (30). Bylo navrženo pro léčbu PD vzhledem k in vitro studie ukazuje, zabraňuje tunica albuginea proliferaci fibroblastů, zmírňuje TGF-B zprostředkované depozice kolagenu, snižuje ukládání elastinu, a zvyšuje fibrinolytickou aktivitu (31-33). Vzhledem k těmto vlastnostem se dvojitě zaslepená placebem kontrolovaná studie z roku 2010 snažila určit účinek PTX u pacientů s časnou chronickou PD (30). Dvě stě dvacet osm pacientů bylo randomizováno 400 mg PTX s prodlouženým uvolňováním oproti placebu po dobu 6 měsíců. Většina účastníků selhala alespoň jedna předchozí léčba PD. Ve skupině s placebem byla 4krát vyšší pravděpodobnost (42%) progrese onemocnění ve srovnání s léčebným ramenem (11%). Kromě toho, PTX skupina ukázala významné zlepšení v obou objektivních a subjektivních opatření; (I) zlepšení v zakřivení penisu měřeno duplexní ultrazvuk před a po desátníku injekce prostaglandinu E1; (II) objem plaku a (III) IIEF skóre (30). Více nedávné studie hodnotí ústní PTX ve spojení s ústní antioxidanty, intralezionální PTX a intralezionální verapamil s různými výsledky (34,35). Zatímco PTX zůstává silným konkurentem pro léčbu PD, bude nutné uzavřít další velké multicentrické studie, aby se zajistilo, že výsledky budou reprodukovatelné (Tabulka 3).

Plné tabulky
Závěry
i Přes desetiletí PD výzkumu, definitivní etiologie a patofyziologie nebyly zcela objasněny. Zatímco chirurgická léčba zůstává zlatým standardem pro chronickou těžkou PD, existuje nesčetné množství dalších méně invazivních možností léčby, jmenovitě orální a intralezionální léky. Zde jsme přezkoumali většinou běžně předepsané nebo diskutované perorální látky pro léčbu PD. Ačkoli řada dobře navržených studií objevila pozitivní odpovědi s perorálními léky, jejich malá velikost vzorku omezuje sílu a reprodukovatelnost studie. V současné době, Americké Urologické Asociace pokyny státní lékaři by neměli nabízet perorální terapie vitaminem E, tamoxifen, omega-3 mastné kyseliny, nebo kombinaci vitaminu E s L-karnitinu. Podobně, v roce 2010 Mezinárodní Konzultace o Sexuální Medicíně nepodporují rutinní klinické použití perorální přípravky pro PD (5). Dva perorální léky, které nejsou omezeny pokyny, jsou inhibitory PDE-5 a PTX. K určení jejich účinnosti je zapotřebí další výzkum PDE-5 a PTX, který zahrnuje velké multicentrické dvojitě zaslepené randomizované kontrolní studie. Obě třídy léků dávají naději na absenci povolených perorálních léků pro léčbu PD.
Potvrzení
Žádné.
poznámka pod čarou
střety zájmů: autoři nemají žádný střet zájmů vyhlásit.
- Mulhall JP, Creech SD, Boorjian SA, et al. Subjektivní a objektivní analýza prevalence Peyronieho choroby v populaci mužů prezentujících screening rakoviny prostaty. J Urol 2004; 171: 2350-3.
- Mulhall JP, Schiff J, Guhring P. analýza přirozené historie Peyronieho choroby. J Urol 2006;175: 2115-8; diskuse 2118.
- Tal R, Heck M, Teloken P, et al. Peyronieho choroba po radikální prostatektomii: incidence a prediktory. J Sex Med 2010; 7: 1254-61.
- Lin H, Alba F, Romero C, et al. 1815 zakřivení penisu je běžným nálezem při implantaci penilní protézy u pacientů s erektilní dysfunkcí po radikální prostatektomii. J Urol 2011; 185: e728-e729.
- Ralph D, Gonzalez-Cadavid N, Mirone V, et al. Řízení Peyronieho choroby: pokyny založené na důkazech z roku 2010. J Sex Med 2010; 7: 2359-74.
- Weidner W, Hauck EW, Schnitker J, et al. Paraaminobenzoát draselný (POTABA) v léčbě Peyronieho choroby: prospektivní, placebem kontrolovaná, randomizovaná studie. Eur Urol 2005; 47: 530-5; diskuse 535-6.
- Zarafonetis CJ, Horrax TM. Léčba Peyronieho choroby para-aminobenzoátem draselným (potaba). J Urol 1959; 81: 770-2.
- Roy J, nosič s. akutní hepatitida spojená s léčbou Peyronieho choroby para-aminobenzoátem draselným (Potaba). J Sex Med 2008; 5: 2967-9.
- Scott WW, Scardino pl. Nový koncept v léčbě Peyronieho choroby. South Med J 1948; 41: 173-7.
- Levine LA, Burnett AL. Standardní operační postupy pro Peyronieho chorobu. J Sex Med 2013; 10: 230-44.
- Pryor JP, Farrell CF. Kontrolovaná klinická studie vitaminu E u Peyronieho choroby. Prog Reprod Biol 1983; 9: 41-5.
- Safarinejad MR, Hosseini SY, Kolahi AA. Srovnání vitaminu E a propionyl-L-karnitinu, samostatně nebo v kombinaci, u pacientů s časnou chronickou Peyronieho chorobou: dvojitě zaslepená, placebem kontrolovaná randomizovaná studie. J Urol 2007; 178: 1398-403; diskuse 1403.
- Klein EA, Thompson IM Jr, Tangen CM, et al. Vitamin E a riziko rakoviny prostaty: studie prevence rakoviny selenu a vitaminu E (SELECT). JAMA 2011; 306: 1549-56.
- El-Sakka AI, Bakircioglu ME, Bhatnagar RS, et al. Účinky kolchicinu na stav podobný Peyroniemu na zvířecím modelu. J Urol 1999; 161: 1980-3.
- Safarinejad PAN Léčebné účinky kolchicinu při řízení Peyronieho choroby: randomizované, dvojitě zaslepené, placebem kontrolované studie. Int J Impot Res 2004; 16: 238-43.
- Prieto Castro RM, Leva Vallejo ME, Regueiro Lopez JC, et al. Kombinovaná léčba vitamínem E a kolchicinem v počátečních stádiích Peyronieho choroby. BJU int 2003; 91: 522-4.
- Cortés-González JR, Glina. S. Konzervativní léčba Peyronieho choroby: kolchicin vs kolchicin plus vitamin E. Actas Urol Esp 2010;34:444-9.
- Ralph DJ, Brooks MD, Bottazzo GF, et al. Léčba Peyronieho choroby tamoxifenem. Br J Urol 1992; 70: 648-51.
- Teloken C, Rhoden EL, Grazziotin TM, et al. Tamoxifen versus placebo v léčbě Peyronieho choroby. J Urol 1999; 162: 2003-5.
- Biagiotti G, Cavallini G. Acetyl-L-karnitin vs tamoxifen v perorální léčba Peyronieho choroby: předběžná zpráva. BJU int 2001; 88: 63-7.
- Safarinejad Mr. účinnost a bezpečnost omega-3 pro léčbu časné fáze Peyronieho choroby: prospektivní, randomizovaná, dvojitě zaslepená placebem kontrolovaná studie. J Sex Med 2009; 6: 1743-54.
- Aron e. léčba Dupuytrenovy choroby cytostatikem (methylhydrazinem). Presse Med 1968; 76: 1956.
- Byström J, Johansson B, Edsmyr F, et al. Induratio penis plastica (Peyronieho choroba). Výsledky různých forem léčby. Scand J Urol Nephrol 1972; 6: 1-5.
- Oosterlinck W, vykresluje G. léčba Peyronieho choroby prokarbazinem. Br J Urol 1975; 47: 219-20.
- Valente EG, Vernet D, Ferrini MG, et al. Inhibitory L-argininu a fosfodiesterázy (PDE) působí proti fibróze v Peyronieho fibrotickém plaku a příbuzných kulturách fibroblastů. Oxid Dusnatý 2003; 9: 229-44.
- Chung E, Deyoung L, Brock GB. Úloha inhibitorů PDE5 v remodelaci jizev penisu: hodnocení klinických a radiologických výsledků. J Sex Med 2011; 8: 1472-7.
- Ozturk U, Yesil S, Goktug HN, et al. Účinky léčby sildenafilem na pacienty s Peyronieho chorobou a erektilní dysfunkcí. Ir J Med Sci 2014; 183: 449-53.
- Medeiros JL Jr, Costa WS, Felix-Patricio B, et al. Ochranné účinky nutriční suplementace argininem a glutaminem na penis potkanů vystavených pánevnímu záření. Andrologie 2014; 2: 943-50.
- Abern MR, Larsen S, Levine LA. Kombinace trakce penisu, intralezionálního verapamilu a perorálních terapií Peyronieho choroby. J Sex Med 2012; 9: 288-95.
- Safarinejad MR, Asgari MA, Hosseini SY, et al. Dvojitě zaslepená placebem kontrolovaná studie účinnosti a bezpečnosti pentoxifylinu U časné chronické Peyronieho choroby. BJU Int 2010; 106: 240-8.
- Raetsch C, Jia JD, Boigk G, et al. Pentoxifylin snižuje profibrogenní cytokiny a expresi prokolagenu I u sekundární biliární fibrózy potkanů. Gut 2002; 50: 241-7.
- Schandené L, Vandenbussche P, Crusiaux A, et al. Rozdílné účinky pentoxifylinu na produkci tumor nekrotizujícího faktoru alfa (TNF-alfa) a interleukinu-6 (IL-6) monocyty a T buňkami. Imunologie 1992; 76: 30-4.
- šindel AW, Lin G, Ning H, et al. Pentoxifylin zeslabuje transformující růstový faktor-β1-stimulovaná depozice kolagenu a elastogeneze v lidských fibroblastech odvozených od tunica albuginea část 1: dopad na extracelulární matrici. J Sex Med 2010; 7: 2077-85.
- Paulis G, Barletta D, Turchi P, et al. Hodnocení účinnosti a bezpečnosti pentoxifylinu spojeného s jinými antioxidanty při léčbě Peyronieho choroby: případová kontrolní studie. Res Rep Urol 2015; 8: 1-10.
- Alizadeh M., Karimi F, Fallah PAN Hodnocení verapamil účinnost u Peyronieho choroby srovnání s pentoxifylin. Glob J Health Sci 2014; 6: 23-30.
- Smith JF, šindel AW, Huang YC, et al. Léčba pentoxifylinem a kalcifikace penisu u mužů s Peyronieho chorobou. Asijské J Androl 2011; 13: 322-5.