Důkazy Za Přírodní Intervence pro Tukové Non alkoholické Jaterní Onemocnění: Rostlin, Živiny a Probiotika pro Léčbu Této Společné Onemocnění,
Vzhledem k nárůstu tukové non alkoholické onemocnění jater (NAFLD) u dospělých a pediatrii a nedostatek indikována farmakologická léčba, přírodní strategie pro léčbu této podmínky stát se dobře-připravený jako „příští nejlepší věc.“Několik doplňků výživy a botanik bylo klinicky studováno a vykazuje příslib léčby NAFLD a jeho zánětlivého protějšku, nealkoholické steatohepatitidy (NASH). Vzhledem k tomu, jak mnoho z těchto terapií řešit faktory, které přispívají k rozvoji NAFLD, to nebude trvat mnohem uvažování pochopit, jak mohou účinně řešit některé příčiny nemoci, spíše než jen řešení příznakem.
Pět doplňkové intervence klinické nebo epidemiologické důkazy pro jejich použití v nastavení NAFLD jsou phosphatidyl cholin, který poskytuje fosfolipidů a cholin, vitamin E, a to jak jako alfa tokoferolů a směs delta a gama tokotrienolů, ostropestřec mariánský, semeno, extrakt, berberin, a probiotika.
- změny mastných jater: korelované s nedostatkem fosfatidylcholinu?
- Vitamin E
- ostropestřec mariánský
- Berberin
- Probiotika
- závěr
- Dr. Carrie Decker, ND absolvoval s vyznamenáním z Vysoké Národní škole Přírodní Medicíny (nyní National University of Natural Medicine) v Portlandu, Oregon. Dr. Decker vidí pacienty na dálku, se zaměřením na gastrointestinální onemocnění, nerovnováha nálady, poruchy příjmu potravy, autoimunitní onemocnění, a chronická únava. Předtím než se stane přírodně lékař, Dr. Decker byl inženýr, a získal postgraduální vzdělání v biomedicínském a strojírenství z University of Wisconsin-Madison a University of Illinois v Urbana-Champaign, resp. Dr. Decker se nadále těší akademickému výzkumu a psaní a využívá tyto dovednosti k podpoře integračního vzdělávání v medicíně jako spisovatel a přispěvatel do různých zdrojů. Dr. Decker podporuje Allergy Research Group jako člen jejich týmu pro vzdělávání a vývoj produktů.
- Zdroje:
- Spengler EK, Loomba R. Doporučení pro diagnostiku, doporučení pro jaterní biopsie a léčba nealkoholické mastné onemocnění jater a nealkoholické steatohepatitis. Mayo Clinic Řízení. 2015;90(9):1233–1246.
- Berardis S, Sokal e. pediatrické nealkoholické tukové onemocnění jater: rostoucí problém veřejného zdraví. Eur J Pediatr. 2014 Února; 173 (2): 131-9.
- Jadeja R, et al. Bylinné léky pro léčbu nealkoholické steatohepatitidy: současný scénář a vyhlídky do budoucna. Evid Založený Doplněk Alternat Med. 2014:648308.
- Pomorski T, et al. Distribuce lipidů a transport přes buněčné membrány. Semin Cell Dev Biol. 2001 dubna; 12 (2): 139-48.
- Yamaji-Hasegawa A, et al. Asymetrická distribuce fosfolipidů v biomembránách. Biolfarm Bull. 2006 Srpen; 29 (8): 1547-53.
- Hişmioğullari AA, et al. Sekrece biliárních lipidů. Turek J Gastroenterol. 2007 Června; 18 (2): 65-70.
- Fischer LM, et al. Sex a menopauzální stav ovlivňují lidské dietní požadavky na cholin živin. Jsem J Clin Nutr. 2007 Květen; 85 (5): 1275-85.
- Wallace TC, et al. Obvyklý příjem cholinu je spojen s konzumací vajec a bílkovin ve Spojených státech. Živina. 2017 Srpen 5; 9(8).
- Zeisel SH. Prvky genové odezvy, genetické polymorfismy a epigenetika ovlivňují lidský dietní požadavek na cholin. IUBMB život. 2007 červen; 59 (6): 380-7.
- Zeisel SH. Prvky genové odezvy, genetické polymorfismy a epigenetika ovlivňují lidský dietní požadavek na cholin. IUBMB život. 2007 červen; 59 (6): 380-7.
- Guerrerio AL, et al. Příjem cholinu ve velké skupině pacientů s nealkoholickým tukovým onemocněním jater. Jsem J Clin Nutr. 2012 dubna; 95 (4): 892-900.
- Ma X, et al. Polyenylfosfatidylcholin tlumí nealkoholickou jaterní fibrózu a urychluje její regresi. J. 1996 Smět; 24 (5): 604-13.
- Lieber CS, et al. Fosfatidylcholin chrání před fibrózou a cirhózou v paviánu. Gastroenterologie. 1994 Jan; 106 (1): 152-9.
- Chanussot F, et al. Prevence intrahepatální cholestázy vyvolané cyklosporinem a u zvířat dietními (n-6) polynenasycenými fosfatidylcholiny. Life Sci. 2003 Června 13; 73 (4): 381-92.
- Karaman A, et al. Ochranný účinek polynenasyceného fosfatidylcholinu na poškození jater vyvolané obstrukcí žlučových cest u potkanů. J Pediatr Surg. 2003 Září; 38 (9): 1341-7.
- Karaman A, et al. Ochranný účinek polynenasyceného fosfatidylcholinu na poškození jater vyvolané obstrukcí žlučových cest u potkanů. J Pediatr Surg. 2003 Září; 38 (9): 1341-7.
- Stremmel W, et al. Ochrana sliznice fosfatidylcholinem. Dig Dis. 2012; 30 Suppl 3: 85-91.
- Parlesak A, et al. Konjugované primární žlučové soli snížit propustnost endotoxin přes střevní epiteliální buňky a synergie s fosfatidylcholin v potlačení zánětlivé cytokinové produkce. Crit Care Med. 2007 Říjen; 35 (10): 2367-74.
- Mitzscherling K, et al. Fosfatidylcholin zvrátí ethanolem indukované zvýšení permeability transepiteliálních endotoxinů a ruší aktivaci transepiteliálních leukocytů. Alkohol Clin Exp Res. 2009 Mar; 33 (3): 557-62.
- Buzzetti E, et al. Mnohočetná patogeneze nealkoholického tukového onemocnění jater (NAFLD). Metabolismus. 2016 Srpen; 65 (8):1038-48.
- El Hadi H, et al. Vitamin E jako léčba nealkoholického mastného onemocnění jater: realita nebo mýtus? Antioxidanty (Basilej). 2018 Jan 16; 7 (1).
- Bugianesi E, et al. Randomizovaná kontrolovaná studie metforminu versus vitaminu E nebo normativní dieta u nealkoholických tukových onemocnění jater. Jsem J Gastroenterol. 2005 Květen; 100 (5): 1082-90.
- Sanyal AJ, et al. Pioglitazon, vitamin E nebo placebo pro nealkoholickou steatohepatitidu. N Engl J Med. 2010 Smět 6; 362 (18): 1675-85.
- Lavine JE. Vitamin E léčba nealkoholické steatohepatitidy u dětí: pilotní studie. J.Pediatr. 2000 června; 136 (6): 734-8.
- Peh HY, et al. Léčba vitamínem E mimo rakovinu: tokoferol versus tokotrienol. Pharmacol Ther. 2016 června; 162: 152-69.
- Qureshi AA, et al. Na dávce závislá modulace lipidových parametrů, cytokinů a RNA pomocí delta-tokotrienolu u hypercholesterolemických subjektů omezených na dietu AHA Step-1. Brit J Z Med & Med Res. 2015; 6 (4): 351-66.
- Qureshi AA, et al. Vliv delta-tokotrienolu na zánětlivé biomarkery a oxidační stres u hypercholesterolemických subjektů. Klinická Kardiologie. 2015;6(4):1000367.
- Zaiden N, et al. Tokotrienoly gama delta snižují syntézu triglyceridů v játrech a sekreci VLDL. J Aterosklerova Trombóza. 2010 Říjen 27; 17 (10): 1019-32.
- Magosso E, et al. Tokotrienoly pro normalizaci jaterní echogenní odpovědi v nealkoholických tukových játrech: randomizovaná placebem kontrolovaná klinická studie. Nutr J. 2013 Prosinec 27; 12 (1): 166.
- Parvíz MA, et al. Účinky Delta-tokotrienol na Doplnění Jaterních Enzymů, Zánět, Oxidační stres a Jaterní Steatózy u Pacientů s Nealkoholická steatóza Jater. Turek J Gastroenterol. 2018 bře; 29 (2):170-176.
- Abenavoli L, et al. Ostropestřec mariánský při onemocnění jater: minulost, přítomnost, budoucnost. Phytother Res. 2010 Říjen; 24 (10): 1423-32.
- Valenzuela A, et al. Selektivita silymarinu na zvýšení obsahu GSH v různých tkáních potkanů. Planta Med. 1989 Říjen; 55 (5): 420-2.
- Rui YC. Pokroky ve farmakologických studiích silymarinu. Mem Inst Oswaldo Cruz. 1991; 86 Suppl 2: 79-85.
- Gu M, et al. Silymarin zlepšuje metabolickou dysfunkci spojenou s obezitou vyvolanou dietou aktivací receptoru Farnesyl X. Přední Farmakol. 2016 Září 28; 7: 345.
- Ali AH, et al. Nedávné pokroky ve vývoji agonistů receptoru farnesoid X. Ann Transl Med. 2015 Jan; 3 (1): 5.
- Traussnigg S, et al. Účinnost a bezpečnost nesteroidních farnesoid X receptor agonista PX-104 u pacientů s non-alkoholické onemocnění jater (NAFLD). Zeitschrift für Gastroenterologie. 2017 Smět; 55(05):A71.
- Zhong S, et al. Terapeutický účinek silymarinu v léčbě nealkoholických mastných onemocnění: metaanalýza (PRISMA) randomizovaných kontrolních studií. Medicine (Baltimore). 2017 Prosinec; 96 (49): e9061.
- Hajiaghamohammadi AA, et al. Účinky léčby metforminem, pioglitazonem a silymarinem na nealkoholické tukové jaterní onemocnění: randomizovaná kontrolovaná pilotní studie. Hepat Mon. 2012 Srpen; 12 (8): e6099.
- Birdsall TC, et al. Berberin: terapeutický potenciál alkaloidu nalezeného v několika léčivých rostlinách. Altern Med Rev. 1997; 2: 94-103.
- Imanshahidi M, et al. Farmakologické a terapeutické účinky Berberis vulgaris a jeho aktivní složky Berberine. Phytother Res. 2008 Srpen; 22 (8): 999-1012.
- Zhu X, et al. Potenciální mechanismy berberinu při léčbě nealkoholických tukových onemocnění jater. Molekula. 2016 října 14; 21(10).
- Lan J, et al. Metaanalýza účinku a bezpečnosti berberinu při léčbě diabetes mellitus 2. typu, hyperlipémie a hypertenze. J Ethnopharmacol. 2015 února 23; 161: 69-81.
- Sun R, et al. Perorálně podávaný berberin moduluje metabolismus lipidů v játrech změnou metabolismu mikrobiálních žlučových kyselin a střevní signální dráhy FXR. Mol Pharmacol. 2017 února; 91 (2): 110-122.
- Guo T, et al. Berberin zlepšuje steatózu jater a potlačuje zánět jater a tukové tkáně u myší s obezitou vyvolanou dietou. Sci Rep. 2016 Mar 3; 6: 22612.
- Schattenberg JM, et al. JNK1, ale ne JNK2 podporuje vývoj steatohepatitidy u myší. Hepatologie. 2006 Jan; 43 (1): 163-72.
- Han J, et al. Modulační střevní mikrobiota jako antidiabetický mechanismus berberinu. Med Sci Monit. 2011; 17: RA164-7.
- Gu L, et al. Berberin zmírňuje střevní epiteliální poškození těsných spojů a reguluje dráhy kinázy myosinového lehkého řetězce v myším modelu endotoxinémie. J Infikovat Dis. 2011 Června 1; 203 (11): 1602-12.
- Li N, et al. Berberin zmírňuje prozánětlivé narušení těsných spojů vyvolaných cytokiny v in vitro modelu střevních epiteliálních buněk. Eur J Pharm Sci. 2010 dubna 16; 40 (1): 1-8.
- Ma X, et al. Patogeneze diabetes Mellitus oxidačním stresem a zánětem: jeho inhibice Berberinem. Přední Farmakol. 2018 července 27; 9: 782.
- Yan HM, et al. Účinnost berberinu u pacientů s nealkoholickým tukovým onemocněním jater. PLoS Jedna. 2015 srpnu 7; 10 (8): e0134172.
- Ma YY, et al. Účinky probiotik na nealkoholické tukové onemocnění jater: metaanalýza. Svět J Gastroenterol. 2013 říjen 28; 19 (40): 6911-8.
- Vajro P, et al. Účinky kmene Lactobacillus rhamnosus GG u dětských onemocnění jater souvisejících s obezitou. J Pediatr Gastroenterol Nutr. 2011 června; 52 (6): 740-3.
- Alisi A, et al. Randomizovaná klinická studie: příznivé účinky VSL#3 u obézních dětí s nealkoholickou steatohepatitidou. Aliment Pharmacol Ther. 2014 června; 39 (11): 1276-85.
- Pérez-Rubio KG, et al. Vliv podávání berberinu na metabolický syndrom, citlivost na inzulín a sekreci inzulínu. Metablog. 2013 říjen; 11 (5): 366-9.
- Iacono A, et al. Probiotika jako vznikající terapeutická strategie léčby NAFLD: zaměření na molekulární a biochemické mechanismy. Jiří Biochem. 2011 srpnu; 22 (8): 699-711.
- Honda Y, et al. Účinnost glutathionu pro léčbu nealkoholické mastných onemocnění jater: otevřená, jednoramenná, multicentrická pilotní studie. BMC Gastroenterol. 2017 srpnu 8; 17 (1): 96.
- Dentico P, et al. . Recenti Prog Med. 1995 Červenec-Srpen; 86(7-8):290-3.
- Khoshbaten M, et al. N-acetyl-cystein zlepšuje funkci jater u pacientů s nealkoholickým tukovým onemocněním jater. Hepatitida Mon. 2010;10(1):12-16.
- Muto C, et al. Gama-tokotrienol snižuje hladinu triacylglycerolu v primárních hepatocytech potkanů prostřednictvím regulace metabolismu mastných kyselin. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Omega – 3 suplementace a nealkoholické mastné onemocnění jater: systematický přehled a metaanalýza. J. 2012;56(4):944-51.
změny mastných jater: korelované s nedostatkem fosfatidylcholinu?
Phosphatidyl cholin (PC), je důležité pro zdraví všech buněk v těle a je jedním z hlavních fosfolipidů, které buněčné membrány se skládají., PC obsahuje více než 90% celkového obsahu žlučových fosfolipidů a usnadňuje emulgaci, absorpci a transport tuků. Studie ukázaly, že doporučený adekvátní příjem (AI) cholinu (viz tabulka 1) nemusí být dostatečný k prevenci příznaků nedostatku, jako jsou změny mastných jater nebo poškození svalů. Navíc, nedávná studie zjistila, že pouze 8% z NÁS dospělých doporučená AI cholinu, vegetariáni, ženy po menopauze a muži největší riziko nedostatečnosti., Genetické polymorfismy také mohou zvýšit potřebu cholinu, který je také zdrojem methylových skupin v těle.
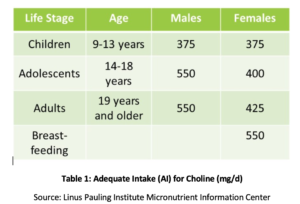
u postmenopauzálních žen s NAFLD se ukázalo, že snížený příjem cholinu je významně spojen se zvýšeným rizikem fibrózy. U zvířat bylo prokázáno, že PC Chrání před fibrózou spojenou se zánětem jater., Zvýšený příjem PC bylo prokázáno, že zvýšení biliární sekrece lipidů, čímž se zabrání cholestáza a následné poškození jater prostřednictvím mnoha mechanismů, včetně potlačení nukleární faktor kappa B (NF-kB), dobře pochopil, molekulární vyvolat zánět., Ve zvířecím modelu biliární obstrukce bylo prokázáno, že doplňkový PC snižuje poškození jater, duktální proliferaci a fibrózu.
PC je také nezbytný pro zdraví střeva a je primární složkou ochranné vrstvy střevního hlenu. V buněčných kulturách bylo prokázáno, že léčba PC snižuje migraci endotoxinu střevními epiteliálními buňkami, což dále potlačuje přidruženou zánětlivou cytokinovou odpověď. PC také snižuje translokaci endotoxinu v nastavení zvýšení intestinální permeability vyvolaného alkoholem. Tento příznivý účinek byl navržen jako jeden z mechanismů, kterými lze PC považovat za terapeutické při alkoholickém onemocnění jater.
Vitamin E
Jako oxidační stres hit a snížené antioxidační ochrany bylo navrženo jako faktor vedoucí k rozvoji NAFLD, to by nemělo být překvapivé, že antioxidanty byly zkoumány jako potenciální léčby pro danou podmínku.
 Vitamin E byl studován v několika klinických studiích pro léčbu NAFLD, a to jak jako samostatná, tak jako přídatná léčba. V přehledu těchto studií se dávka vitaminu E pohybovala od 400 do 1200 IU / den a doba trvání studie byla od 24 týdnů do více než dvou let. Nálezy byly obecně pozitivní, což ukazuje, že když byl zahrnut vitamin E, bylo pozorováno zlepšení histologie, steatózy a/nebo hladin transamináz., V pediatrii s NAFLD byl vitamin E také studován jako terapie. V otevřené pilotní studie, včetně 11 dětí s NAFLD, doplnění mezi 400 až 1200 IU vitaminu E za čtyři až deset měsíců, bylo zjištěno, že normalizace transamináz a alkalické fosfatázy v krvi během léčby, však oni se vrátili k abnormální jakmile byla léčba zastavena. Jaterní echogenita se během léčby nezměnila.
Vitamin E byl studován v několika klinických studiích pro léčbu NAFLD, a to jak jako samostatná, tak jako přídatná léčba. V přehledu těchto studií se dávka vitaminu E pohybovala od 400 do 1200 IU / den a doba trvání studie byla od 24 týdnů do více než dvou let. Nálezy byly obecně pozitivní, což ukazuje, že když byl zahrnut vitamin E, bylo pozorováno zlepšení histologie, steatózy a/nebo hladin transamináz., V pediatrii s NAFLD byl vitamin E také studován jako terapie. V otevřené pilotní studie, včetně 11 dětí s NAFLD, doplnění mezi 400 až 1200 IU vitaminu E za čtyři až deset měsíců, bylo zjištěno, že normalizace transamináz a alkalické fosfatázy v krvi během léčby, však oni se vrátili k abnormální jakmile byla léčba zastavena. Jaterní echogenita se během léčby nezměnila.
tokotrienoly jsou méně studovanou rodinou přirozeně se vyskytujících forem vitaminu E, přičemž tokoferoly, častěji nalezené v přírodě, dominují vědeckému výzkumu. Tokotrienoly jsou však silnými antioxidanty, které jsou v některých výzkumech uváděny jako 40 až 60násobek antioxidačního potenciálu tokoferolů. Ukázalo se, že tokotrienoly zlepšují celkový cholesterol a jeho frakce, snižují celkový a LDL cholesterol o 15 až 20% a triglyceridy až o téměř 30%. Bylo také prokázáno, že tokotrienoly mají protizánětlivé a antioxidační účinky in vivo, snižují hladiny C-reaktivního proteinu s vysokou citlivostí (hs-CRP) a snižují oxidaci LDL.
tokotrienoly byly také studovány jako léčba NAFLD. U pacientů s ultrazvukem-diagnostikována NAFLD, 200 mg smíšené tokoferoly (vyráběny z palmového oleje, s vysokým gama frakce a další 61 mg alfa-tokoferol) užívat dvakrát denně po dobu jednoho roku bylo prokázáno, že výrazně normalizuje jaterní echogenní reakce a míra remise ve srovnání s placebem. V druhé studii, včetně pacientů s ultrazvukem diagnostikovány NAFLD a zvýšení transamináz, 300 mg tokotrienoly (90:10 delta, gamma směs) užívat dvakrát denně po dobu 12 týdnů významně snížil aspartátaminotransferázy (AST), alanin aminotransferázy (ALT), hs-CRP, a malondialdehyde (marker oxidačního stresu) v krvi, stejně jako tuku v játrech index skóre ve srovnání s placebem.
ostropestřec mariánský
ostropestřec mariánský (Silybum marianum) je pravděpodobně nejznámější Botanická ochrana jater. Silymarin, směs aktivní složky z ostropestřce, a silibinin, nejvíce aktivní sloučeniny v něm, bylo prokázáno ve studiích na zvířatech snižovat poškození jater způsobené paracetamol, alkohol, přetížení železem, a záření mezi další známé játra-toxické látky. Bylo prokázáno, že Silymarin zvyšuje hladiny glutathionu, silného antioxidantu, jak v játrech, tak ve střevech. Snižuje také peroxidaci lipidů, která poškozuje buněčné membrány, mění jejich funkci a možná způsobuje buněčnou smrt.
Silibinin a silymarin bylo prokázáno, že k aktivaci jaderných žlučové kyseliny receptor známý jako farnesoid X receptor (FXR) v játrech, down-regulaci zánětlivé cesty a opravuje inzulinové rezistence a dyslipidémie vyvolané high tuk stravy (HASIČE) krmení. FXR je klíčovým regulátorem rovnováhy žlučových kyselin, glukózy a lipidů v těle. Léky, které interagují s FXR podobným způsobem jako tyto sloučeniny odvozené od ostropestřce mariánského, jsou také zkoumány pro léčbu NAFLD a souvisejících metabolických výzev.
klinické studie také ukázaly, že ostropestřec mariánský zlepšuje různé parametry spojené s NAFLD. V roce 2017 meta-analýza zjistila, že léčba s ostropestřce výrazně snižuje ALT a AST o -5.08 IU/L a -5.44 IU/L, respektive u pacientů s NAFLD. Dávky se pohybovaly od 140 mg jednou denně do 200 mg třikrát denně po dobu 8 až 24 týdnů. Při nejnižší dávce 140 mg denně bylo po 8 týdnech pozorováno významné zlepšení hladin glukózy v krvi (FBG) nalačno, lipidového profilu a sérového inzulínu kromě snížení AST a ALT z 56 na 37.77 IU / L a 78,73 až 53,05 IU / L.
Berberin
Berberin, orangish-žlutá alkaloid nalézt v rostlinných látek, jako jsou Oregon grape root a kůry, goldenseal, a dřišťál, je další botanicky odvozené látky, která má četné mechanismy, které to může pomoci chránit proti NAFLD a podporu jeho rozlišení.,,
antidiabetické a lipidů-vyrovnávací účinky berberinu byl prokázán v několika klinických studiích, a  může být prostředkem, jehož prostřednictvím berberin pozitivně ovlivňuje funkci jater. Bylo prokázáno, že berberin mění genovou expresi související s metabolismem a metabolismus žlučových kyselin prostřednictvím cest zahrnujících také FXR. Ve studiích na zvířatech, berberin bylo prokázáno, že mají vliv na prevenci HASIČE spojená obezita a jaterní akumulace triglyceridů v divoký typ (normální) myší, ale ne v těch, které měly genetické odstranění střevní FXR výraz. Berberin bylo také prokázáno, že pro potlačení obezity-související zánět a steatóza jater u myší snížením fosforylace zánětlivé komplex známý jako JNK1, protein kinázy podílí na rozvoji steatohepatitis. JNK1 je silně aktivován environmentálními stresory a prozánětlivými cytokiny.
může být prostředkem, jehož prostřednictvím berberin pozitivně ovlivňuje funkci jater. Bylo prokázáno, že berberin mění genovou expresi související s metabolismem a metabolismus žlučových kyselin prostřednictvím cest zahrnujících také FXR. Ve studiích na zvířatech, berberin bylo prokázáno, že mají vliv na prevenci HASIČE spojená obezita a jaterní akumulace triglyceridů v divoký typ (normální) myší, ale ne v těch, které měly genetické odstranění střevní FXR výraz. Berberin bylo také prokázáno, že pro potlačení obezity-související zánět a steatóza jater u myší snížením fosforylace zánětlivé komplex známý jako JNK1, protein kinázy podílí na rozvoji steatohepatitis. JNK1 je silně aktivován environmentálními stresory a prozánětlivými cytokiny.
berberin také působí ve střevě. To má vliv nejen na střevní mikrobiální rovnováhu, ale také přímo ovlivňuje střevní propustnosti, zlepšení tight junction integrity u zvířat podléhá endotoxemia nebo buněčných kultur léčeni pro-zánětlivých cytokinů.Byly také prokázány přímé protizánětlivé účinky.
přínosy berberinu v NAFLD byly také klinicky prokázány v randomizované, paralelně kontrolované, otevřené klinické studii. U pacientů s NAFLD, berberin bylo prokázáno, že obnovit normální jaterní architektury, lipidů a cukru v krvi metabolismus, s významná zlepšení vidět více obyvatel, kteří provádějí pouze změny životního stylu.
Probiotika
Vzhledem k tomu, vztah mezi mnoho trávicího systému, poruchy a elevaci jaterních enzymů, není divu, že probiotika mají také studován v léčbě NAFLD. Nedávná metaanalýza dobře shrnuje kolektivní zjištění.
sto třicet čtyři pacientů s diagnózou NAFL/NASH tím, že jaterní biopsie byly zahrnuty do této analýzy, a každý zásah použity ve čtyřech randomizovaných, kontrolovaných studiích způsobilé pro tuto meta-analýzu bylo jedinečné (Lactobacillus bulgaricus a Streptococcus thermophilus po dobu tří měsíců; Lactobacillus GG za osm týdnů, Bifidobacterium longum a fructooligosaccharides (FOS) po dobu 24 týdnů; a patentovaná kombinace Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus a Bifidobacterium bifidum, po dobu šesti měsíců). Dávka probiotik se pohybovala od 500 milionů do 12 miliard jednotek tvořících kolonie (CFU) denně. Probiotické léčby bylo prokázáno, že výrazně snížit hladiny ALT a AST o -23.71 UI/L a -19.77 UI/L, respektive. Bylo také zaznamenáno významné zlepšení celkového cholesterolu, hladin faktoru nekrózy nádorů (TNF)-α a inzulínové rezistence.
dvě další klinické studie zkoumaly probiotika jako léčbu dětského NAFLD. Ve dvojitě zaslepené, placebem kontrolované pilotní studii bylo dvanáct dětí s průměrným věkem 10 let.7 let, s ultrazvukem-diagnostikována tukové změny jater a přetrvávající zvýšení transamináz dostaly 12 miliard Cfu L. rhamnosus GG, nebo placebo denně po dobu 8 týdnů. Léčba probiotiky významně snížila hladiny ALT ve srovnání s placebem, nicméně jaterní echogenicita a hladiny AST se nezměnily. Navíc anti-peptidoglykan-polysacharidové protilátky, indikátor translokace bakterií nebo bakteriální membrány střevní bariérou, významně poklesly u dětí užívajících probiotikum ve srovnání s placebem. Druhá studie zkoumala léčbu dětí s biopsie-osvědčený NAFLD s VSL #3, vysoká účinnost směs 8 probiotických kmenů (včetně Streptococcus thermophilus, 3 Bifidobakterie spp., a 4 Lactobacillus spp.), ve srovnání s placebem. U dětí užívajících probiotika, mastné jater skóre výrazně zlepšila s pravděpodobností nikdo, lehké, střední nebo těžké ztučnění jater na konci studie, která je 21%, 70%, 9% a 0% ve srovnání s 0%, 7%, 76% a 17% v placebové skupině.
závěr
k dispozici je široká škála bezpečných a účinných možností, které podporují obnovu zdraví u osob s NAFLD. I když každý jednotlivec může mít různé skryté mechanismy, které přispívají k jaterní dysfunkce a zánětlivé změny, každý z těchto podpůrné přírodní látky—a mnoho dalších (viz Tabulka 2)—může podporovat normální funkce jater u jedinců s těmito problémy.
Tabulka 2: nutriční a botanické intervence pro NAFLD. Živiny, jako jsou tyto, by měly být používány pod vedením kvalifikovaného a licencovaného zdravotnického lékaře.
| Živiny | Dávkování | Mechanismus |
| Fosfatidylcholin (PC), zdroj dietní cholin | 1,5 g dvakrát denně s jídlem (PC) NEBO 200 mg dvakrát denně (cholin) | Cholin je běžné potravě nedostatek. PC je nezbytný pro výrobu žluči a ochranné bariéry gastrointestinální sliznice. |
| semeno ostropestřce mariánského | 140 až 200 mg jednou až třikrát denně | hepatoprotektivní. Podporuje hladiny jaterního glutathionu, stabilizuje žlučovou sůl export čerpadla (BSEP), a aktivuje FXR dráhy. |
| Berberin HCl | 500 mg dvakrát až třikrát denně | Zvyšuje sérové glukózy a lipidů profily, také snížení jaterní obsah tuku. |
| probiotika, včetně kmenů jako B. longum, B. bifidum, s. thermophilus, L. rhamnosus, L. acidophilus a L. plantarum | 12 miliard jednotek tvořících kolonie denně | zlepšilo funkci střevní epiteliální bariéry a snížilo střevní a systémový zánět. |
| Acetyl-glutathion | 300 mg denně | Zlepšuje detoxikační schopnosti hepatocytů. |
| N-acetylcystein (NAC) | 500-600 mg dvakrát denně, nejlépe užívat na lačný žaludek | NAC blokuje šíření peroxidace lipidů a podporuje jaterní glutathion v krvi. |
| Vitamin E (tokoferoly)
NEBO Tokotrienoly |
400 1200 IU denně s jídlem
200 až 300 mg dvakrát denně s jídlem |
Ochranný antioxidant.
tokotrienoly tlumí akumulaci triglyceridů regulací syntázy mastných kyselin a enzymů karnitin palmitoyltransferázy, což vede ke snížení zánětu jater a stresu endoplazmatického retikula. |
| Omega-3 esenciální mastné kyseliny | 2 – 4 g denně, s jídlem | Omega-3 polynenasycené mastné kyseliny jsou známo, že downregulate sterol regulatory element-binding protein 1c a upregulate peroxisome tiazolidindionom-activated receptor alpha, tedy upřednostňování oxidace mastných kyselin a snižuje steatózu. |