Generic Name: difenhydramin hydrochlorid, lidokain hydrochlorid, hydroxid hlinitý, hydroxid hořečnatý
Léková Forma: perorální slučování kit
Lékařsky přezkoumány Drugs.com. Naposledy aktualizován dne 21. Září, v roce 2020.
- Profesionální
- Interakce
- Recenze
- Více
Upozornění: Tento lék nebyl nalezen FDA jako bezpečné a účinné, a toto označení není schválen FDA. Další informace o neschválených lécích, klikněte zde.
PRVNÍ ® – Ústní voda BLM Rx
Difenhydramin HCl, Lidokain Hydrochlorid, Hydroxid hlinitý, Hydroxid Hořečnatý, a Simetikon Slučování Kit
NA PŘEDPIS MÍCHÁNÍ POUZE
Na Této Stránce
První Ústní voda BLM Popis
Každá PRVNÍ®— Ústní voda BLM Slučování Kit se skládá z 0,2 g difenhydramin hydrochlorid prášek USP a 1,6 g lidokain-hydrochloridu prášek USP pro orální použití.* PRVNÍ®— Ústní voda BLM Slučování Kit také obsahuje 236 mL suspenze obsahující 3.15 g hydroxidu hlinitého USP (ekvivalent sušené gel USP), 3.15 g hydroxidu hořečnatého USP, a 0.315 g simetikon USP s benzylalkohol, butylparabenu, chuť, hydroxyethylcellulose, propylparaben, čištěná voda, sodná sůl sacharinu, sorbitol roztok, D&C red #28 a FD&C red #40.* Když se zhoršuje, konečný produkt poskytuje homogenní suspenze obsahující difenhydramin hydrochlorid, lidokain hydrochlorid, hydroxid hlinitý, hydroxid hořečnatý, simetikon srovnatelné s aktivní ingredience (Benadryl®, Lidokain HCl 2% Viskózní, Maalox® 1:1:1), obsažené v Magic Ústní voda.**
Jak Dodává a Míchání Směry
| Velikost | 8 uncí (237 mL) |
| NDC# | 65628-050-01 |
| Difenhydramin HCl | 0.2g |
| Lidokain HCl | 1,6 g |
| PRVNÍ®-Ústní voda Pozastavení | 236 mL |
NA LÉKÁRNÍKA
Vše, co potřebujete udělat, je součástí…
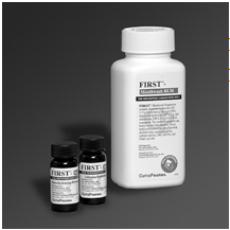
1. PRVNÍ®— Ústní voda BLM Slučování Kit obsahuje premeasured difenhydramin hydrochlorid prášek, lidokain hydrochlorid prášek a ústní vody, suspenze (hydroxid hlinitý, hydroxid hořečnatý, simetikon plus neaktivní složky)

2. Důležité-před dávkováním klepněte na horní a dolní část lahvičky obsahující hydrochlorid difenhydraminu, aby se prášek uvolnil a sejměte uzávěr. Vyprázdněte prášek hydrochloridu difenhydraminu do lahvičky obsahující tekutou suspenzi ústní vody. Stejně tak klepněte na horní a dolní část lahvičky obsahující lidokain hydrochlorid, abyste uvolnili prášek a odstranili víčko. Vyprázdněte prášek lidokain hydrochloridu do lahvičky obsahující tekutou suspenzi ústní vody.
odpovídající množství difenhydramin hydrochlorid prášek a lidokain hydrochlorid-prášek byly zabaleny v každé láhvi poskytovat požadované dávkování každého léku. Zbytková množství zbývající v lahvích po vyprázdnění nemusí být vypláchnuta.

3. Uzavřete lahvičku a protřepejte po dobu 20 až 30 sekund. Poučte pacienta, aby před každým použitím lahvičku dobře protřepal.
Před slučování, ukládání PRVNÍM®— Ústní voda BLM Složení Soupravy při pokojové teplotě mezi 15°-30°C (59°-86°F) . Finální přípravek skladujte také při pokojové teplotě 15°-30°C (59°-86°F).
komponenty compounding Kit FIRST®— Mouthwash BLM mají tříletou expiraci.*** Na základě testování pokojové teploty a vlhkosti v reálném čase je compounded first®— Mouthwash BLM Compounding Kit stabilní po dobu nejméně šesti měsíců.***
PRVNÍ®— Ústní voda pozastavení splňuje požadavky na celkový počet aerobních mikroorganismů, ne více než 100 ktj/mL, stejně jako absence specifikovaných mikroorganismů Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus a Salmonella spp. když se zkouší, jak je popsáno v aktuální USP pod <61> Mikrobiální Výčet Testů a <62> Zkoušky na Specifikované Mikroorganismy. FIRST® – ústní voda suspenze také splňuje požadavky, jak je popsáno v aktuálním USP pod <51> testování antimikrobiální účinnosti pro produkty kategorie 4.
pouze pro perorální podání. Zabraňte kontaktu s očima. Uchovávejte v dobře uzavřeném obalu. Uchovávejte mimo dosah dětí. Chraňte před světlem. Chraňte před mrazem. Složený produkt, jak je dávkován, je stabilní po dobu nejméně 180 dnů při pokojové teplotě.
* osvědčení o analýze v souboru
* * tento výrobek není vyráběn společností Pfizer, Inc., výrobce Benadryl® nebo Novartis Consumer Health, Inc. výrobce Maalox®
*** Data a dokumentace ve spisu
pouze RX
revidováno: únor 2010
US Patent No. 6,708,822 B1
Další AMERICKÝ Patent
Distribuovány Pomocí:
CutisPharma, Inc.
INTELIGENTNÍ PRODUKTY PRO CHYTRÉ LIDI®
Woburn, MA 01801, spojené státy www.cutispharma.com
HLAVNÍ DISPLEJ
NDC 65628-050-01
PRVNÍ® Ústní voda BLM
Každá sada obsahuje:
Aktivní Složky:
Difenhydramin hydrochlorid 0,2 g
Lidokain-hydrochloridu 1,6 g
hydroxid hlinitý 3.15 g v 236mL suspenze (odpovídá sušené gel USP)
hydroxid Hořečnatý 3.15 g v 236mL pozastavení
Simetikon 0.315g in 236mL suspension
8 FL OZ (237 mL) as dispensed

| First Mouthwash BLM diphenhydramine hydrochloride and lidocaine hydrochloride and aluminum hydroxide and magnesium hydro kit |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Část 1 3 LIDOKAIN HYDROCHLORID
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Část 2 3 PRVNÍ ÚSTNÍ vody POZASTAVENÍ
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Část 3 3 DIPHENHYDRAMINE HYDROCHLORIDE
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – CutisPharma, Inc. (090598256)
More about FIRST Mouthwash BLM (aluminum hydroxide / diphenhydramine / lidocaine / magnesium hydroxide / simethicone topical)
- Drug Interactions
- 2 Reviews
- Drug class: produkty v ústech a krku
související průvodce léčbou
- aftózní vřed
lékařské Disclaimer