Yleiset sidoskuviot orgaanisissa rakenteissa
edellä tarkastellut menetelmät Lewis-rakenteiden piirtämiseksi ja atomien muodollisten varausten määrittämiseksi ovat olennainen lähtökohta aloittelevalle orgaaniselle kemistille, ja ne toimivat varsin tahdikkaasti pienten, yksinkertaisten rakenteiden käsittelyssä. Mutta kuten voitte kuvitella, nämä menetelmät tulevat kohtuuttoman työläitä ja aikaa vieviä, kun alat käsitellä suurempia rakenteita. Olisi epärealistista esimerkiksi pyytää teitä piirtämään Lewis-rakenne alla (yhdestä DNA: n muodostavista neljästä nukleosidirakenteesta) ja määrittämään kaikki muodolliset varaukset laskemalla yhteen atomi atomilta valenssielektronit.
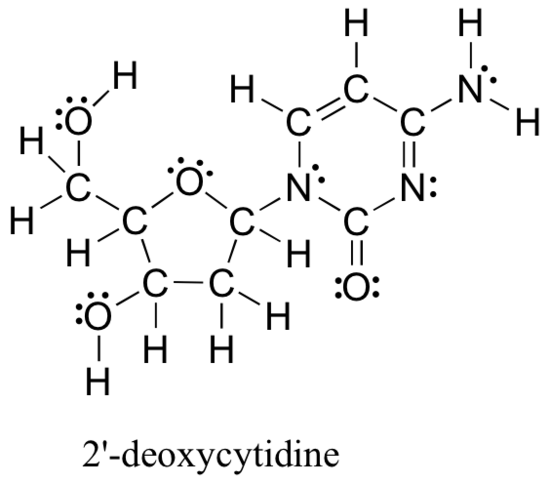
ja kuitenkin orgaanisina kemisteinä ja erityisesti biologisia molekyylejä käsittelevinä orgaanisina kemisteinä sinun odotetaan pian piirtävän tämänkaltaisten suurten molekyylien rakennetta säännöllisesti. On selvää, että sinun täytyy kehittää kykyä nopeasti ja tehokkaasti piirtää suuria rakenteita ja määrittää muodolliset maksut. Onneksi tämä kyky ei ole hirveän vaikea löytää – kaikki se vie on muutamia oikoteitä ja joitakin käytännön tunnustaa yhteisiä liimaus malleja.
aloitetaan hiilestä, joka on orgaanisten kemistien tärkein alkuaine. Hiilen sanotaan olevan tetravalenttia, eli sillä on taipumus muodostaa neljä sidosta. Jos tarkastellaan metaanin, metanolin, etaanin, eteenin ja etyynin yksinkertaisia rakenteita edellisen osan luvuissa, pitäisi nopeasti huomata, että jokaisessa molekyylissä hiiliatomissa on neljä sidosta ja muodollinen varaus nolla.
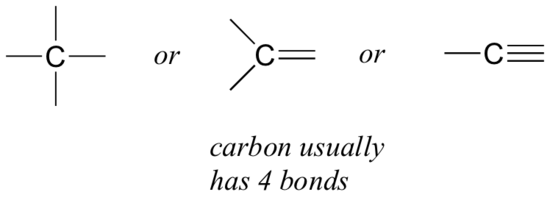
tämä on kuvio, joka pitää sisällään suurimman osan näkemistämme orgaanisista molekyyleistä, mutta on myös poikkeuksia.
hiilidioksidissa hiiliatomilla on kaksoissidokset Happeen molemmin puolin (O=C=O). Myöhemmin tässä luvussa ja koko tämän kirjan näemme esimerkkejä orgaanisten ionien kutsutaan ”carbocations” ja karbanions”, jossa hiiliatomi kantaa positiivinen tai negatiivinen muodollinen varaus, vastaavasti. Jos hiilellä on vain kolme sidosta ja täyttämätön valenssikuori (eli jos se ei täytä oktettisääntöä), sillä on positiivinen formaali varaus.
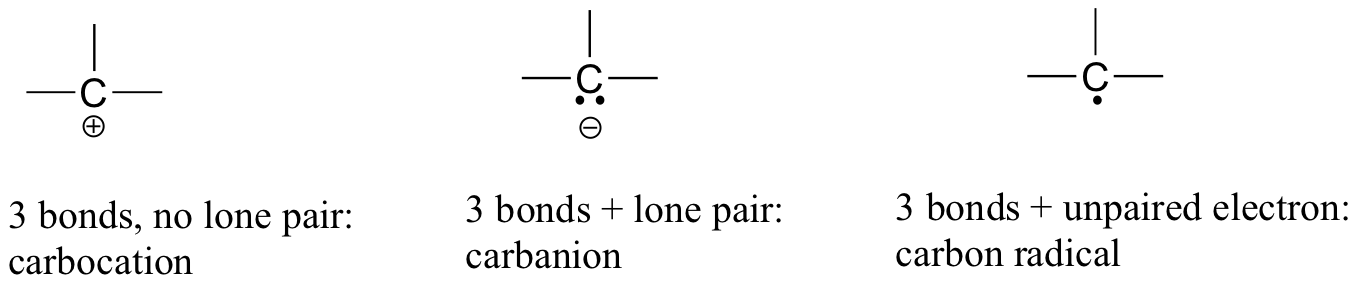
jos taas sillä on kolme sidosta plus yksinäinen elektronipari, sen muodollinen varaus on -1. Toinen mahdollisuus on hiili, jossa on kolme sidosta ja yksi, pariton (vapaiden radikaalien) elektroni: tällöin hiilellä on formaali varaus nolla. (Viimeinen mahdollisuus on erittäin reaktiivinen laji nimeltä ”karbeeni”, jossa hiilellä on kaksi sidosta ja yksi yksinäinen elektronipari, jolloin sen muodollinen varaus on nolla. Saatat kohdata karbeeneja kehittyneemmillä kemian kursseilla, mutta niitä ei käsitellä enempää tässä kirjassa).
kannattaa varmasti käyttää oppimiasi menetelmiä varmistaakseen, että nämä muodolliset syytökset ovat oikein edellä mainittujen esimerkkien osalta. Vielä tärkeämpää, sinun täytyy, ennen kuin edistyt paljon pidemmälle oman tutkimuksen orgaanisen kemian, Yksinkertaisesti tunnistaa nämä kuviot (ja kuviot kuvattu alla muiden atomien) ja pystyä tunnistamaan hiilet, jotka kantavat positiivinen ja negatiivinen muodollinen maksuja nopea tarkastus.
vedyn kaava on helppo: vetyatomeilla on vain yksi sidos, eikä muodollista varausta. Poikkeuksia tähän sääntöön ovat protoni H+ ja hydridi-ioni H -, joka on protoni plus kaksi elektronia. Koska keskitymme tässä kirjassa orgaaniseen kemiaan sovellettuna elollisiin olentoihin, emme kuitenkaan näe ”alastomia” protoneja ja hydridejä sellaisenaan, koska ne ovat liian reaktiivisia esiintyäkseen siinä muodossa vesiliuoksessa. Protonin idea tulee kuitenkin olemaan hyvin tärkeä, kun keskustelemme happo-emäs-kemiasta, ja hydridi-ionin idea tulee hyvin tärkeäksi paljon myöhemmin kirjassa, kun keskustelemme orgaanisista hapetus-ja pelkistysreaktioista. Säännönmukaisesti orgaanisten molekyylien kaikilla vetyatomeilla on kuitenkin yksi sidos, eikä muodollista varausta.
kääntykäämme seuraavaksi happiatomeihin. Tyypillisesti, näet happea liimaus kolmella tavalla, jotka kaikki täyttävät oktetti sääntö.
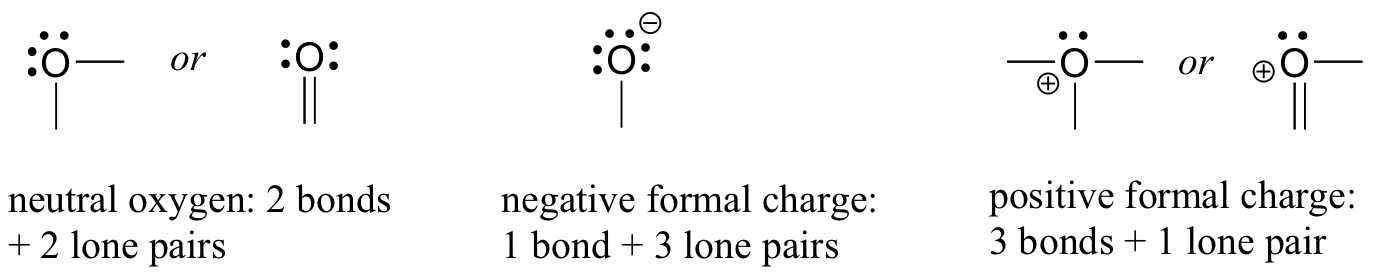
jos sillä on kaksi sidosta ja kaksi yksinäistä paria, kuten vedessä, sen muodollinen varaus on nolla. Jos sillä on yksi sidos ja kolme yksinäistä paria, kuten hydroksidi-ionilla, sen muodollinen varaus on-1. Jos sillä on kolme sidosta ja yksi yksinäinen pari, kuten hydroniumionilla, sen muodollinen varaus on +1.
kun pääsemme käsittelemään vapaiden radikaalien kemiaa luvussa 17, näemme muita mahdollisuuksia, kuten missä happiatomilla on yksi sidos, yksi yksinäinen pari ja yksi pariton (vapaiden radikaalien) elektroni, jolloin sille saadaan formaali varaus nollasta. Keskity nyt kuitenkin kolmeen tärkeimpään ei-radikaaliin esimerkkiin, sillä ne selittävät käytännössä kaiken, mitä näemme 17.lukuun asti.
typellä on kaksi merkittävää sidoskuviota, jotka molemmat täyttävät oktettisäännön:
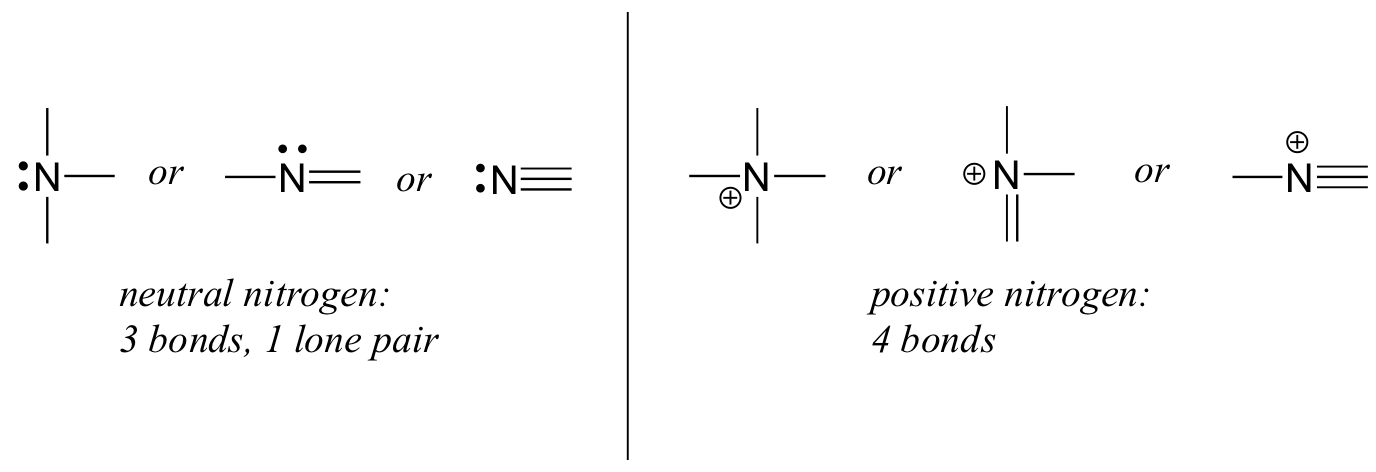
jos typellä on kolme sidosta ja yksinäinen pari, sen muodollinen varaus on nolla. Jos sillä on neljä sidosta (eikä yhtään yksinäistä paria), sen muodollinen varaus on +1. Melko harvinaisessa sidoskuviossa negatiivisesti varautuneella typellä on kaksi sidosta ja kaksi yksinäistä paria.
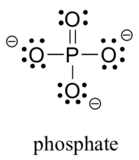
biologisissa orgaanisissa molekyyleissä esiintyy yleisesti kahta kolmannen rivin alkuainetta: rikkiä ja fosforia. Vaikka molemmilla näillä alkuaineilla on muita sidoskuvioita, joilla on merkitystä laboratoriokemiassa, biologisessa kontekstissa rikki noudattaa lähes aina samaa sidos/muodollista varauskuviota kuin happi, kun taas fosfori esiintyy fosfaatti-ionina (PO43 -), jossa sillä on viisi sidosta (lähes aina Happeen), ei yksinäisiä pareja ja muodollinen varaus on nolla. Muista, että jaksollisen järjestelmän kolmannen rivin alkuaineilla on valenssikuoressaan d-orbitaalit sekä S-ja p-orbitaalit, joten oktettisääntö ei sido niitä.
lopuksi halogeenit (fluori, kloori, bromi ja jodi) ovat erittäin tärkeitä laboratorio-ja lääkeainekemiassa, mutta harvinaisempia luonnossa esiintyvissä orgaanisissa molekyyleissä. Orgaanisissa yhdisteissä halogeeneilla on yleensä yksi sidos, kolme yksinäistä paria ja muodollinen varaus nolla. Joskus, erityisesti bromin tapauksessa, törmäämme reaktiivisiin lajeihin, joissa halogeenilla on kaksi sidosta (yleensä kolmijäsenisessä renkaassa), kaksi yksinäistä paria ja muodollinen varaus +1.

nämä säännöt, jos ne opitaan ja sisäistetään niin, ettei niitä tarvitse edes ajatella, mahdollistavat suurten orgaanisten rakenteiden piirtämisen muodollisine latauksineen melko nopeasti.
kun on oppinut piirtämään Lewis-rakenteita, heteroatomeille ei aina tarvitse piirtää yksinäisiä pareja, sillä voidaan olettaa, että kunkin atomin ympärillä on oikea määrä elektroneja, jotka vastaavat ilmoitettua muodollista varausta (tai sen puutetta). Silloin tällöin arvotaan kuitenkin yksinäisiä pareja, jos se auttaa selityksen selventämisessä.