Takaisin Lewis-rakenteiden kirjoittamiseen molekyyleille
kovalenttisen molekyylin luurankorakenne voidaan usein määrittää ottamalla huomioon rakenneosien atomien valenssit. Yleensä atomi, joka muodostaa suurimman määrän sidoksia, löytyy luurangon keskeltä, jossa se voi yhtyä mahdollisimman moneen muuhun atomiin.
Esimerkki 1: Hypokloorihapokkeen molekyylikaava on HOCl. Piirretään
rakennekaava.
liuos on useita mahdollisia tapoja liittää atomit yhteen
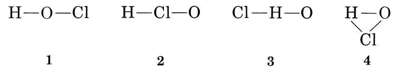
H: n tavanomainen valenssi on 1, joten rakenteet 3 ja 4, joissa on kaksi sidosta H: hon, voidaan eliminoida. Tavallinen Cl: n valenssi on myös 1, joten myös rakenne 2 voidaan sulkea pois. Rakenne 1 osoittaa H: n muodostavan yhden sidoksen, Cl: n muodostavan yhden ja O: n muodostavan kaksi yhtäpitävästi tavallisten valenssien kanssa, ja niin se valitaan.
valenssielektronien kokonaismäärä on 1 h: sta plus 6: sta O: sta plus 7: stä Cl: stä eli 14. Täytämme nämä luurankoon, joka meillä on.
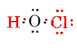
huomaa, että O, jolla oli suurin valenssi, on keskellä luuranko.
Esimerkki 2:
Piirrä hydroksyyliamiinille rakennekaava NH3O.
liuoksella on tässä tapauksessa n suurin valenssi (3), jota seuraavat o (2) ja H (1). Sekä N että O voivat muodostaa ”siltoja” muiden atomien välille, mutta H Ei. Siksi asetamme N ja O keskellä luuranko antaa
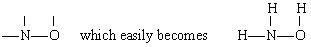
lisäämällä kolme h-atomia.
on yhteensä 5 + 3 + 6 = 14 valenssielektronia n: ltä, 3H: lta ja O: lta. nämä voidaan sijoittaa seuraavasti:
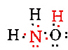
kun Lewisin Diagrammi on määritetty, molekyylikaava kirjoitetaan usein uudelleen muistuttamaan siitä, mikä rakennekaava on. Esimerkiksi hydroksyyliamiinin molekyylikaava kirjoitetaan yleensä nh3o: n sijasta NH2OH muistuttamaan siitä, että kaksi H: ta on sitoutunut N: ään ja yksi O: hon. Oletetaan, että kaavaa lukeva henkilö ymmärtää, että N: llä ja O: lla on kullakin yksi valenssielektroni jäljellä jaettavaksi keskenään, liittäen —NH2: n —OH: n kanssa. Joissakin tapauksissa useampi kuin yksi luurankorakenne täyttää myös kunkin atomin valenssin ja oktettisäännön. Esimerkiksi voidaan todentaa, että molekyylikaava C2H6O vastaa molempia seuraavista:
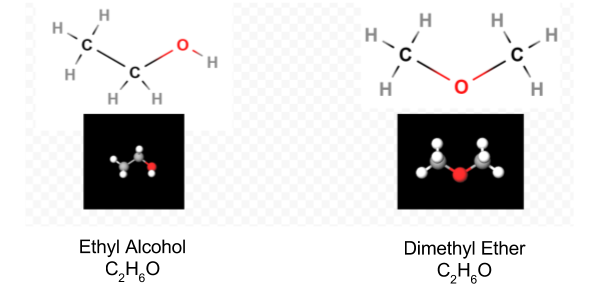
tällaisessa tapauksessa voimme vain päättää, mikä molekyylirakenne meillä on kokeella. Etyylialkoholin ominaisuudet vedellä laimennettuna ja kulutettuna tunnetaan hyvin. Dimetyylieetteri on kaasu. Leikkaussaleissa käytetyn dietyylieetterin tavoin se on erittäin räjähdysherkkä ja voi nukuttaa. Isomeereiksi sanotaan kahta molekyyliä, kuten dimetyylieetteriä ja etyylialkoholia, joilla on sama molekyylikaava mutta eri rakennekaavat.
Takaisin Lewis Structures for Molecules
kuittaukset:
C2h6o-molekyylit ja niiden luustorakenteet luotiin MolView ’ n avulla.