Reaktionopeudet
nopeuksien vaihtelu, kun muutetaan halogeenia
Reaktionopeudet kasvavat järjestyksessä HF-HCl – HBr-HI. Vetyfluoridi reagoi paljon hitaammin kuin kolme muuta, eikä sitä yleensä huomioida näistä reaktioista puhuttaessa.
vetyhalidien reagoidessa alkeenien kanssa vety-halogeenisidos on katkaistava. Sidoksen vahvuus laskee HF: stä HI: hen mentäessä, ja vety-fluorisidos on erityisen vahva. Koska vedyn ja fluorin välistä sidosta on vaikea murtaa, HF: n lisääminen on vääjäämättä hidasta.
nopeuksien vaihtelu kun muutetaan alkeenia
tämä koskee sekä epäsymmetrisiä alkeeneja että symmetrisiä. Yksinkertaisuuden vuoksi alla olevat esimerkit ovat kaikki symmetrisiä – mutta niiden ei tarvitse olla.
reaktionopeus kasvaa alkeenin monimutkaistuessa-siinä mielessä, että kaksoissidoksen kummassakin päässä on hiiliatomeihin kiinnittyneitä alkyyliryhmiä (kuten metyyliryhmiä). Esimerkiksi:
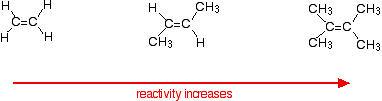
on kaksi tapaa tarkastella syitä tähän – jotka molemmat sinun täytyy tietää mekanismi reaktioita.
Alkeenit reagoivat, koska pi-sidoksen elektronit vetävät puoleensa asioita, joilla on millä tahansa asteella positiivinen varaus. Kaikki, mikä lisää elektronitiheyttä kaksoissidoksen ympärillä, auttaa tässä.
Alkyyliryhmillä on taipumus ”työntää” elektroneja pois itsestään kohti kaksoissidosta. Mitä enemmän alkyyliryhmiä on, sitä negatiivisemmaksi kaksoissidosten ympärillä oleva alue muuttuu.
mitä negatiivisesti varautunut alue on, sitä enemmän se vetää puoleensa vetykloridin kaltaisia molekyylejä.
tärkeämpi syy on kuitenkin reaktiossa muodostuvan väli-ionin stabiilisuus. Edellä mainitut kolme esimerkkiä tuottavat nämä karbokationit (karboniumionit) reaktion puolitievaiheessa:
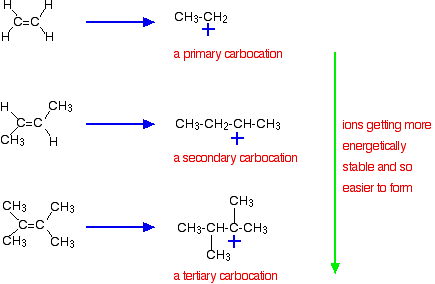
väli-ionien stabiilisuus säätelee reaktion aktivaatioenergiaa. Kun mennään kohti monimutkaisempia alkeeneja, reaktion aktivointienergia laskee. Se tarkoittaa, että reaktiot tulevat nopeammiksi.