Learning Objectives
tämän osion loppuun mennessä voit:
- Kirjoita Lewis-symbolit neutraaleille atomeille ja ioneille
- Piirrä Lewis-rakenteet, jotka kuvaavat sidosta yksinkertaisissa molekyyleissä
olemme keskustelleet erityyppisistä atomien ja/tai ionien välisistä sidoksista. Kaikissa tapauksissa näihin sidoksiin liittyy valenssikuoren elektronien jakamista tai siirtämistä atomien välillä. Tässä osiossa tutkitaan tyypillistä menetelmää valenssikuoren elektronien ja kemiallisten sidosten kuvaamiseksi, eli Lewis-symboleita ja Lewis-rakenteita.
Lewis-symbolit
käytämme Lewis-symboleja kuvaamaan atomien ja yksiatomisten ionien valenssielektronikonfiguraatioita. Lewis-symboli koostuu alkuainesymbolista, jota ympäröi yksi piste jokaista sen valenssielektronia kohti:
kuvassa 1 on Lewis-symbolit jaksollisen järjestelmän kolmannen kauden alkuaineille.

Kuva 1. Lewis-symbolit kuvaavat kunkin alkuaineen valenssielektronien määrää jaksollisen järjestelmän kolmannella jaksolla.
Lewis-symboleilla voidaan myös havainnollistaa kationien muodostumista atomeista, kuten tässä on esitetty natriumin ja kalsiumin osalta:

samoin niitä voidaan käyttää osoittamaan anionien muodostumista atomeista, kuten alla on esitetty kloorille ja rikille:

kuva 2 osoittaa Lewis-symbolien käytön elektronien siirtymiseen ioniyhdisteiden muodostuessa.

kuva 2. Kationeja muodostuu atomien menettäessä elektroneja, joita edustavat vähemmän Lewis-pisteet, kun taas anioneja muodostuu atomien saadessa elektroneja. Elektronien kokonaismäärä ei muutu.
Lewis-rakenteet
käytämme myös Lewis-symboleita osoittamaan kovalenttisten sidosten muodostumista, mikä näkyy Lewis-rakenteissa, piirroksissa, jotka kuvaavat molekyylien ja polyatomisten ionien sidoksia. Esimerkiksi kun kaksi klooriatomia muodostaa kloorimolekyylin, niillä on yksi elektronipari:

Lewis-rakenne osoittaa, että jokaisella Cl-atomilla on kolme elektroniparia, joita ei käytetä sidosaineena (joita kutsutaan yksinäisiksi pareiksi) ja yksi jaettu elektronipari (jotka on kirjoitettu atomien välille). Viivaa (tai viivaa) käytetään joskus osoittamaan yhteistä elektroniparia:

yhtä jaettua elektroniparia kutsutaan yhdeksi sidokseksi. Jokainen Cl-atomi vuorovaikuttaa kahdeksan valenssielektronia: yksinäisten parien kuusi ja yhden sidoksen kaksi.
Oktettisääntö
muut halogeenimolekyylit (F2, Br2, I2 ja At2) muodostavat sidoksia kuten kloorimolekyylissä: yksi yksittäinen sidos atomien välillä ja kolme yksinäistä elektroniparia atomia kohti. Näin jokaisella halogeeniatomilla on jalokaasuelektronikonfiguraatio. Pääryhmäatomien taipumusta muodostaa tarpeeksi sidoksia kahdeksan valenssielektronin saamiseksi kutsutaan oktettisäännöksi.
niiden sidosten lukumäärä, jotka atomi voi muodostaa, voidaan usein ennustaa oktetin saavuttamiseen tarvittavien elektronien määrästä (kahdeksan valenssielektronia); tämä pätee erityisesti jaksollisen järjestelmän toisen jakson epämetaaleihin (C, N, O ja F). Esimerkiksi ryhmän 14 alkuaineen jokaisella atomilla on uloimmassa kuoressaan neljä elektronia, joten oktetin saavuttamiseen tarvitaan neljä elektronia lisää. Nämä neljä elektronia voidaan saada muodostamalla neljä kovalenttista sidosta, kuten tässä havainnollistetaan hiilelle CCl4: ssä (hiilitetrakloridi) ja Piille sih4: ssä (silaani). Koska vety tarvitsee vain kaksi elektronia täyttääkseen valenssikuorensa, se on poikkeus oktettisäännöstä. Siirtymäelementit ja sisäiset siirtymäelementit eivät myöskään noudata oktettisääntöä:

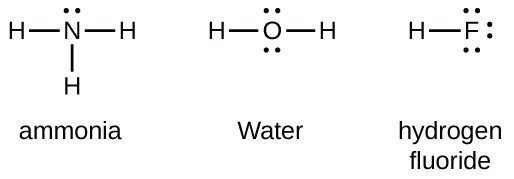
ryhmän 15 alkuaineella, kuten typellä, on atomin Lewis-symbolissa viisi valenssielektronia: yksi yksinäinen pari ja kolme paritonta elektronia. Oktetin saamiseksi nämä atomit muodostavat kolme kovalenttista sidosta, kuten NH3: ssa (ammoniakissa). Happi ja muut ryhmän 16 atomit saavat oktetin muodostamalla kaksi kovalenttista sidosta:
kaksois-ja kolmoissidos
kuten aiemmin mainittiin, kun atomipari jakaa yhden elektroniparin, kutsumme tätä yhdeksi sidokseksi. Atomipari voi kuitenkin joutua jakamaan useamman kuin yhden elektroniparin saavuttaakseen tarvittavan oktetin. Kaksoissidos muodostuu, kun atomiparin välillä on kaksi elektroniparia, kuten hiili-ja happiatomien välillä ch2o: ssa (formaldehydissä) ja kahden hiiliatomin välillä C2H4: ssä (eteenissä):
kolmoissidos muodostuu, kun atomipari jakaa kolme elektroniparia, kuten typpikaasussa (N2):
kirjoitettaessa Lewis-rakenteita Oktettisäännöllä
hyvin yksinkertaisille molekyyleille ja molekyyli-ioneille voidaan Lewis-rakenteet kirjoittaa vain parittamalla parittamattomat elektronit rakenneosien atomeihin. Katso nämä esimerkit:

monimutkaisempien molekyylien ja molekyyli-ionien osalta on hyödyllistä noudattaa tässä esitettyä vaiheittaista menettelyä:
- Määritä valenssielektronien (ulkokuoren) kokonaismäärä.
- Piirrä molekyylistä luurankorakenne järjestäen atomit keskusatomin ympärille. (Yleensä vähiten elektronegatiivinen elementti tulee sijoittaa keskelle.) Liittää jokaisen atomin keskusatomiin yhdellä sidoksella (yksi elektronipari).
- jakaa jäljellä olevat elektronit yksinäisinä pareina pääteatomeille (vetyä lukuun ottamatta), jolloin kunkin atomin ympärille muodostuu oktetti.
- aseta kaikki jäljellä olevat elektronit keskusatomille.
- järjestää uloimpien atomien elektronit uudelleen niin, että syntyy useita sidoksia keskusatomin kanssa, jotta saadaan oktetteja aina kun mahdollista.
Määrittäkäämme Pbr3: n Lewis-rakenne yllä olevien vaiheiden avulla:
- Vaihe 1: Määritä valenssin (ulkokuoren) elektronien kokonaismäärä.
\suuri \begin {array}{l}\\ \phantom{\rule{0.8 em}{0ex}} {\text{PBR}}_{3}\\ \phantom {\rule{0.8 em}{0EX}}\text{p: 5 valenssielektronia/atomi}\times \text{1 atom}=5\\ \alleviivaa{+\text{Br: 7 valenssielektronia/atomi}\times \text{3 atomia}=21}\\ \\ \phantom{\rule{15.95em}{0ex}} = \text{26 valenssielektronia}\end{array}
- Vaihe 2: Piirrä molekyylin luurankorakenne järjestäen atomit keskusatomin ympärille. (Yleensä vähiten elektronegatiivinen elementti tulee sijoittaa keskelle.) Liittää jokaisen atomin keskusatomiin yhdellä sidoksella (yksi elektronipari).

- Vaihe 3: Jaa jäljellä olevat elektronit yksinäisinä pareina pääteatomeille (vetyä lukuun ottamatta) ja täytä oktetti jokaisen atomin ympärille.
-
 Vaihe 4: Aseta kaikki jäljellä olevat elektronit keskusatomille.
Vaihe 4: Aseta kaikki jäljellä olevat elektronit keskusatomille.

Huomautus: Vaihe 5: ei tarvita, koska kaikilla atomeilla on oktetti.
Määrittäkäämme Ch2o: n Lewis-rakenne.
- Vaihe 1: Määritetään valenssin (ulkokuoren) elektronien kokonaismäärä.
\suuri \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{H}_{2}}\text{CO}\\ \phantom{\rule{0.8 em}{0ex}}\text{H: 1 valenssielektroni/atomi}\times \text{2 atom}=2\\\text{c: 4 valenssielektronia/atomi}\times \text{1 atom}=4\\ \alleviivaa{+\text{O: 6 valenssielektronia/atomi}\ajat \text{1 atoms}=6}\\ \ \ \\Phantom {\rule{15.95 em}{0EX}}=\text{12 valenssielektronia} \ end{array}
- Vaihe 2: Piirrä molekyylin luurankorakenne järjestäen atomit keskusatomin ympärille. (Yleensä vähiten elektronegatiivinen elementti tulee sijoittaa keskelle.) Liittää jokaisen atomin keskusatomiin yhdellä sidoksella (yksi elektronipari).

- Vaihe 3: Jaa jäljellä olevat elektronit yksinäisinä pareina pääteatomeille (vetyä lukuun ottamatta) ja täytä oktetti jokaisen atomin ympärille.

- Vaihe 4: ei tarvita, koska kaikki elektronit on sijoitettu. Hiilellä ei kuitenkaan ole oktettia,
- Vaihe 5: Järjestele uloimpien atomien elektronit uudelleen niin, että syntyy useita sidoksia keskusatomin kanssa, jotta saadaan oktetteja aina kun mahdollista.

Esimerkki 1: Writing Lewis Structures
Nasan Cassini-Huygens mission havaitsi Titanissa, yhdessä Saturnuksen kuista, suuren myrkyllisen vetysyanidipilven (HCN). Mitkä ovat näiden molekyylien Lewis-rakenteet?
Tarkista oppisi
hiilidioksidi, CO2, on fossiilisten polttoaineiden palamisen tuote. CO2 on vaikuttanut maailmanlaajuiseen ilmastonmuutokseen. Mikä on CO2: n Lewis-rakenne?
keskeiset käsitteet ja yhteenveto
valenssielektroniset rakenteet voidaan visualisoida piirtämällä Lewis-symbolit (atomeille ja monatomisille ioneille) ja Lewis-rakenteet (molekyyleille ja polyatomisille ioneille). Yksinäisiä pareja, parittomia elektroneja sekä yksi -, kaksois-tai kolmoissidoksia käytetään osoittamaan, missä valenssielektronit sijaitsevat kunkin atomin ympärillä Lewis-rakenteessa. Useimmat rakenteet—erityisesti toisen rivin alkuaineita sisältävät—noudattavat oktettisääntöä, jossa jokaista atomia (H: ta lukuun ottamatta) ympäröi kahdeksan elektronia. Poikkeuksia oktettisäännöstä esiintyy parittomille elektronimolekyyleille (vapaat radikaalit), elektronipuutteisille molekyyleille ja hypervalenteille molekyyleille.
harjoitukset
- kirjoittavat Lewis-symbolit jokaiselle seuraavista ioneista:
- As3 –
- I –
- Be2 +
- O2 –
- Ga3 +
- Li +
- N3–
- merivedessä on monia yksiatomisia ioneja, muun muassa seuraavassa luettelossa alkuaineista muodostuneita ioneja. Kirjoita Lewis-symbolit seuraavista alkuaineista muodostuville yksiatomisille ioneille:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- kirjoita kunkin seuraavan ioniyhdisteen ionien Lewis-symbolit ja sen atomin Lewis-symbolit, josta ne muodostuvat:
- MgS
- Al2O3
- Gacl3
- K2O
- Li3N
- KF
- alla luetelluissa Lewis-rakenteissa m ja X edustavat eri alkuaineita jaksollisen järjestelmän kolmannessa jaksossa. Kirjoita kunkin yhdisteen kaava käyttäen kunkin alkuaineen kemiallisia symboleja:
- Kirjoita Lewis-rakenne diatomiselle molekyylille P2, epävakaalle fosforille, jota esiintyy korkean lämpötilan fosforihöyryssä.
- Kirjoita Lewis-rakenteet seuraaville:
- H2
- HBr
- PCl3
- Kirjoita Lewis-rakenteet seuraaville:
- O2
- H2CO
- AsF3
- SiCl4
Sanasto
kaksoissidos: kovalenttinen sidos, jossa kaksi elektroniparia on jaettu kahden atomin kesken
vapaa radikaali: molekyyli, joka sisältää parittoman määrän elektroneja
hypervalentti molekyyli: molekyyli, joka sisältää vähintään yhden pääryhmän alkuaineen, jonka valenssikuoressa on enemmän kuin kahdeksan elektronia
Lewis-rakenne: kaavio, joka esittää molekyylissä tai ionissa yksinäisiä elektronipareja ja sidospareja
Lewisin symboli: symboli alkuaineelle tai monatomiselle Ionille, joka käyttää pistettä edustamaan jokaista alkuaineen tai ionin valenssielektronia
yksinäinen pari: kaksi (pari) valenssielektronia, joita ei käytetä kovalenttisen sidoksen muodostamiseen
oktettisääntö: ohje, jonka mukaan pääjoukon atomit muodostavat rakenteita, joissa kahdeksan valenssielektronia vuorovaikuttaa kunkin ytimen kanssa, laskien sidoselektronien vuorovaikuttavan molempien sidoksella yhdistettyjen atomien kanssa
yhden sidoksen: sidos, jossa yksi elektronipari jakautuu kahden atomin kesken
kolmoissidos: sidos, jossa kolme elektroniparia on jaettu kahden atomin kesken


 HCN: elektroneja ei ole jäljellä
HCN: elektroneja ei ole jäljellä




















