Introduction
Jännitesuojatut kaliumkanavat muodostavat suuren ja monimuotoisen perheen, joka säilyy evolutionaarisesti. Ihmisen jännitekanavageenejä on 40, jotka kuuluvat 12 alaheimoon. Näillä KV-kanavilla näkyy laajoja jakaumia hermostossa ja muissa kudoksissa. Liikuteltavissa soluissa, kuten neuroneissa, kardiomyosyyteissä ja lihaksissa, KV-kanavat säätelevät toimintapotentiaalien aaltomuotoa ja laukaisumallia. KV-kanavat voivat myös säädellä useiden eri solutyyppien solumäärää, proliferaatiota ja migraatiota.
Jännitegeneroidut kaliumkanavat (KV) kuuluvat yhteen suurimmista ja erittäin evolutionaarisesti säilyneistä ionikanavaperheistä . Jokainen KV-kanava sisältää neljä samanlaista tai identtistä huokosia muodostavaa α-alayksikköä, ja se voi sisältää myös ylimääräisiä β-alayksiköitä, jotka voivat vaikuttaa kanavan toimintaan ja/tai lokalisointiin . Kukin KV-kanavien huokosia muodostava alayksikkö sisältää kuusi transmembrane-segmenttiä (S1-S6), joista neljä ensimmäistä transmembrane-segmenttiä (S1-S4) muodostavat jännitesensorin ja kaksi viimeistä transmembrane-segmenttiä, jotka reunustavat huokosilmukkaa (S5-P-S6) huokosdomaanina. Sen lisäksi, että ihmisellä, hiirellä ja rotalla on kunkin KV-kanavageenin kromosomin sijainti, kanavan fysiologiset ja farmakologiset ominaisuudet sekä sen kudosjakautuminen ja patofysiologia on saatu kansainvälisen farmakologian liiton (NC-IUPHAR) Nimistökomitean Jännitetyhjennettyjä kaliumkanavia käsittelevän alakomitean Ionikanavatietokannasta. Tässä artikkelissa esitellään jännitetykkien kaliumkanavien monimuotoisuutta ja toimintoja.
prokaryooteissa syntynyt K+-selektiivisyys säilyy suuressa määrässä kaliumkanavia, joiden monimuotoisuus on huomattava . Kuten kuviosta 1 käy ilmi, jännitesuojatun kationikanavan superperheen evoluutiopuuta voidaan ehdottaa vertaamalla ihmisen perimässä olevia kanavageenejä muiden metatsoaanien, kuten hiiren, kanan, pallokalan, vaippaeläimen, hedelmäkärpäsen, hyttysen, sukkulamadon ja merivuokkon, geeneihin . Tämä evoluutiopuu hahmottelee k+-selektiivisyyden yhden alkuperän sisäisesti korjaaville kaliumkanaville (Kir), jänniteporttisille kaliumkanaville (KV) ja kaksihuokoisille kaliumkanaville (K2P). On kuitenkin tärkeää huomata, että selvä K+-selektiivisyys liittyy todennäköisesti evolutionaarisesti säilyneeseen organelle K+ – kanavaan, joka sijaitsee endosomeissa ja lysosomeissa .
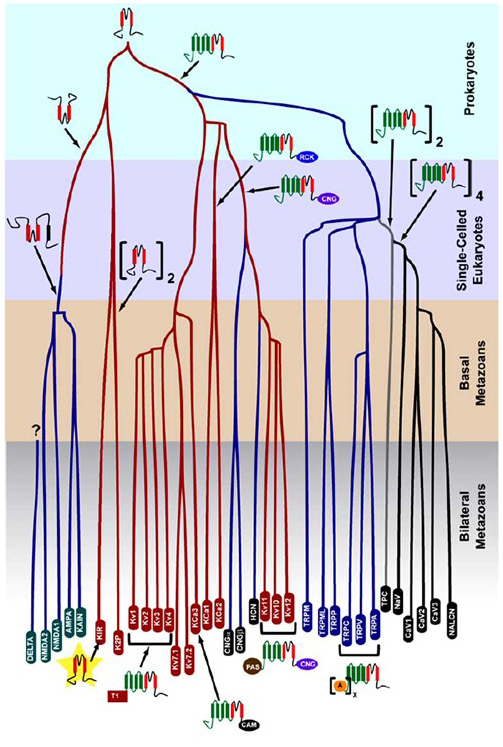
Kuva 1. Evoluutiopuu jänniteaitatun kationikanavan superperheen synnylle. Tämä evoluutiopuu perustuu cnidaarien ja kahdenvälisten metatsoaanien ionikanavien genominlaajuisiin analyyseihin , ja se kuvaa yhteistä alkuperää kaliumkanavien k+-selektiivisyydelle (joiden nimet ovat punaisia soikeita), jotka liittyvät tetrameerisiin syklisiin nukleotidi-aidattuihin kationikanaviin (CNG), hyperpolarisaatio-aidattuihin KATIONIKANAVIIN (HCN) ja TRP-kanaviin, dimeerisiin TPC-kanaviin sekä Monomeerisiin Na+ -, Ca2+ – ja nalcn-kanaviin. Haaran pituudet eivät heijasta aikaa. Alalaidassa olevat geeniperimänimet merkitsevät yksittäisiä haaroja. Ionotrooppiset glutamaattireseptorit ovat mukana sen hypoteesin perusteella, että ne ovat peräisin kaliumkanavan huokosia muodostavan domeenin inversiosta, jossa on kaksi transmembraanisegmenttiä (punainen). Jännite-anturi domain on neljä transmembrane segmentit (vihreä). A: ankryin toistaa; CAM: kalmoduliini-sitova domeeni; CNG: syklinen nukleotidi-sitova domeeni; PAS: per-ARNT-Sim-domeeni; RCK: k+ – domeenin konduktanssin säätelijä; T1: tetramerisaatio-domeeni.
ihmisen genomi sisältää ~80 kaliumkanavageeniä, joista 40 geeniä koodaa jännitekanavan huokosia muodostavia alayksiköitä, jotka kuuluvat 12 alaheimoon (Kuva. 2). Fysiologisesti jaettuna A-tyypin kaliumkanaviin, joissa näkyy nopea inaktivaatio ja viivästyneet tasasuuntaajan kaliumkanavat ilman nopeaa inaktivaatiota, nämä KV-kanavat ovat molekulaarisesti ja toiminnallisesti erilaisia. Nopea inaktivointi, joka voi vaikuttaa toimintapotentiaalin kestoon toistuvan ampumisen aikana, näkyy KV1-kanavissa, jotka sisältävät KV1: n.4 tai KVß1 -, KV3-ja KV4-kanavat . Viivästynyt tasasuuntaaja kaliumvirta alun perin ominaista Hodgkin ja Huxley sen rooli toimintapotentiaali todennäköisesti vastaa Kalmarin KV1 kanavat, jotka voivat luottaa RNA editointi saavuttaa joustavan toiminnallisen monimuotoisuuden kuten monet pienet aksonit jättiläinen kuitu lohko neuronien sulake muodostaa Kalmarin jättiläinen aksoni suurempi toiminta potentiaali johtumisnopeus .
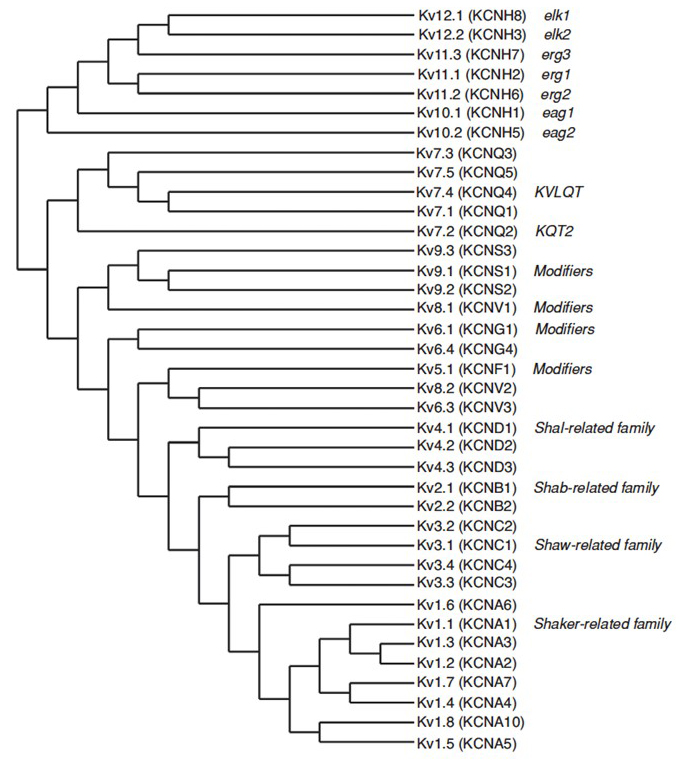
kuva 2. Fylogeneettinen puu KV1-12-perheille. Tämä fylogeneettinen puu syntyy hydrofobisen domeenin analyysien perusteella, jotka sisältävät kuusi transmembraanisegmenttiä (S1-S6) . Sekä IUPHAR-että hgnc-nimet (suluissa) on esitetty, samoin kuin muut yleisesti käytetyt nimet näille jännitteisille kaliumkanaville.
KV-kanavien huomattava moninaisuus voidaan saavuttaa KV-kanavan alayksiköiden sekoittumisen vuoksi. Jokaisessa KV1 -, KV2 -, KV3 -, KV4-ja KV7-suvussa voi muodostua homomeerisiä ja heteromeerisia kanavia, joilla on useita funktionaalisia ominaisuuksia . KV2-perheenjäsenet voivat myös kokoontua KV5 -, KV6 -, KV8-tai KV9-perheen jäsenten kanssa, joilla on rajoittuneempia ilmentymäkuvioita hermostossa ja sileissä lihaksissa, kuten kuvassa kaavamaisesti esitetään. 3.

kuva 3. KV kanavan monimuotoisuuden kautta sekoitus ja ottelu huokosia muodostavien kanavan alayksiköiden. (A) ominaisuuksiltaan ja jakaumaltaan erilaiset tetrameriset KV-kanavat käsittävät homomeeriset KV1 -, KV2 -, KV3 -, KV4-ja KV7-kanavat, eri jäsenten muodostamat heteromeeriset kanavat kunkin KV-kanavaperheen sisällä sekä KV2-suvun jäsenten muodostamat heteromeeriset kanavat, joilla on KV5 -, KV6 -, KV8-tai KV9-suvun jäsenet . KV5 -, KV6 -, KV8-ja KV9-suvut synnyttävät homomeerisia kanavia, jotka ovat sähköisesti äänettömiä todennäköisesti endoplasmaisessa retikulumissa pysymisen vuoksi, joten niistä käytetään nimitystä KVS. (B) KV2 – ja KVS-perheenjäsenten kokoonpanoon liittyy niiden n-ja C-terminaaliset sytoplasmat. (C, D) KV2-ja KVS-perheenjäsenten kokoonpano synnyttää heteromeerisia kanavia, joilla on erilainen jänniteriippuvuus (C) ja porttimekanismi (D) verrattuna KV2-perheen jäsenten muodostamiin homomeerisiin kanaviin .
KV-kanavien jänniteriippuvuuden ja kinetiikan funktionaaliset erot ovat niiden differentiaalisen vaikutus aktiopotentiaalimodulaatioon (Kuva. 4). Siinä missä KV1 -, KV4-ja KV7-kanavat vaativat aktivoituakseen matalia kalvojen depolarisaatiotasoja, KV2-ja KV3-kanavat aktivoituvat suuremmalla depolarisaatiolla. Entiset, matalajännitteiset, KV-kanavat voivat vaikuttaa toimintapotentiaalin syntymisen kynnykseen ja depolarisaation tai eksitatorisen synaptisen potentiaalin aikana syntyneiden toimintapotentiaalien määrään. Sen sijaan suurjännitteellä aktivoidut KV-kanavat voivat moduloida toimintapotentiaalin kestoa ja laukaisukuviota . KV-kanavien kinetiikka vaikuttaa myös siihen, miten ne vaikuttavat aktiopotentiaalin syntymiseen. Siinä missä pienjännitteellä aktivoidut KV1-kanavat, joilla on nopea aktivointi, voivat vaikuttaa toimintapotentiaalin kynnykseen ja aaltomuotoon, suurjännitteellä aktivoidut KV3-ja KV2-kanavat voivat aktivoitua peräkkäin toimintapotentiaalin aikana johtuen niiden aktivointikinetiikan erosta, ja KV2-kanavilla voi olla pitkäkestoisempia vaikutuksia hitaan inaktivointikinetiikkansa vuoksi. Lisäksi KV4-kanavat, joilla on nopea inaktivointi, voivat vaikuttaa aktiopotentiaalin aaltomuodon eroon toistuvan ampumisen aikana KV4-kanavan aktiivisuuden tukahduttamisen vuoksi depolarisaatiolla .
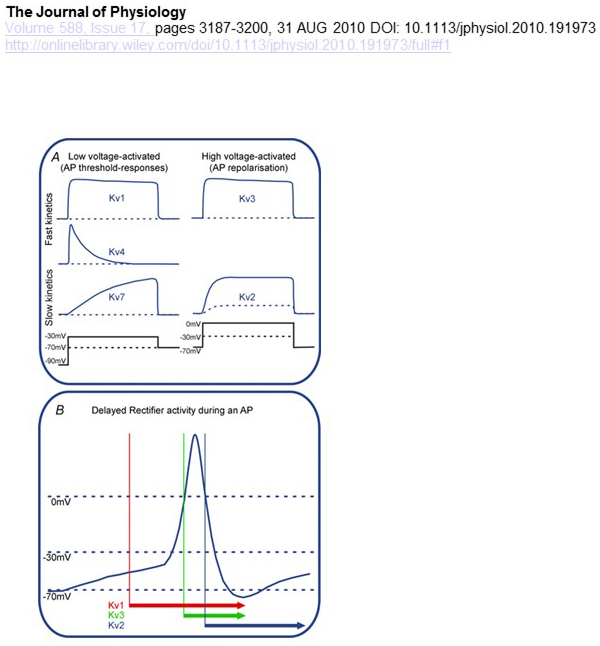
Kuva 4. KV-kanavien toiminnalliset erot ja niiden vaikutus toimintamahdollisuuksiin. (A) eri KV-kanavilla on erilainen jänniteriippuvuus aktivointiin ja erilainen kinetiikka . (B) matalajännitteiset aktivoidut KV1-kanavat, joilla on nopea kinetiikka, avautuvat, kun solu depolarisoituu kohti toimintapotentiaalin syntymisen kynnystä. Vaikka sekä KV2-että KV3-kanavat ovat suurjänniteaktivoituja, KV3-kanavat avautuvat nopeammin kuin KV2-kanavat toimintapotentiaalin aikana. KV2-kanavien sulkeutuminen voi myös kestää kauemmin toimintapotentiaalin vuoksi .
kaliumkanavamodulaattoreiden kyky muuttaa aktiopotentiaalia laukaisutapoja on herättänyt kysymyksen siitä, olisiko niillä terapeuttista arvoa . Kuten kuvassa. 5, erilaiset neurologiset ja psykologiset häiriöt voivat sisältää muutoksia toimintapotentiaalin laukaisumalleissa, joita voidaan moduloida KV-kanavan aktivaattoreilla ja salpaajilla . Jännitteellä varustetut kaliumkanavat voivat myös vaikuttaa solujen proliferaatioon ja migraatioon; KV-kanavamodulaattoreita onkin harkittu syövän kasvun ja etäpesäkkeiden mahdollisiin hoitoihin . Kuvassa. 6, KV1. 2-kanavarakennetta käytetään kaavamaisesti osoittamaan, että KV-kanavamodulaattorit voivat estää kanavan toimintaa joko sulkemalla kanavan läpäisyreitin, kuten ulompien huokosten estävien toksiinien ja sisempien huokosten estäjien tapauksessa, tai niiden vuorovaikutuksen kautta jännitesensorin kanssa kanavan suljetun tilan vakauttamiseksi, kuten gating-modifier-toksiinien tapauksessa. Vaihtoehtoisesti jotkut pienet molekyylit toimivat sitoutumalla porttikoneistoon gating-modifioijoina tai vuorovaikutuksessa α – Ja β-alayksiköiden välisen rajapinnan kanssa muuttaakseen kanavan toimintaa .
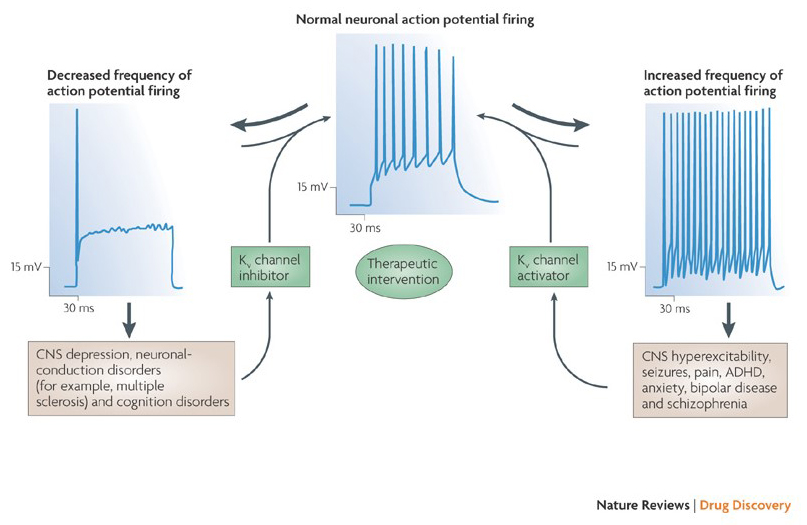
kuva 5. Mahdolliset sovellukset KV kanavamodulaattorit. Koska epänormaali toimintakyky on yhdistetty sairauksiin, kuten epilepsiaan ja MS-tautiin, KV-kanavan aktivoijia ja inhibiittoreita on harkittu sellaisten sairauksien mahdollisissa terapeuttisissa hoidoissa, joihin liittyy hermosolun ylivirittyneisyyden muutoksia .
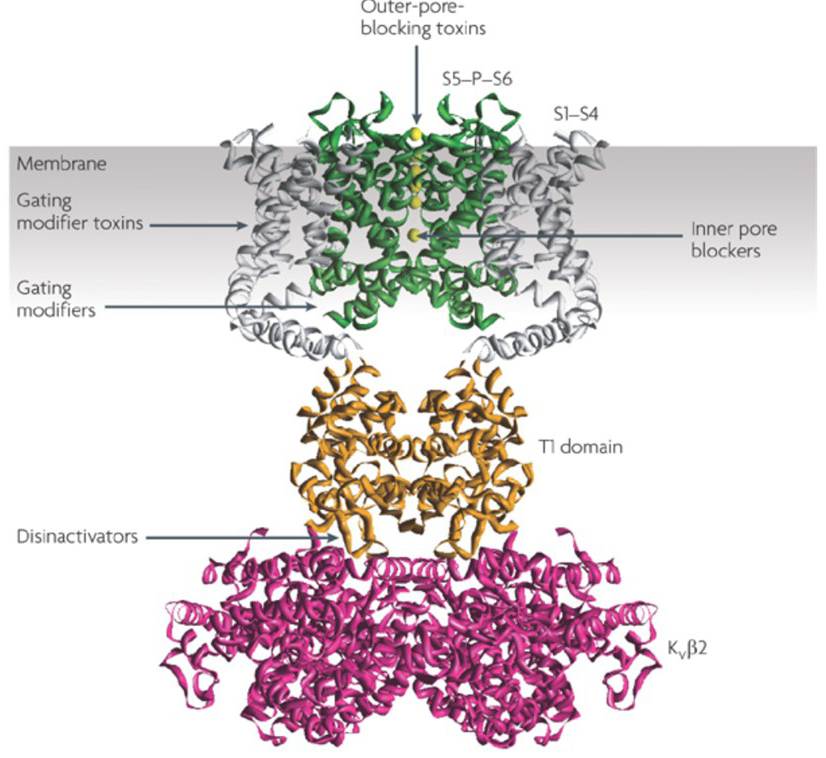
kuva 6. Esimerkkejä KV-kanavamodulaattoreiden toimintatavoista. Peptidimyrkyille ja pienille molekyyleille on useita eri tapoja moduloida KV-kanavan toimintaa. KV1 .2-rakenne esitetään vihreänä huokosdomeeneilla (S5-P-S6), harmaana jännitesensoridomeeneilla (S1-S4), oranssina T1-tetramerisaatiodomeeneilla ja Magentana KVß2-apualayksiköillä. Skorpionien, merivuokojen, käärmeiden ja kartiokotiloiden ulkohuokosia estävät toksiinit voivat sitoutua ulompaan eteiseen ja estää ioniläpäisyn. Hämähäkkien, kuten hanatoksiinin, gating modifier-toksiinit voivat olla vuorovaikutuksessa jännitesensorin kanssa suljetun tilan vakauden lisäämiseksi, mikä aiheuttaa jänniteriippuvuuskäyrän oikean suuntaisen siirtymisen kanavan aktivointia varten. On myös pienimolekyylisiä kanavamodulaattoreita, jotka sitoutuvat sisähuokosalpaajiin (sisähuokosalpaajiin), porttihuokosaranoihin (gating – modifioijiin) tai α-Ja β-alayksiköiden väliseen rajapintaan (disinaktivaattoreihin) .
kaliumkanavien huomattava selektiivisyys, jonka ansiosta K+-ionit voivat kulkea kanavahuokosten läpi suuruusluokkaa helpommin kuin pienemmät Na+-ionit ja lähes rajallisella diffuusionopeudella , johtuu selektiivisyyssuodattimen selkärangan karbonyylien kyvystä koordinoida k+ – ioneja , jotka on suurelta osin poistettu hydraatiokuoristaan, niin että useampi kuin yksi K+ – ioni liikkuu tämän huokosten kapeimman segmentin läpi yhdessä (kuva. 7) – pitkä huokosten yhden tiedoston k+ ionipermeaatio kuten ennustettu .
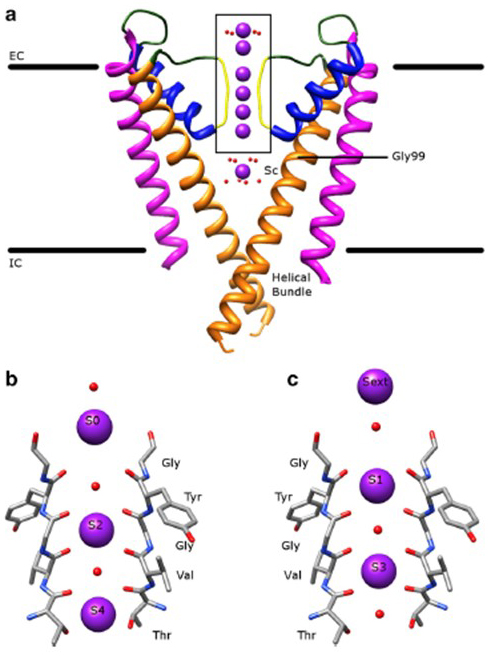
Kuva 7. Kaliumkanavien huokosalue. (a) KCSA: n rakenne johtavassa tilassa (PDB: 1k4c) , ulommat kierteet magentassa, sisemmät kierteet oransseissa, huokoskierteet sinisissä ja selektiivisyyssuodatin keltaisessa. K + – ionit ovat violetteja, kun taas sitä ympäröivät vesimolekyylit ovat punaisia. EC: solunulkoinen; IC: solunsisäinen. (b, c) selektiivisyyssuodatin KCSA: n rakenteen boxed-alueella esitetään siten, että K+ ionit miehittävät joko S2-ja S4-asemat (b) tai S1-ja S3-asemat (c), jotta voidaan havainnollistaa K+ – ionipermeaatiota yhtenä tiedostona .
KV-kanavan aktivoinnin jänniteriippuvuus johtuu niiden jännitesensorialueista . Kuten kuvassa. 8, KV-kanavilla ja niihin liittyvillä kanavilla, kuten jännitesuojatuilla natriumkanavilla ja TRPV1-kanavilla samassa superperheessä on samanlaiset huokos-ja jännitesensori-verkkotunnusten järjestelyt. Yhden alayksikön jännitesensori-domain vuorovaikuttaa naapurialayksikön huokosdomaanin kanssa toimialueen swap-konfiguraatiossa, ja jännitesensorin sisällä positiivisesti varautuneet arginiinijäämät S4: llä voivat vuorovaikuttaa negatiivisesti varautuneiden happamien jäämien kanssa naapurimaiden kierteissä (Kuva. 9).
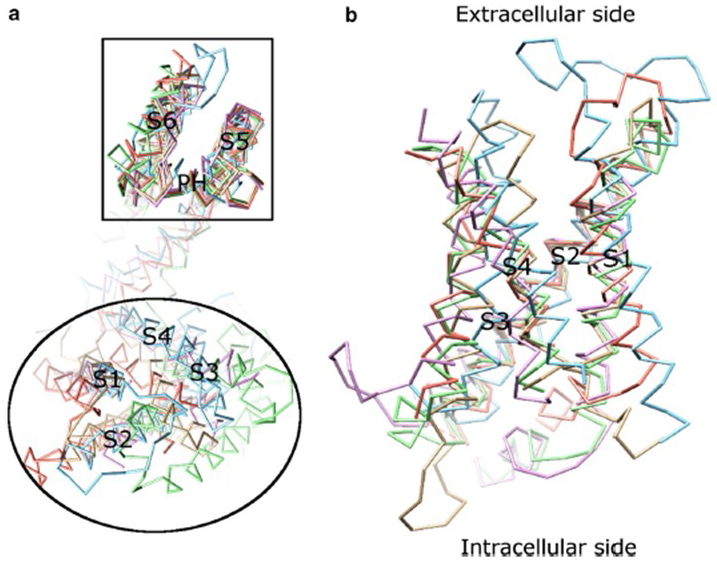
Kuva 8. Jänniteanturi domain jännitteellä aidattuja kaliumkanavia. (a) eri ionikanavien huokosdomeenin (S5-P-S6) yhdenmukaistaminen paljastaa, että niiden jännitesensoridomeenit (S1-S4) voivat ottaa erilaisia orientaatioita (katsottuna solunulkoiselta puolelta). (b) KV1.2: n (PDB: 3LUT, light magenta) jännitesensorialueen päällekkäisyys mlotik1: n (PDB: 3beh, vaaleanruskea), Navabin (PDB: 3RVY, vaaleanvihreä), NaVRh: n (PDB: 4DXW, vaaleanoranssi) ja TRPV1: n (PDB: 3j5p, Vaaleansininen) jännitesensorialueiden kanssa (kalvosta katsottuna).
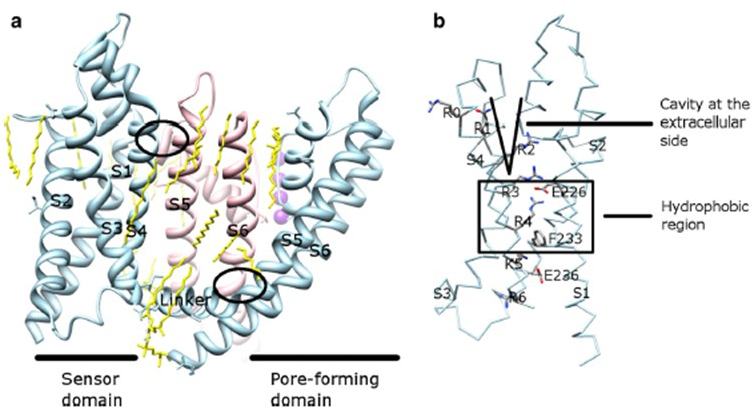
Kuva 9. Yhteystiedot huokosalueen ja jännite anturi verkkotunnuksen KV kanavat. (a) KV1.2-KV2.1-kimaira (PDB: 2r9r), jossa yhden alayksikön jännite-anturi (Vaaleansininen) ottaa yhteyttä naapurialayksikön (vaaleanpunainen) huokosalueeseen. Solunsisäisiin kontakteihin liittyy S4-S5-linkerin vuorovaikutus S6: n kanssa, ja solunulkoisiin kontakteihin liittyy S1: n ja huokoskierteen välinen vuorovaikutus . Kanavaa ympäröivät lipidit (keltaiset) sekä huokosdomeenin ja jännitesensoridomeenin välissä ovat havaittavissa kiderakenteessa. b) S4: n emäksiset jäämät ja happamat jäämät niiden läheisyydessä jänniteanturin alueella .
Jännitesidottuihin kaliumkanaviin liittyvät Kanavapatiat ilmenevät laajasti eri kudoksissa. Neuroneissa ne kohdistuvat erilaisiin alisolukohtiin(Kuva. 10), ja eri alayksiköiden koostumuksia sisältäviä kanavia voi olla eri alapopulaatioissa neuroneissa . KV-kanavan geenien mutaatiot voivat aiheuttaa neurologisia sairauksia, kuten episodista ataksiaa ja epileptikkoja, sydänsairauksia ja kuuroutta . KV-kanavan toiminnan evolutiivinen säilyminen ilmenee esimerkiksi KV1-ortologien mutaation aiheuttamista samankaltaisista liikehäiriöistä ihmisellä, hiirellä ja hedelmäkärpäsellä .
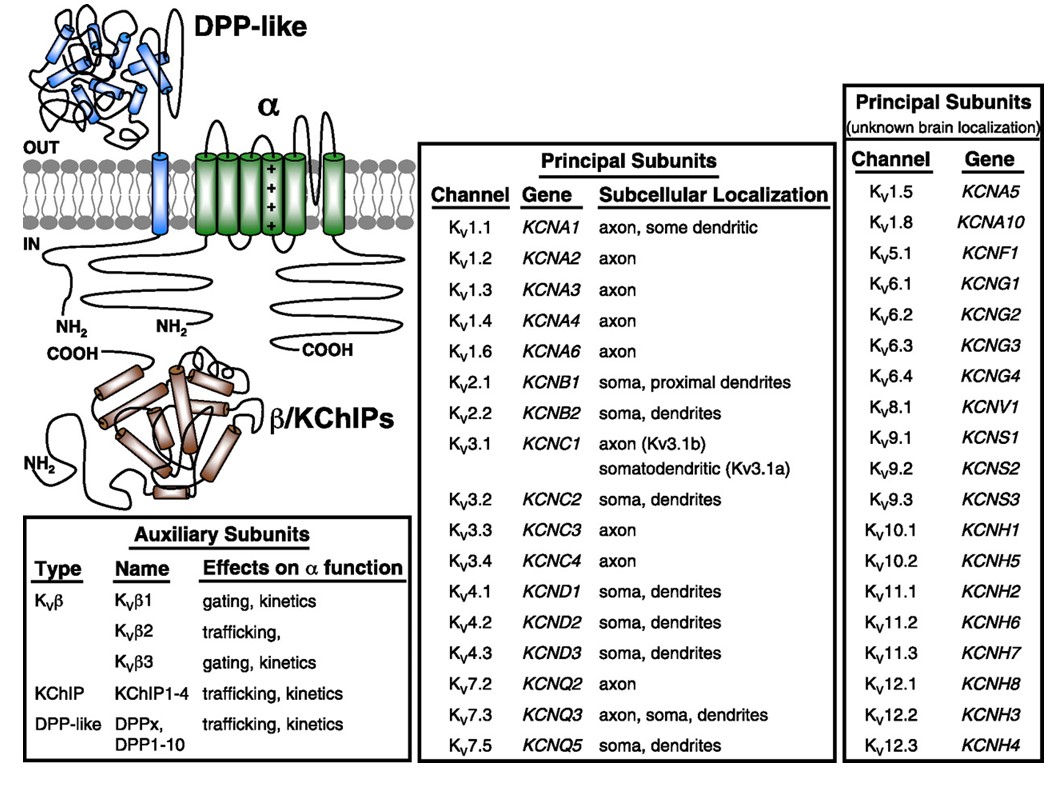
Kuva 10. Jännitteellä varustettujen kaliumkanavien solunalainen jakautuminen. Vasemmassa yläkulmassa olevassa kaaviossa on KV4-kanava, jossa on kaksi erilaista apualayksikköä. Eri KV-kanavien subsellulaarinen lokalisointi nisäkkäiden keskusteuroneissa on merkitty keskimmäiseen ruutuun .
viitteet ja huomautukset
1.Hille, B., Ionic Channels of Excitable Membranes, 3rd, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K (+) kanavat: funktio-rakenteellinen yleiskatsaus. Compr Physiol, 2012. 2(3): s. 2087-149.
3.Vacher, H., D. P. Mohapatra ja J. S. Jänniteriippuvaisten ionikanavien trimmeri, lokalisointi ja kohdentaminen nisäkkäiden keskusteuroneissa. Physiol Rev, 2008. 88(4): s. 1407-47.
4.Jegla, TJ, ym., Ihmisen ionikanavan kehitys. Comb Chem Korkean Suoritustehon Näyttö, 2009. 12(1): s. 2-23.
5.Cang, C. ym., TMEM175 on Lysosomaalista toimintaa säätelevä Organelle K (+) – kanava. Cell, 2015. 162(5): s. 1101-12.
6.Hodgkin, A. L. ja A. F. Huxley, natrium-ja kaliumionien kuljettamat Virrat loligon jättiläisaksonin kalvon läpi. J Fysiol, 1952. 116(4): s. 449-72.
7.Rosenthal, JJ, T. I. Liu ja W. F. Gilly, perhe viivästynyt tasasuuntaaja KV1 cDNAs osoittaa solun tyypin spesifinen ilmentymä Kalmarin stellaatti ganglion / jättiläinen kuitu lohko monimutkainen. J Neurosci, 1997. 17(13): s. 5070-9.
8.Nuoret, J. Z., fuusioituneet hermosolut ja synaptiset kontaktit pääjalkaisten jättimäisissä hermokuiduissa. Phil Trans R Soc Lond B, 1939. 229: s. 465-503.
9.Rosenthal, J. J. ja F. Bezanilla, laaja editointi mrnas varten Kalmarin viivästynyt tasasuuntaaja K + kanava säätelee alayksikön tetramerisaatio. Neuron, 2002. 34(5): s. 743-57.
10.Jan, L. Y. ja Y. N. Jan, jännitteellä aidatut kaliumkanavat ja sähköisten merkinantolaitteiden monimuotoisuus. J Fysiol, 2012. 590(11): s. 2591-9.
11.Johnston, J., I. D. Forsythe, ja C. Kopp-Scheinpflug, menossa natiivi: jännitteellä aidatut kaliumkanavat, jotka säätelevät hermosolujen kiihtyvyyttä. J Fysiol, 2010. 588 (Pt 17): s. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8 ja KV9 alayksiköt: ei yksinkertaisia hiljaisia sivullisia. J Gen Physiol, 2016. 147 (2): s. 105-25.
13.Wulff, H., N. A. Castle ja L. A. Pardo, Jännitesuojatut kaliumkanavat terapeuttisina kohteina. Nat Rev Drug Discov, 2009. 8(12): s. 982-1001.
14.Bates, E., Ionikanavat kehityksessä ja syövässä. Annu Rev Cell Dev Biol, 2015. 31: s. 231-47.
15.Huang, X ja L. Y. Jan, tähtäävät kaliumkanaviin syövässä. J Cell Biol, 2014. 206(2): s. 151-62.
16.Huang, X., et al. Eag2: n kaliumkanava, joka toimii aivokasvainkohteena. Nat Neurosci, 2015. 18(9): s. 1236-46.
17.Kunzelmann, K., Ion channels and cancer. J Membr Biol, 2005. 205 (3): s. 159-73.
18.Li M. ja Z. G. Xiong, ionikanavat syöpähoidon kohteina. Int J Physiol Patophysiol Pharmacol, 2011. 3(2): s. 156-66.
19.Pardo, L. A., Jännitteisillä kaliumkanavilla solujen proliferaatiossa. Fysiologia (Bethesda), 2004. 19: s. 285-92.
20.Urrego, D., et al., Kaliumkanavat solusyklissä ja solujen proliferaatiossa. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): s. 20130094.
21.Zhou, Y., et al., K+ channel-Fab-kompleksin paljastama ionikoordinaation ja hydraation kemia 2,0 a-resoluutiolla. Luonto, 2001. 414(6859): s. 43-8.
22.Mackinnon, R., kaliumkanavat. FEBS Lett, 2003. 555(1): s. 62-5.
23.Kuang, Q., P. Purhonen ja H. Hebert, kaliumkanavien rakenne. Cell Mol Life Sci, 2015. 72(19): s. 3677-93.
24.Isacoff, E. Y., L. Y. Jan, and D. L. Minor, Jr., Conduits of life ’ s spark: a perspective on ion channel research since the birth of neuron. Neuron, 2013. 80(3): s. 658-74.
25.Swartz, kj, aistii jännitteen lipidikalvoissa. Luonto, 2008. 456(7224): s. 891-7.
26.Nusser, Z., ionikanavien differentiaalinen subsellulaarinen jakautuminen ja hermosolujen toiminnan monimuotoisuus. Curr Opin Neurobiol, 2012. 22(3): s. 366-71.
27.Lujan, R., kaliumkanavien järjestäminen neuronaalisella pinnalla. J Chem Neuroanat, 2010. 40(1): s. 1-20.
28.Abriel, H. ja E. V. Zaklyazminskaya, sydämen kanavointipatiat: geneettiset ja molekyylimekanismit. Gene, 2013. 517(1): s. 1-11.
29.Kullmann, D. M. ja M. G. Hanna, neurologiset häiriöt, jotka johtuvat perityistä ionikanavamutaatioista. Lancet Neurol, 2002. 1(3): s. 157-66.
30.Lehmann-Horn, F. Ja K. Jurkat-Rott, Jännitesuojatut ionikanavat ja perinnöllinen sairaus. Physiol Rev, 1999. 79(4): s. 1317-72.
31.Villa, C. ja R. Combi, kaliumkanavat ja ihmisen epileptiset fenotyypit: päivitetty yleiskatsaus. Front Cell Neurosci, 2016. 10: s. 81.
32.Long, S. B., E. B. Campbell ja R. Mackinnon, nisäkkäiden jänniteriippuvaisen Ravistelijaperheen K+-kanavan kiderakenne. Tiede, 2005. 309 (5736): s. 897-903.
33.Chen, X., et al., Kokopitkän ravistelijan kaliumkanavan KV1. 2 rakenne normaalitilaan perustuvalla Röntgenkristallografisella tarkennuksella. Proc Natl Acad Sci U S A, 2010. 107(25): s. 11352-7.
34.Clayton, G. M., et al., Bakteerien syklisen nukleotidisäädellyn kanavan transmembraanialueiden rakenne. Proc Natl Acad Sci U S A, 2008. 105(5): s. 1511-5.
35.Payandeh, J. ym., Jännitesuojatun natriumkanavan kiderakenne. Luonto, 2011. 475(7356): s. 353-8.
36.Zhang, X., et al., Kiderakenne nachbac-jännitteellä varustetun natriumkanavan ortologiasta. Luonto, 2012. 486(7401): s. 130-4.
37.Liao, M., et al., Elektronikryomikroskopialla määritetyn TRPV1-ionikanavan rakenne. Luonto, 2013. 504 (7478): s. 107-12.
38.Long, S. B. ym., Jännitteestä riippuvaisen K+-kanavan atomirakenne lipidikalvomaisessa ympäristössä. Luonto, 2007. 450(7168): s. 376-82.