se ei ole itsestään selvää. Valenssielektronit ovat niitä, jotka ovat tärkeitä kemiallisessa sidoksessa. Siirtymämetallien kohdalla sana ”tärkeä” vaihtelee asiayhteydestä riippuen.
on helpompaa ja käytännöllisempää kuvata, mitkä orbitaalit ovat valenssiorbitaaleja siirtymämetallien kohdalla (tosin lantanidien ja aktinidien kohdalla se käy hankalaksi).
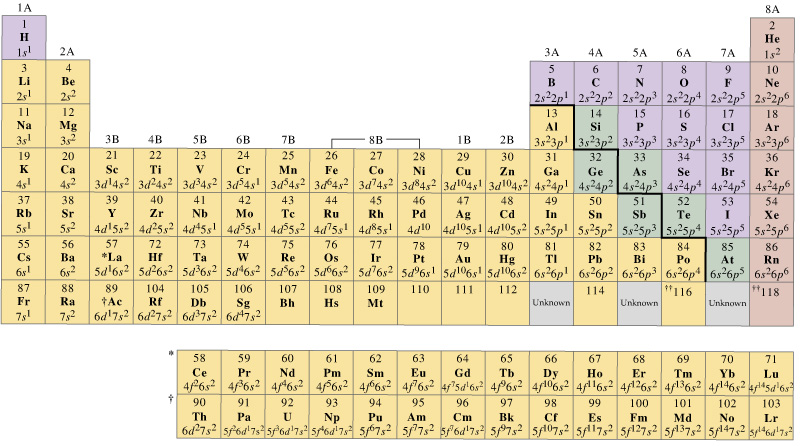
yleensä ensimmäisen rivin siirtymämetalleilla on joukko valenssiorbitaaleja, jotka sisältävät niiden #4s# ja #3d# ’ s, mutta valenssielektronien määrä vaihtelee. Esimerkiksi
…

- Skandiumilla on järkevää olla jopa kolme valenssielektronia, koska on olemassa #”Sc”^(+3)# hapetustila (esimerkiksi #”ScCl”_3#), mutta ei #”SC”^(+4)# tai korkeampi. Hapetustila # + 3# olisi vaatinut kolmen valenssielektroninsiirron, jos se muodostaisi puhtaan kationin.
- kromilla voi olla jopa kuusi valenssielektronia, jotka sisältäisivät sen #3D# – elektronit, koska se voi saavuttaa #+6# hapetustilan (eli #”Cr”_2″O”_7^(2 -)#, tai # ”CrO”_4^(2-)#).
- kuparilla on yleensä #+1# hapetustila (esimerkiksi #”CuCl”#), joten on järkevää, että se käyttää yhtä #4s# – elektroniaan useimmiten valenssielektroninaan (- elektroneinaan). Mutta #+2# hapetustila tunnetaan myös(esim. #”CuCl”_2#), joten se kykenee ottamaan #bb(3d)# – elektroneistaan myös valenssielektroninsa (- elektroniensa).
toisaalta voidaan helposti sanoa, että ensimmäisen rivin siirtymämetallien valenssiorbitaalit ovat #4s# ja #3D# orbitaalit.
yleisesti sanoisin, että siirtymämetallien (ja lantanidien ja aktinidien) valenssielektronien määrä vaihtelee arvaamattomalla tavalla, mutta valenssiorbitaalit voidaan joskus ennustaa riittävän kemiallisella intuitiolla.
DISCLAIMER: lantanidien ja aktinidien on kuitenkin yleensä vaikea ennustaa, mitkä orbitaalit ovat valensseja.
esimerkiksi aktinideilla on #5f# ja #6d# orbitaalit hyvin lähellä energialtaan #7s# orbitaalejaan, joten voimme arvata ja sisällyttää #7s#, #6D# ja #5f# valenssiavaruuteen (vaikka #6d# orbitaalit ovat tyhjiä) atomienergialaskentaa tehtäessä.