Common bonding patterns in organic structures
a fent ismertetett módszerek a Lewis-struktúrák megrajzolására és az atomok formális töltéseinek meghatározására alapvető kiindulópontot jelentenek egy kezdő szerves vegyész számára, és nagyon fognak dolgozni, ha kis, egyszerű struktúrákkal foglalkoznak. De ahogy el tudod képzelni, ezek a módszerek indokolatlanul fárasztóvá és időigényessé válnak, amikor nagyobb struktúrákkal kezdünk foglalkozni. Irreális lenne például azt kérni, hogy rajzoljuk le alább a Lewis-struktúrát (a DNS-t alkotó négy nukleozid építőelem egyikét), és határozzuk meg az összes formális töltést úgy, hogy atomonként összeadjuk a vegyértékelektronokat.
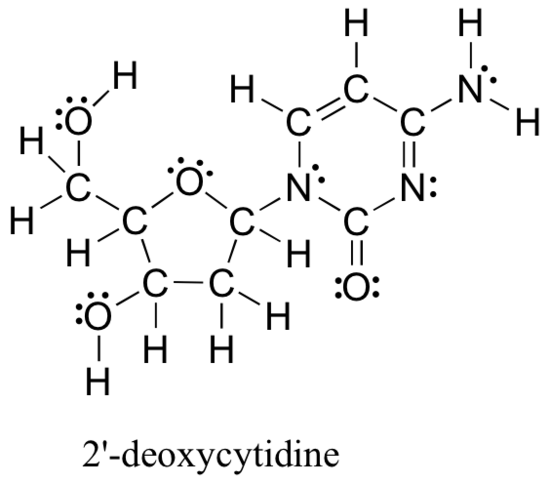
és mégis, mint szerves vegyészek, és különösen a biológiai molekulákkal foglalkozó szerves vegyészek, hamarosan várhatóan rendszeresen megrajzolják az ilyen nagy molekulák szerkezetét. Nyilvánvaló, hogy fejleszteni kell a nagy struktúrák gyors és hatékony rajzolásának képességét és a hivatalos díjak meghatározását. Szerencsére ezt a képességet nem túl nehéz elérni – mindössze néhány parancsikonra és némi gyakorlatra van szükség a közös kötési minták felismerésében.
kezdjük a szénnel, amely a szerves vegyészek legfontosabb eleme. A szénről azt mondják, hogy tetravalens, ami azt jelenti, hogy általában négy kötést képez. Ha megnézzük a metán, a metanol, az etán, az etén és az etin egyszerű szerkezetét az előző szakasz ábráin, gyorsan fel kell ismernünk, hogy minden molekulában a szénatomnak négy kötése van, és formális töltése nulla.
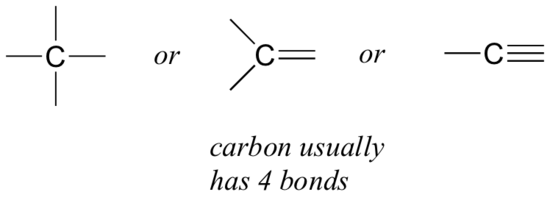
ez egy olyan minta, amely a legtöbb szerves molekulában megmarad, de vannak kivételek is.
szén-dioxidban a szénatom mindkét oldalán kettős kötéssel rendelkezik az oxigénnel (O=C=O). Később ebben a fejezetben és ebben a könyvben példákat fogunk látni a karbokációknak és karbanionoknak nevezett szerves ionokra, amelyekben a szénatom pozitív vagy negatív formális töltést visel. Ha egy szénnek csak három kötése és egy kitöltetlen vegyértékhéja van (más szóval, ha nem felel meg az oktettszabálynak), akkor pozitív formális töltése lesz.
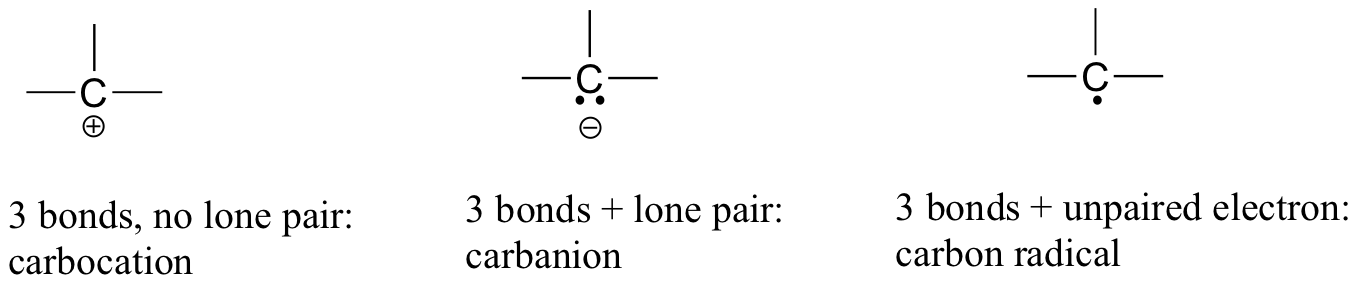
ha viszont három kötése van plusz egy magányos elektronpár, akkor formális töltése -1 lesz. Egy másik lehetőség egy három kötésű szén és egy párosítatlan (szabad gyök) elektron: ebben az esetben a szén formális töltése nulla. (Az utolsó lehetőség egy nagyon reaktív faj, az úgynevezett ‘karbén’, amelyben a szénnek két kötése és egy magányos elektronpárja van, így formális töltése nulla. Előfordulhat, hogy a karbénekkel fejlettebb kémiai tanfolyamokon találkozhat, de ezeket a könyvben nem tárgyaljuk tovább).
minden bizonnyal használnia kell a megtanult módszereket annak ellenőrzésére, hogy ezek a hivatalos díjak helyesek-e a fenti példákhoz. Ennél is fontosabb, hogy mielőtt sokkal tovább haladna a szerves kémia tanulmányozásában, egyszerűen fel kell ismernie ezeket a mintákat (és az alábbiakban leírt mintákat más atomokra), és képesnek kell lennie azonosítani azokat a szénatomokat, amelyek pozitív és negatív formális töltéseket hordoznak egy gyors ellenőrzéssel.
a hidrogének mintázata egyszerű: a hidrogénatomoknak csak egy kötésük van, formális töltésük nincs. E szabály alól kivételt képez a proton, a H+ és a hidridion, a H -, amely proton plusz két elektron. Mivel ebben a könyvben az élőlényekre alkalmazott szerves kémiára koncentrálunk, nem fogunk ‘meztelen’ protonokat és hidrideket látni, mert túl reakcióképesek ahhoz, hogy vizes oldatban jelen legyenek ebben a formában. Mindazonáltal a proton gondolata nagyon fontos lesz, amikor a sav-bázis kémiáról beszélünk, és a hidridion gondolata nagyon fontos lesz sokkal később a könyvben, amikor a szerves oxidációs és redukciós reakciókról beszélünk. Általános szabály, hogy a szerves molekulák összes hidrogénatomjának egyetlen kötése van, és nincs formális töltése.
forduljunk legközelebb az oxigénatomokhoz. Általában háromféle módon látja az oxigénkötést, amelyek mindegyike teljesíti az oktettszabályt.
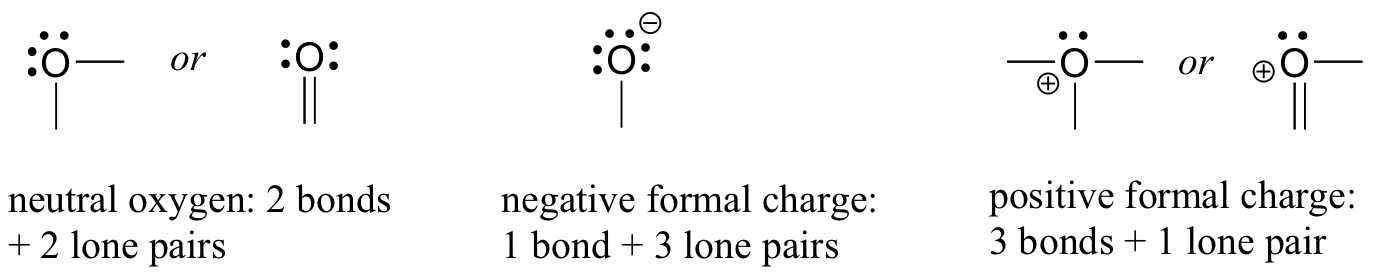
ha két kötése és két magányos párja van, mint a vízben, akkor formális töltése nulla lesz. Ha egy kötése és három magányos párja van, mint a hidroxid-ionban, akkor formális töltése-1. Ha három kötése és egy magányos párja van, mint a hidróniumionban, akkor formális töltése +1.
amikor eljutunk a 17. fejezetben a szabad gyökök kémiájáról szóló tárgyalásunkhoz, más lehetőségeket fogunk látni, például ahol egy oxigénatomnak van egy kötése, egy magányos párja és egy párosítatlan (szabad gyök) elektron, így formális töltése nulla. Most azonban koncentráljunk a három fő, nem radikális példára, mivel ezek gyakorlatilag mindent figyelembe vesznek, amit a 17.fejezetig látunk.
a nitrogénnek két fő kötési mintázata van, mindkettő megfelel az oktett szabálynak:
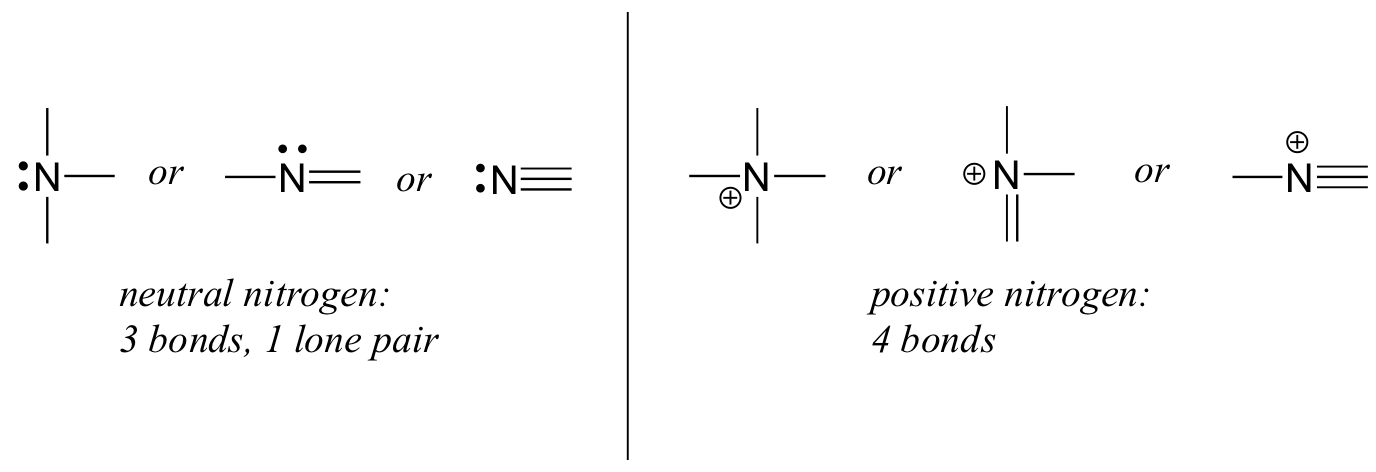
ha egy nitrogénnek három kötése és egy magányos párja van, akkor formális töltése nulla. Ha négy kötése van (és nincs egyetlen párja), akkor formális töltése +1. Egy meglehetősen ritka kötési mintázatban a negatív töltésű nitrogénnek két kötése és két magányos párja van.
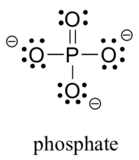
a biológiai szerves molekulákban általában két harmadik sorelem található: a kén és a foszfor. Bár mindkét elemnek más kötési mintái vannak, amelyek relevánsak a laboratóriumi kémiában, biológiai összefüggésben a kén szinte mindig ugyanazt a kötési/formális töltésmintát követi, mint az oxigén, míg a foszfor foszfátion (PO43 -) formájában van jelen, ahol öt kötése van (szinte mindig oxigénnel), nincs magányos pár, és a formális töltés nulla. Ne feledje, hogy a periódusos rendszer harmadik sorában lévő elemek vegyértékhéjában vannak d pályák, valamint s és p pályák, ezért nem köti őket az oktett szabály.
végül a halogének (fluor, klór, bróm és jód) nagyon fontosak a laboratóriumi és gyógyászati szerves kémiában, de kevésbé gyakoriak a természetben előforduló szerves molekulákban. A szerves vegyületek halogénjei általában egy kötéssel, három magányos párral és nulla formális töltéssel láthatók. Néha, különösen a bróm esetében, olyan reaktív fajokkal találkozunk, amelyekben a halogénnek két kötése van (általában háromtagú gyűrűben), két magányos pár, és formális töltése +1.

ezek a szabályok, ha megtanulják és internalizálják, hogy ne is kelljen rájuk gondolni, lehetővé teszik, hogy nagy szerves struktúrákat rajzoljon, formális díjakkal kiegészítve, elég gyorsan.
miután megértette a Lewis-struktúrák rajzolását, nem mindig szükséges magányos párokat rajzolni a heteroatomokra, mivel feltételezhetjük, hogy az egyes atomok körül megfelelő számú elektron van jelen, hogy megfeleljen a jelzett formális töltésnek (vagy annak hiányának). Néha, bár, magányos párokat rajzolnak, ha ez segít a magyarázat egyértelműbbé tételében.