Reakciósebességek
a sebességek változása a halogén megváltoztatásakor
Reakciósebességek növekedése a HF – HCl – HBr – HI sorrendben. A hidrogén-fluorid sokkal lassabban reagál, mint a másik három, és általában figyelmen kívül hagyják ezeket a reakciókat.
amikor a hidrogén-halogenidek alkénekkel reagálnak, a hidrogén-halogén kötést meg kell szakítani. A kötés erőssége a HF-ről a HI-re haladva csökken, és a hidrogén-fluor kötés különösen erős. Mivel a hidrogén és a fluor közötti kötést nehéz megszakítani, a HF hozzáadása lassú.
a sebességek változása az alkén megváltoztatásakor
ez vonatkozik a nem szimmetrikus alkénekre és a szimmetrikusakra is. Az egyszerűség kedvéért az alábbi példák mind szimmetrikusak – de nem kell.
a reakciósebesség az alkén bonyolultabbá válásával növekszik – a kettős kötés mindkét végén a szénatomokhoz kapcsolódó alkilcsoportok (például metilcsoportok) számának értelmében. Például:
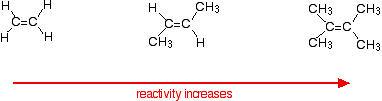
kétféle módon lehet megvizsgálni ennek okait – mindkettőnek tudnia kell a reakciók mechanizmusáról.
az alkének azért reagálnak, mert a pi kötésben lévő elektronok bármilyen pozitív töltésű dolgokat vonzanak. Bármi, ami növeli az elektron sűrűségét a kettős kötés körül, segít ebben.
az alkilcsoportok hajlamosak “eltolni” az elektronokat maguktól a kettős kötés felé. Minél több alkilcsoport van, annál negatívabbá válik a kettős kötések körüli terület.
minél negatívabb töltésű lesz ez a régió, annál inkább vonzza a molekulákat, például a hidrogén-kloridot.
a fontosabb ok azonban a reakció során képződött közbenső ion stabilitásában rejlik. A fenti három példa ezeket a karbokációkat (karboniumionokat) a reakció félidejében állítja elő:
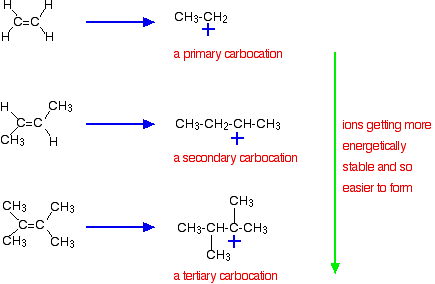
a közbenső ionok stabilitása szabályozza a reakció aktiválási energiáját. A bonyolultabb alkének felé haladva a reakció aktiválási energiája csökken. Ez azt jelenti, hogy a reakciók gyorsabbá válnak.