tanulási célok
e szakasz végére képes lesz:
- Lewis-szimbólumok írása semleges atomokra és ionokra
- Rajzolj Lewis-struktúrákat, amelyek egyszerű molekulákban ábrázolják a kötést
megvizsgáltuk az atomok és/vagy ionok közötti kötések különböző típusait. Ezek a kötések minden esetben magukban foglalják a vegyértékhéj elektronok megosztását vagy átadását az atomok között. Ebben a részben megvizsgáljuk a valence shell elektronok és kémiai kötések ábrázolásának tipikus módszerét, nevezetesen a Lewis szimbólumokat és a Lewis struktúrákat.
Lewis szimbólumok
Lewis szimbólumokat használunk az atomok és a monatomi ionok vegyértékelektron-konfigurációinak leírására. A Lewis szimbólum egy elemi szimbólumból áll, amelyet egy pont vesz körül minden vegyértékelektronjához:
az 1.ábra a periódusos rendszer harmadik periódusának elemeire vonatkozó Lewis-szimbólumokat mutatja.

1.ábra. Lewis szimbólumok, amelyek szemléltetik a vegyérték elektronok számát az egyes elemekhez a periódusos rendszer harmadik periódusában.
Lewis szimbólumok is használhatók az atomokból származó kationok képződésének szemléltetésére, amint itt látható a nátrium és a kalcium:

betűt tartalmaz. hasonlóképpen felhasználhatók az atomokból származó anionok képződésének bemutatására, az alábbiak szerint a klór és a kén esetében:

betű pedig a 2.ábra bemutatja Lewis-szimbólumok használatát az elektronok átvitelének bemutatására az ionos vegyületek képződése során.

2.ábra. A kationok akkor keletkeznek, amikor az atomok elveszítik az elektronokat, amelyeket kevesebb Lewis-pont képvisel, míg az anionokat az atomok elektronokat szereznek. Az elektronok száma nem változik.
Lewis-struktúrák
Lewis-szimbólumokat is használunk a kovalens kötések kialakulásának jelzésére, amelyeket Lewis-struktúrák, rajzok mutatnak, amelyek leírják a molekulák és a poliatomikus ionok kötését. Például, amikor két klóratom klórmolekulát képez, egy elektronpáron osztoznak:

a Lewis szerkezet azt jelzi, hogy minden Cl atomnak három elektronpárja van, amelyeket nem használnak a kötéshez (úgynevezett magányos Párok) és egy megosztott elektronpár (az atomok között írva). Kötőjelet (vagy vonalat) néha használnak egy megosztott elektronpár jelzésére:

egyetlen megosztott elektronpárt egyetlen kötésnek nevezünk. Minden Cl atom nyolc vegyértékelektronnal lép kölcsönhatásba: a hat a magányos párokban, a kettő pedig az egyetlen kötésben.
az oktett szabály
a többi halogénmolekula (F2, Br2, I2 és At2) a klórmolekulához hasonló kötéseket képez: egyetlen kötés az atomok és atomonként három magányos elektronpár között. Ez lehetővé teszi, hogy minden halogénatom nemesgáz-elektron konfigurációval rendelkezzen. A főcsoport atomjainak hajlama arra, hogy elegendő kötést képezzenek nyolc vegyértékelektron előállításához, oktettszabályként ismert.
az atom által képezhető kötések száma gyakran megjósolható az oktett eléréséhez szükséges elektronok számából (nyolc vegyérték elektron); ez különösen igaz a periódusos rendszer második periódusának nemfémjeire (C, N, O és F). Például egy 14. csoport elem minden atomjának négy elektronja van a legkülső héjában, ezért további négy elektronra van szükség az oktett eléréséhez. Ez a négy elektron négy kovalens kötés kialakításával nyerhető, amint azt itt szemléltetjük szén a CCl4-ben (szén-tetraklorid) és szilícium a sih-Ben4 (szilán). Mivel a hidrogénnek csak két elektronra van szüksége a vegyértékhéj kitöltéséhez, ez kivétel az oktettszabály alól. Az átmeneti elemek és a belső átmeneti elemek szintén nem követik az oktett szabályt:

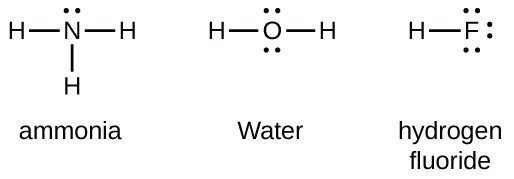
a 15.csoportba tartozó elemeknek, például a nitrogénnek, öt vegyértékelektronja van az atom Lewis szimbólumában: egy magányos pár és három párosítatlan elektron. Oktett előállításához ezek az atomok három kovalens kötést képeznek, mint az NH3-ban (ammónia). Az oxigén és a 16. csoportba tartozó más atomok két kovalens kötés kialakításával oktettet kapnak:
kettős és hármas kötések
mint korábban említettük, amikor egy atompár egy elektronpáron osztozik, ezt egyetlen kötésnek nevezzük. Előfordulhat azonban, hogy egy atompárnak egynél több elektronpárt kell megosztania a szükséges oktett elérése érdekében. Kettős kötés alakul ki, amikor két elektronpár megoszlik egy atompár között, mint a ch2o (formaldehid) szén-és oxigénatomjai, valamint a C2H4 (etilén) két szénatomja között:
hármas kötés alakul ki, amikor három elektronpárt osztanak meg egy atompár, mint A nitrogéngáz (N2):
Lewis-struktúrák írása a
oktett szabály szerint nagyon egyszerű molekulák és molekuláris ionok esetében a Lewis-struktúrákat úgy írhatjuk le, hogy pusztán párosítjuk a párosítatlan elektronokat az alkotó atomokon. Lásd ezeket a példákat:

bonyolultabb molekulák és molekuláris ionok esetén hasznos az itt ismertetett lépésenkénti eljárás követése:
- határozza meg a vegyérték (külső héj) elektronok teljes számát.
- rajzolja meg a molekula vázszerkezetét, az atomokat egy központi atom köré rendezve. (Általában a legkevésbé elektronegatív elemet kell a középpontba helyezni.) Csatlakoztassa az egyes atomokat a központi atomhoz egyetlen kötéssel (egy elektronpárral).
- ossza el a fennmaradó elektronokat magányos párként a terminális atomokon (kivéve a hidrogént), kitöltve egy oktettet minden atom körül.
- helyezze az összes fennmaradó elektront a központi atomra.
- rendezze át a külső atomok elektronjait, hogy többszörös kötést hozzon létre a központi atommal annak érdekében, hogy oktetteket kapjon, ahol csak lehetséges.
határozzuk meg a Pbr3 Lewis szerkezetét a fenti lépésekkel:
- 1. lépés: Határozza meg a vegyérték (külső héj) elektronok teljes számát.
\nagy \ begin{array}{l}\ \ \ phantom {\rule{0.8 em}{0ex}} {\text{PBr}} _ {3}\ \ \ phantom {\rule{0.8 em}{0ex}}\text{P: 5 vegyérték elektron/atom} \times\ text{1 atom}=5\ \\aláhúzás {+\text{Br: 7 vegyérték elektron/atom} \times\ text{3 Atom}=21}\ \ \ \\phantom {\rule{15.95em}{0EX}}= \ szöveg{26 vegyérték elektronok} \ vége{tömb}
- 2. lépés: rajzolja meg a molekula vázszerkezetét, az atomokat egy központi atom köré rendezve. (Általában a legkevésbé elektronegatív elemet kell a középpontba helyezni.) Csatlakoztassa az egyes atomokat a központi atomhoz egyetlen kötéssel (egy elektronpárral).

- 3. lépés: ossza el a fennmaradó elektronokat magányos párként a terminális atomokon (kivéve a hidrogént), kitöltve egy oktettet minden atom körül.
-
 4. lépés: Helyezze az összes megmaradt elektront a központi atomra.
4. lépés: Helyezze az összes megmaradt elektront a központi atomra.

Megjegyzés: 5.lépés: nem szükséges, mivel minden atomnak oktettje van.
határozzuk meg a Ch2o Lewis szerkezetét.
- 1. lépés: Határozza meg a vegyérték (külső héj) elektronok teljes számát.
\nagy \kezdődik{array}{l}\\ \fantom{\szabály{0,8 em}{0ex}}{\szöveg{H}_{2}}\szöveg{CO}\\ \fantom{\szabály{0,8 em}{0ex}}\szöveg{H: 1 vegyérték elektron/atom}\times \szöveg{2 atom}=2\\\szöveg{C: 4 vegyérték elektron/atom}\times \szöveg{1 atom}=4\\ \aláhúzás{+\szöveg{o: 6 vegyérték elektron/atom}\times \text{1 atom}=6}\\ \\ \fantom{\szabály{15,95 em}{0EX}}=\szöveg{12 vegyérték elektron}\end{array}
- 2. lépés: rajzolja meg a molekula vázszerkezetét, az atomokat egy központi atom köré rendezve. (Általában a legkevésbé elektronegatív elemet kell a középpontba helyezni.) Csatlakoztassa az egyes atomokat a központi atomhoz egyetlen kötéssel (egy elektronpárral).

- 3. lépés: ossza el a fennmaradó elektronokat magányos párként a terminális atomokon (kivéve a hidrogént), kitöltve egy oktettet minden atom körül.

- 4. lépés: nem szükséges, mivel az összes elektront elhelyezték. A szénnek azonban nincs oktettje,
- 5. lépés: Rendezze át a külső atomok elektronjait, hogy több kötést hozzon létre a központi atommal annak érdekében, hogy oktetteket kapjon, ahol csak lehetséges.

1. példa: Lewis struktúrák írása
a NASA Cassini-Huygens missziója nagy mennyiségű mérgező hidrogén-cianidot (HCN) észlelt a Titánon, a Szaturnusz egyik holdján. Melyek ezeknek a molekuláknak a Lewis-szerkezete?
ellenőrizze a tanulást
a szén-dioxid, a CO2, a fosszilis tüzelőanyagok elégetésének terméke. A CO2 szerepet játszik a globális éghajlatváltozásban. Mi a CO2 Lewis szerkezete?
a Vegyértékelektronikai struktúrák megjeleníthetők Lewis-szimbólumok (atomok és monatomikus ionok) és Lewis-struktúrák (molekulák és poliatomikus ionok) rajzolásával. Magányos párokat, párosítatlan elektronokat, valamint egy -, kettős vagy hármas kötéseket használnak annak jelzésére, hogy a vegyérték elektronok hol helyezkednek el az egyes atomok körül Egy Lewis-struktúrában. A legtöbb szerkezet—különösen azok, amelyek második sorelemeket tartalmaznak-engedelmeskedik az oktettszabálynak, amelyben minden atomot (kivéve H) nyolc elektron vesz körül. Az oktett szabály alóli kivételek a páratlan elektronmolekulák (szabad gyökök), az elektronhiányos molekulák és a hipervalens molekulák esetében fordulnak elő.
gyakorlatok
- írja be a Lewis szimbólumokat az alábbi ionok mindegyikére:
- As3 –
- I –
- Be2+
- O2 –
- Ga3+
- Li +
- N3–
- számos monatomikus Ion található a tengervízben, beleértve az alábbi elemlistából képződött ionokat is. Írja be a Lewis szimbólumokat a következő elemekből képződött monatomi ionokra:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- írja be az alábbi ionos vegyületek ionjainak Lewis-szimbólumait és annak az atomnak a Lewis-szimbólumait, amelyből ezek képződnek:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- az alábbiakban felsorolt Lewis-struktúrákban az M és az X a periódusos rendszer harmadik periódusának különböző elemeit képviseli. Írja be az egyes vegyületek képletét az egyes elemek kémiai szimbólumaival:
- írja be a Lewis szerkezetét a P kétatomos molekulához2, a magas hőmérsékletű foszforgőzben található foszfor instabil formája.
- írja Lewis struktúrák a következő:
- H2
- HBr
- PCl3
- írja Lewis struktúrák a következő:
- O2
- H2CO
- AsF3
- SiCl4
glosszárium
kettős kötés: kovalens kötés, amelyben két elektronpár megoszlik két atom között
szabad gyök: páratlan számú elektronot tartalmazó molekula
hipervalens molekula: legalább egy főcsoportelemet tartalmazó molekula, amelynek vegyértékhéjában nyolcnál több elektron van
Lewis szerkezet: diagram, amely magányos párokat és elektronpárokat mutat egy molekulában vagy egy ionban
Lewis szimbólum: egy elem vagy egyatomos ion szimbóluma, amely pontot használ az elem vagy ion egyes vegyértékelektronjainak ábrázolására
magányos pár: két (egy pár) vegyértékelektron, amelyeket nem használnak kovalens kötés kialakítására
oktett szabály: iránymutatás, amely kimondja, hogy a főcsoport atomjai olyan struktúrákat alkotnak, amelyekben nyolc vegyértékelektron kölcsönhatásba lép az egyes magokkal, a kötő elektronokat úgy számolva, hogy kölcsönhatásba lépnek a kötés által összekapcsolt mindkét atommal
egyetlen kötés: olyan kötés, amelyben egy egyetlen elektronpár megoszlik két atom között
hármas kötés: kötés, amelyben három elektronpár oszlik meg két atom között


 HCN: nem maradnak elektronok
HCN: nem maradnak elektronok




















