Bevezetés
a feszültségfüggő káliumcsatornák egy nagy és változatos családot alkotnak, amely evolúciós szempontból konzervált. Vannak 40 emberi feszültségfüggő káliumcsatorna gének, amelyek 12 alcsaládba tartoznak. Ezek a KV csatornák széles eloszlást mutatnak az idegrendszerben és más szövetekben. Az ingerelhető sejtek, például a neuronok, a szívizomsejtek és az izmok esetében a KV csatornák szabályozzák az akciós potenciálok hullámformáját és tüzelési mintáját. A KV csatornák szabályozhatják a sejttípusok széles skálájának sejttérfogatát, proliferációját és migrációját is.
a feszültségfüggő kálium (Kv) csatornák az egyik legnagyobb és evolúciósan konzervált ioncsatornacsaládhoz tartoznak . Minden KV csatorna négy hasonló vagy azonos pórusformáló alegységet tartalmaz, és tartalmazhat olyan kiegészítő alegységeket is, amelyek befolyásolhatják a csatorna működését és / vagy lokalizációját . A KV csatornák minden pórusképző alegysége hat transzmembrán szegmenst (S1-S6) tartalmaz, az első négy transzmembrán szegmens (S1-S4) alkotja a feszültségérzékelőt, az utolsó két transzmembrán szegmens pedig pórushurkot (S5-P-S6) szegélyez pórustartományként. Az egyes KV-csatornagének humán, egér és patkány kromoszóma-elhelyezkedésén kívül a csatorna fiziológiai és farmakológiai tulajdonságait, valamint szöveti eloszlását és patofiziológiáját a nemzetközi farmakológiai Unió nómenklatúra Bizottsága (NC-IUPHAR) feszültségfüggő káliumcsatornákkal foglalkozó Albizottságának ioncsatorna-adatbázisa szolgáltatta. Ez a cikk bemutatja a feszültségfüggő káliumcsatornák sokféleségét és funkcióit.
a káliumcsatornák evolúciós megőrzése
a prokariótákban keletkezett K+-szelektivitás nagyszámú, figyelemre méltó sokféleségű káliumcsatornában konzerválódik . Amint az 1. ábrán látható, a feszültségfüggő kationcsatorna szupercsalád evolúciós fája javasolható az emberi genomban lévő csatornagének összehasonlítása alapján más metazoák genomjában található génekkel, beleértve az egeret is, csirke, pufferhal, tunikát, gyümölcslégy, szúnyog, fonálféreg és tengeri kökörcsin . Ez az evolúciós fa a K+-szelektivitás egyetlen eredetét képzeli el a befelé egyenirányító kálium (kir) csatornákra, a feszültségfüggő kálium (KV) csatornákra és a két pórusú kálium (K2P) csatornákra. Fontos azonban megjegyezni, hogy a különálló K + – szelektivitás valószínűleg összefügg az evolúciósan konzervált organelle k + csatornával, amely az endoszómákban és a lizoszómákban található .
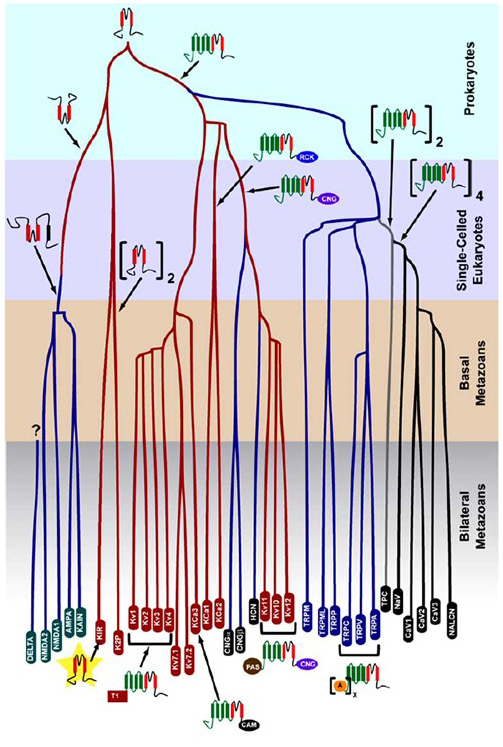
1. ábra. Evolúciós fa a feszültségfüggő kationcsatorna szupercsalád kialakulásához. A cnidariánoktól és a bilaterális metazoánoktól származó ioncsatornák genomszintű elemzése alapján ez az evolúciós fa a káliumcsatornák k+-szelektivitásának közös eredetét ábrázolja (a családnevek vörös oválisak), amelyek kapcsolatban állnak a tetramer ciklikus nukleotid-kapuzott kation (CNG) csatornákkal, a hiperpolarizációval-kapuzott kation (HCN) csatornákkal és a TRP csatornákkal, a dimer TPC csatornákkal, valamint a monomer Na+, Ca2+ és NALCN csatornákkal. Az ág hossza nem tükrözi az időt. Az alsó géncsaládnevek az egyes ágakat jelölik. Az ionotróp glutamát receptorok azon a hipotézisen alapulnak, hogy a káliumcsatorna pórusképző domén inverziójából származnak két transzmembrán szegmenssel (piros). A feszültségérzékelő tartománynak négy transzmembrán szegmense van (zöld). A: ankryin ismétlődik; CAM: kalmodulin-kötő domén; CNG: ciklikus nukleotidkötő domén; PAS: Per-ARNT-Sim domén; RCK: a K+ domén vezetőképességének szabályozója; T1: tetramerizációs domén.
feszültségfüggő káliumcsatornák sokfélesége
az emberi genom ~80 káliumcsatorna gént tartalmaz, amelyek közül 40 gén kódolja a feszültségfüggő káliumcsatorna pórusképző alegységeket, amelyek 12 alcsaládba tartoznak (ábra. 2). Fiziológiailag a-típusú káliumcsatornákra osztva, amelyek gyors inaktivációt mutatnak, és késleltetett egyenirányító káliumcsatornákat gyors inaktiválás nélkül, ezek a KV csatornák molekulárisan és funkcionálisan változatosak. A gyors inaktiválás, amely befolyásolhatja az akciópotenciál időtartamát az ismétlődő tüzelés során, nyilvánvaló a KV1-et tartalmazó KV1 csatornákban.4 vagy KVV (1), KV3 (3) és KV4 (4) csatornák . A késleltetett egyenirányító káliumáram, amelyet eredetileg Hodgkin és Huxley jellemzett az akciópotenciálban betöltött szerepe miatt, valószínűleg megfelel a squid KV1 csatornáknak, amelyek az RNS szerkesztésére támaszkodhatnak a rugalmas funkcionális sokféleség elérése érdekében, mivel az Óriás rost lebeny neuronjainak sok kis axonja összeolvad, hogy a squid óriás axont képezzék nagyobb akciós potenciál vezetési sebességgel .
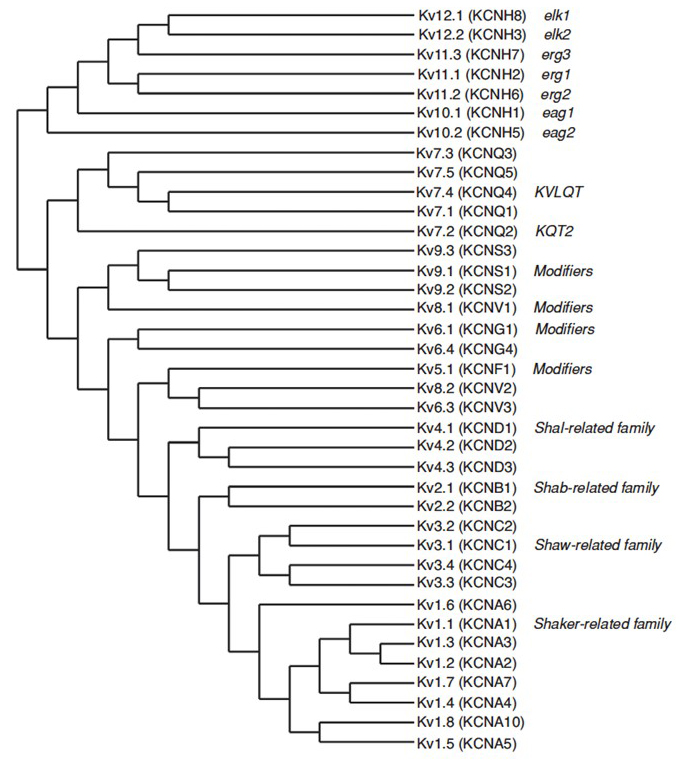
2. ábra. Filogenetikai fa a KV1-12 családok számára. Ezt a filogenetikai fát a hat transzmembrán szegmenst (S1-S6) tartalmazó hidrofób domén elemzése alapján állítják elő . Mind az IUPHAR, mind a HGNC (zárójelben) nevek láthatók, valamint ezeknek a feszültségfüggő káliumcsatornáknak a más általánosan használt nevei.
a KV csatornák figyelemre méltó sokfélesége érhető el a KV csatorna alegységek keverése és egyezése miatt. A KV1, a KV2, a KV3, a KV4 és a KV7 családokban homomer és heteromer csatornák alakulhatnak ki számos funkcionális tulajdonsággal . KV2 családtagok is össze KV5, KV6,KV8 vagy KV9 családtagok korlátozottabb expressziós minták az idegrendszerben és a simaizmok, amint azt vázlatosan ábra. 3.

3. ábra. KV csatorna sokszínűség a pórusképző csatorna alegységek keverésével. (A) a különböző tulajdonságokkal és eloszlással rendelkező tetramer KV csatornák magukban foglalják a HOMOMER KV1, KV2, KV3, KV4 és KV7 csatornákat, a heteromer csatornákat, amelyeket e KV csatornacsaládok különböző tagjai alkotnak, valamint a KV2 család tagjainak KV5, KV6, KV8 vagy KV9 családtagokkal való összeszerelésével létrehozott heteromer csatornákat . A KV5, KV6 , KV8 és KV9 családok olyan homomer csatornákat hoznak létre, amelyek elektromosan csendesek, valószínűleg az endoplazmatikus retikulumban való visszatartásuk miatt, ezért KVS-nek nevezik őket. (B) A KV2 és KVS család tagjai közé tartoznak a citoplazmatikus N – és C-terminális domének. (C, D) A KV2 és KVS családtagok összeszerelése különböző feszültségfüggőségű (C) és kapuzási mechanizmusú (D) heteromer csatornákat eredményez a KV2 családtagok által alkotott homomer csatornákhoz képest .
a KV csatornák feszültségfüggőségének és kinetikájának funkcionális különbségei az akciós potenciál modulációhoz való differenciális hozzájárulásuk alapját képezik (ábra. 4). Míg a KV1, KV4 és KV7 csatornák aktiválásához alacsony szintű membrán depolarizációra van szükség, addig a KV2 és KV3 csatornák nagyobb depolarizációval aktiválódnak. Az előbbi, alacsony feszültséggel aktivált, KV csatornák befolyásolhatják az akciós potenciál létrehozásának küszöbét, valamint a depolarizáció vagy az excitációs szinaptikus potenciálok során keletkező akciós potenciálok számát. Ezzel szemben a nagyfeszültségű aktivált KV csatornák modulálhatják az akciós potenciál időtartamát és a tüzelési mintázatot . A KV csatornák kinetikája befolyásolja azt is, hogy miként járulnak hozzá az akciós potenciál generálásához. Míg a kisfeszültségű aktivált KV1 csatornák gyors aktiválással befolyásolhatják az akciós potenciál küszöbértékét és hullámformáját, a nagyfeszültségű aktivált KV3 csatornák és KV2 csatornák aktiválási kinetikájuk különbsége miatt egymás után aktiválhatók az akciós potenciál alatt, és a KV2 csatornák lassú inaktivációs kinetikájuk miatt hosszabb ideig tartó hatásúak lehetnek. Ezenkívül a gyors inaktiválással rendelkező KV4 csatornák hozzájárulhatnak az akciós potenciál hullámformájának különbségéhez az ismétlődő tüzelés során, a KV4 csatorna aktivitásának depolarizációval történő elnyomása miatt .
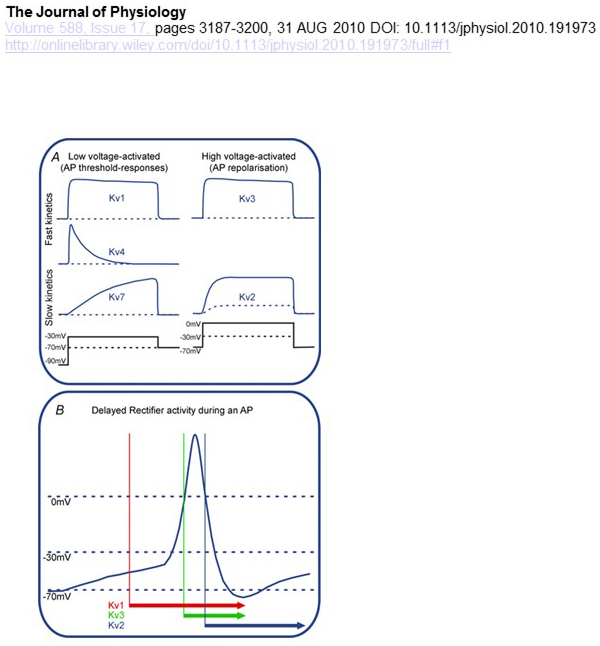
4. ábra. A KV csatornák funkcionális különbségei és az akciós potenciálhoz való hozzájárulásuk. (A) A különböző KV csatornák eltérő feszültségfüggőséggel rendelkeznek az aktiválás és a különböző kinetika szempontjából . (B) az alacsony feszültségű aktivált KV1 csatornák gyors kinetikával nyitva vannak, amikor a sejt depolarizálódik az akciós potenciál létrehozásának küszöbértéke felé. Míg mind a KV2, mind a KV3 csatornák nagyfeszültséggel vannak aktiválva, a KV3 csatornák hamarabb megnyílnak, mint a KV2 csatornák egy akciós potenciál során. A KV2 csatornák bezárása hosszabb ideig is eltarthat egy akciós potenciál után .
a káliumcsatorna-modulátorok potenciális terápiás alkalmazása
a káliumcsatorna-modulátorok azon képessége, hogy megváltoztassák az akciós potenciál tüzelési mintáit, felvetette a kérdést, hogy lehetnek-e terápiás értékűek . Amint az ábrán látható. 5, a különböző neurológiai és pszichológiai rendellenességek az akciós potenciál tüzelési mintáinak megváltozásával járhatnak, amelyeket a KV csatorna aktivátorai és blokkolói modulálhatnak . A feszültségfüggő káliumcsatornák szintén szerepet játszhatnak a sejtproliferációban és a migrációban; A KV csatorna modulátorokat ezért fontolóra vették a rák növekedésének és metasztázisának lehetséges kezelésére . Ábra. A 6.ábrán látható, hogy a KV1.2 csatornaszerkezetet vázlatosan használjuk annak szemléltetésére, hogy a KV csatornamodulátorok gátolhatják a csatorna aktivitását vagy a csatorna áteresztési útvonalának elzárásával, mint a külső pórusokat blokkoló toxinok és a belső pórusokat blokkolók esetében, vagy a feszültségérzékelővel való kölcsönhatásuk révén, hogy stabilizálják a csatorna zárt állapotát, mint a kapu módosító toxinok esetében. Alternatív megoldásként egyes kis molekulák úgy hatnak, hogy a kapuzógéphez kötődnek, mint a kapuzás módosítói, vagy kölcsönhatásba lépnek a csatornák aktivitásának megváltoztatásához a kontinensek és a kontinensek közötti interfésszel .
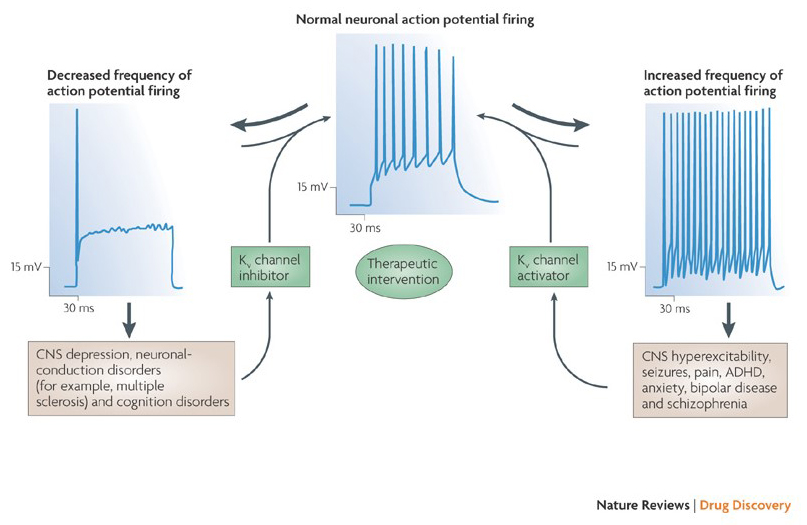
5. ábra. A KV csatorna modulátorok lehetséges alkalmazásai. Mivel a kóros akciós potenciál kilövési mintázatok összefüggésbe hozhatók olyan betegségekkel, mint az epilepszia és a sclerosis multiplex, a KV-csatorna aktivátorait és inhibitorait fontolóra vették olyan betegségek lehetséges terápiás kezelésére, amelyek az idegsejtek ingerlékenységének megváltozásával járnak .
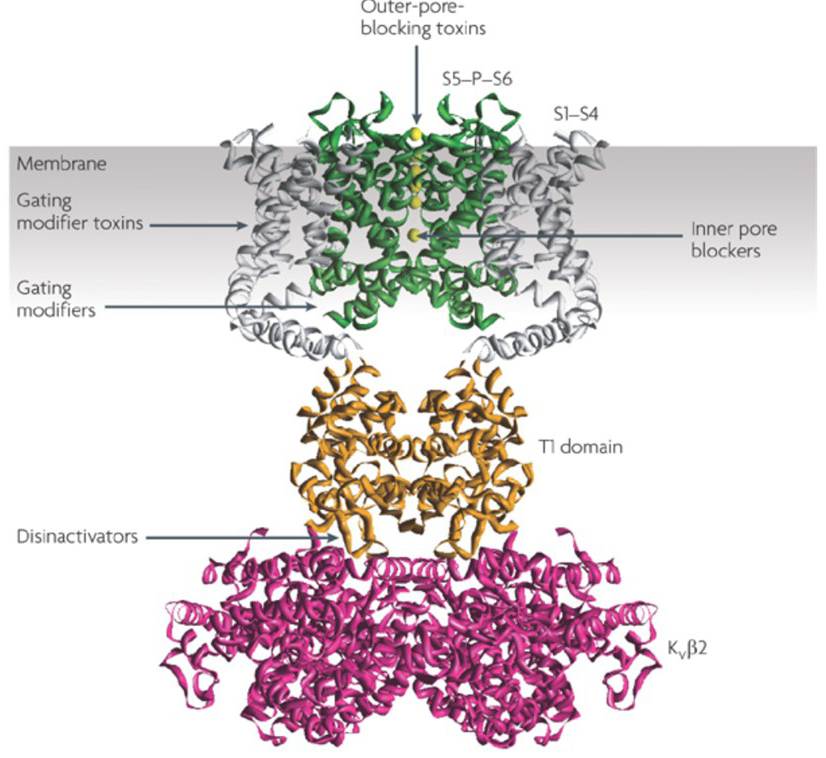
6. ábra. Példák a KV csatorna modulátorok működési módjaira. A peptid toxinoknak és a kis molekuláknak számos különböző módja van a KV csatorna aktivitásának modulálására. A KV1 .2 szerkezet a pórus doménekkel (S5-P-S6) zöld színnel, a feszültségérzékelő doménekkel (S1-S4) szürkével, a T1 tetramerizációs doménekkel narancssárgával, a KV2 kiegészítő alegységekkel pedig bíborvörös színnel látható. A skorpiók, tengeri kökörcsin, kígyók és kúpcsigák külső pórusokat blokkoló toxinjai kötődhetnek a külső előcsarnokhoz és blokkolhatják az ionáteresztést. A pókok, például a hanatoxin módosító toxinjai kölcsönhatásba léphetnek a feszültségérzékelővel, hogy növeljék a zárt állapot stabilitását, ami a csatorna aktiválásához a feszültségfüggési görbe jobb oldali eltolódását okozza. Vannak kis molekulájú csatornamodulátorok is, amelyek kötődnek a belső pórusokhoz (belső pórusblokkolók), a kapuzási csuklópántokhoz (kapuzat – módosítók), vagy az interfész a kettő között (diszinaktivátorok) .
feszültségfüggő káliumcsatorna-szerkezet
a káliumcsatornák figyelemre méltó szelektivitása, amely lehetővé teszi a K+ ionok számára , hogy a kisebb Na+ ionoknál nagyságrendekkel könnyebben és közel diffúziós korlátozott sebességgel haladjanak át a csatorna pórusán , annak köszönhető, hogy a szelektivitási szűrő gerinc karboniljai képesek koordinálni azokat a K+ ionokat, amelyek nagyrészt megfosztottak hidratációs héjuktól, így egynél több K+ ion mozog a pórusok ezen legszűkebb szegmensén tandemben (ábra. 7) – egy hosszú pórus egyetlen fájl K+ ion permeáció előre jelzett .
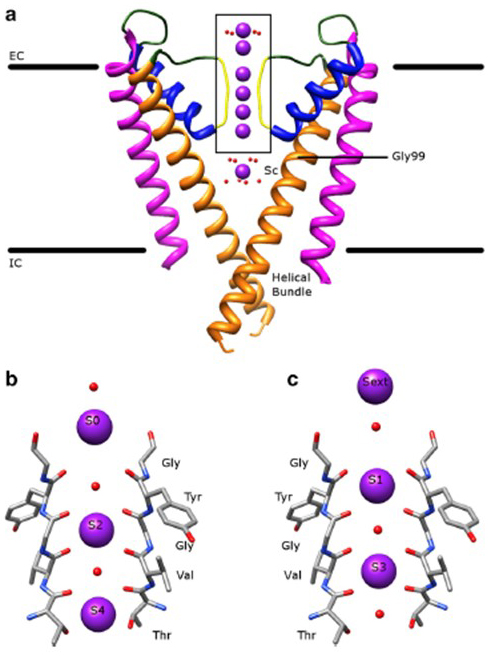
7. ábra. A káliumcsatornák pórustartománya. (a) A KCSA szerkezete vezetőképes állapotban (PDB: 1K4C) , a külső hélixek bíborvörös, a belső hélixek narancssárga, a pórus hélixek kék, a szelektivitási szűrő pedig sárga. A K + ionok lila színűek, míg a környező vízmolekulák pirosak. EC: extracelluláris; IC: intracelluláris. (b, c) a KCSA szerkezet dobozos tartományában a szelektivitási szűrőt úgy mutatjuk be, hogy a K+ ionok vagy az S2 és S4 (b), vagy az S1 és S3 (c) pozíciókat foglalják el, hogy a K+ ion permeációját egyetlen fájlban szemléltetjük .
a KV csatorna aktiválásának feszültségfüggése a feszültségérzékelő tartományukból származik . Amint az ábrán látható. A 8.ábrán látható, hogy a KV csatornák és a kapcsolódó csatornák, mint például a feszültségfüggő nátriumcsatornák és a TRPV1 csatornák ugyanabban a szupercsaládban hasonló elrendezéssel rendelkeznek a pórustartományok és a feszültségérzékelő tartományok tekintetében. Az egyik alegység feszültségérzékelő tartománya kölcsönhatásba lép egy szomszédos alegység pórustartományával tartománycsere konfigurációban, a feszültségérzékelőn belül pedig az S4 pozitív töltésű argininmaradványai kölcsönhatásba léphetnek a szomszédos spirálok negatív töltésű savas maradékaival (ábra. 9).
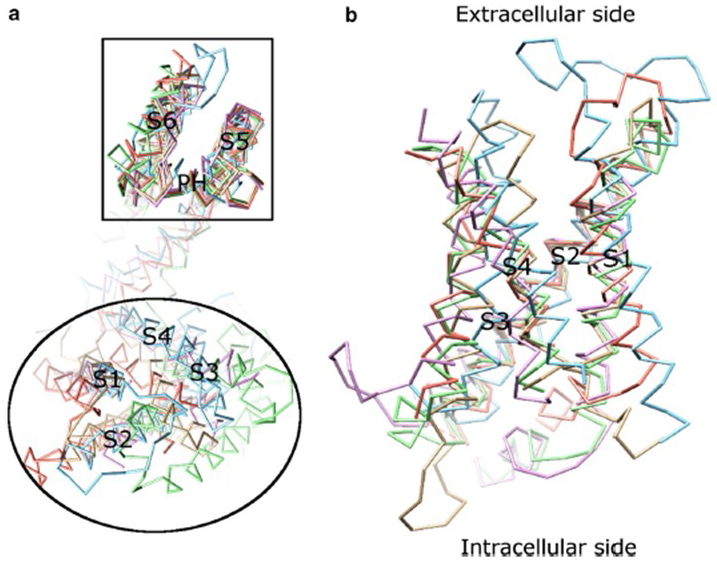
8. ábra. A feszültségfüggő káliumcsatornák feszültségérzékelő tartománya. (a) A különböző ioncsatornák pórustartományának (S5-P-S6) igazítása azt mutatja, hogy feszültségérzékelő doménjeik (S1-S4) különféle irányokat vehetnek fel (az extracelluláris oldalról nézve). (b) A KV1.2 (PDB: 3lut, világos bíbor) feszültségérzékelő tartományának egymásra helyezése az MlotiK1 (PDB: 3BEH, Világosbarna), A NaVAb (PDB: 3rvy, Világoszöld), a NaVRh (PDB: 4DXW, világos narancssárga) és a TRPV1 (PDB: 3j5p, Világoskék) (membránról nézve) feszültségérzékelő tartományaival .
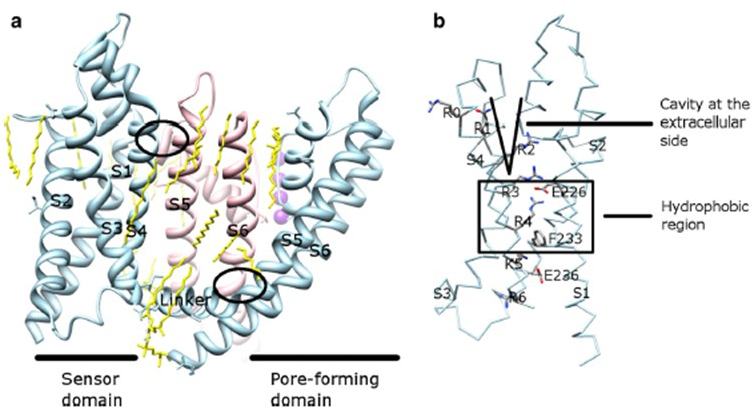
9. ábra. A KV csatornák pórustartománya és feszültségérzékelő tartománya közötti kapcsolatok. (a) A KV1.2-KV2.1 kiméra (PDB: 2r9r) egy alegység feszültségérzékelő tartományával (Világoskék) érintkezve egy szomszédos alegység pórustartományával (rózsaszín). Az intracelluláris oldalon lévő érintkezők magukban foglalják az S4-S5 linker és az S6 kölcsönhatását, az extracelluláris oldalon lévő érintkezők pedig az S1 és a pórushélix közötti kölcsönhatást . A csatornát körülvevő, valamint a pórustartomány és a feszültségérzékelő tartomány között lévő lipidek (sárga) kimutathatók a kristályszerkezetben. b) az S4 bázikus maradékai és savas maradékai azok közelségében a feszültségérzékelő tartományban .
a feszültségtől függő káliumcsatornákhoz kapcsolódó Csatornalopathiák
a feszültségtől függő káliumcsatornák széles körben expresszálódnak a különböző szövetekben. A neuronokban különböző szubcelluláris rekeszekre irányulnak (ábra. 10), valamint a különböző alegység-összetételű csatornák lehetnek jelen a neuronok különböző alpopulációiban . A KV csatorna génjeinek mutációi neurológiai betegségeket okozhatnak, mint például epizodikus ataxia és epilepsziák, szívbetegségek és süketség . A KV csatorna funkciójának evolúciós megőrzése nyilvánvaló, például a KV1 ortológusok mutációja által okozott hasonló mozgási rendellenességekből az emberben, az egérben és a gyümölcslégyben .
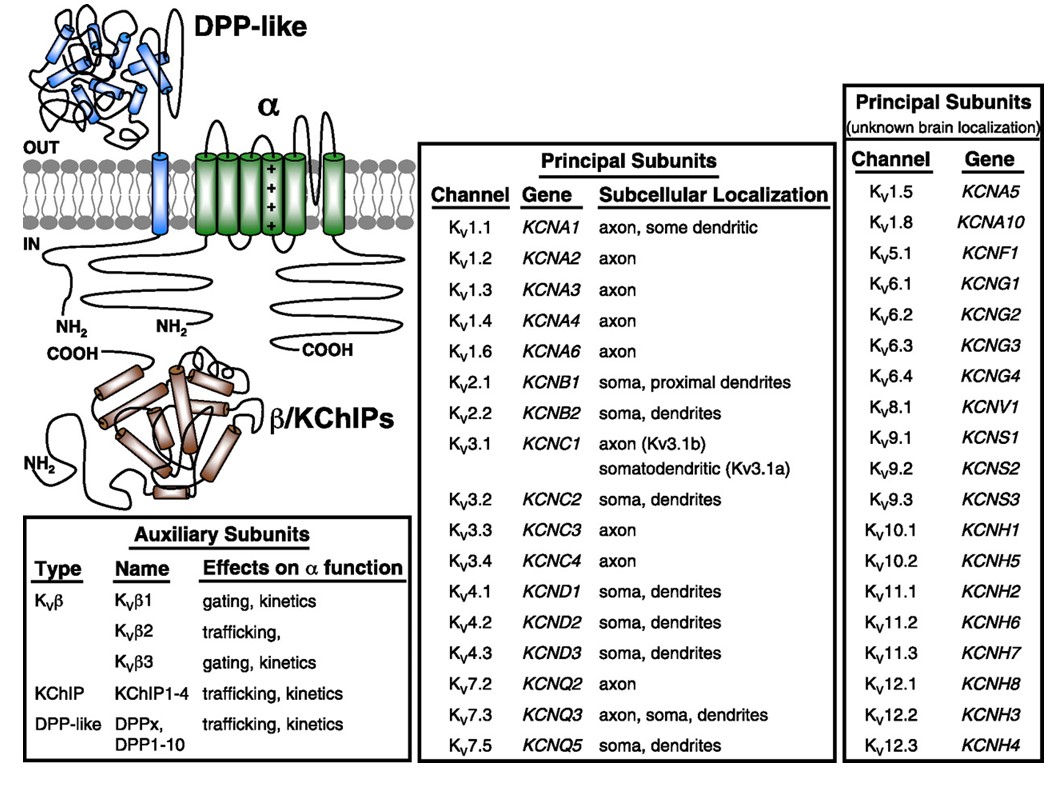
10. ábra. A feszültségfüggő káliumcsatornák szubcelluláris eloszlása. A bal felső sarokban lévő sematikus ábra egy KV4 csatornát ábrázol, két különböző kiegészítő alegységgel. Az emlősök központi neuronjaiban a különböző KV csatornák szubcelluláris lokalizációját a középső doboz jelzi .
hivatkozások és megjegyzések
1.Hille, B., gerjeszthető membránok Ionos csatornái, 3., Szerk. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K(+) csatornák: funkció-szerkezeti áttekintés. Compr Physiol, 2012. 2 (3): 2087-149. o.
3.Vacher, H., D. P. Mohapatra és J. S. Trimmer, lokalizáció és célzás feszültségfüggő ioncsatornák emlős központi neuronok. Physiol Rev, 2008. 88(4): o. 1407-47.
4.Jegla, T. J., et al., Az emberi ioncsatorna-készlet evolúciója. Comb Chem Nagy Áteresztőképességű Képernyő, 2009. 12(1): O. 2-23.
5.Cang, C., et al., A TMEM175 egy Organelle K (+) csatorna, amely szabályozza a lizoszomális funkciót. Cell, 2015. 162(5): o. 1101-12.
6.Hodgkin, A. L. és A. F. Huxley: nátrium-és káliumionok által hordozott áramok a Loligo óriás axonjának membránján keresztül. J Physiol, 1952. 116(4): o. 449-72.
7.Rosenthal, J. J., T. I. Liu és W. F. Gilly, a késleltetett egyenirányító KV1 cDNS-ek családja, amely sejttípus-specifikus expressziót mutat a squid stellate ganglion / óriás rost lebeny komplexben. J Neurosci, 1997. 17(13): 5070-9. o.
8.Young, J. Z., összeolvadt neuronok és szinaptikus kapcsolatok a lábasfejűek óriási idegrostjaiban. Phil Trans R Soc Lond B, 1939. 229: o. 465-503.
9.Rosenthal, J. J. és F. Bezanilla, a squid késleltetett egyenirányító K+ csatorna mRNS-jeinek kiterjedt szerkesztése szabályozza az alegység tetramerizációját. Neuron, 2002. 34(5): o. 743-57.
10.Jan, L. Y. és Y. N. Jan, feszültségfüggő káliumcsatornák és az elektromos jelátvitel sokfélesége. J Physiol, 2012. 590(11): 2591-9. o.
11.Johnston, J., I. D. Forsythe és C. Kopp-Scheinpflug, going native: feszültségfüggő káliumcsatornák, amelyek szabályozzák az idegsejtek ingerlékenységét. J Physiol, 2010. 588 (Pt 17): o. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8 és KV9 alegységek: nincsenek egyszerű néma szemlélők. J Gen Physiol, 2016. 147(2): p. 105-25.
13.Wulff, H., N. A. Castle, és L. A. Pardo, feszültségfüggő káliumcsatornák, mint terápiás célpontok. Nat Rev Drug Discov, 2009. 8 (12): o. 982-1001.
14.Bates, E. Ioncsatornák a fejlődésben és a rák kialakulásában. Éves Rev Cell Dev Biol, 2015. 31: o. 231-47.
15.Huang, X. és L. Y. Jan, a rák káliumcsatornáit célozzák meg. J Cell Biol, 2014. 206(2): p. 151-62.
16.Huang, X., et al., Eag2 káliumcsatorna evolúciósan konzervált funkcióval, mint agydaganat célpont. Nat Neurosci, 2015. 18(9): o. 1236-46.
17.Kunzelmann, K.: ioncsatornák és rák. J Membr Biol, 2005. 205(3): 159-73. o.
18.Li, M. és Z. G. Xiong, ioncsatornák, mint a rákterápia célpontjai. Int J Physiol Patophysiol Pharmacol, 2011. 3 (2): O. 156-66.
19.Pardo, Los Angeles., Feszültségfüggő káliumcsatornák a sejtproliferációban. Élettan (Bethesda), 2004. 19: O. 285-92.
20.Urrego, D., et al., Káliumcsatornák a sejtciklusban és a sejtproliferációban. Philos Trans R Soc Lond B Biol Sci, 2014. 369(1638): 20130094. o.
21.Zhou, Y., et al., Az ionkoordináció és a hidratáció kémiája, amelyet egy K+ csatorna-Fab komplex tárt fel 2,0 a felbontással. Természet, 2001. 414(6859): o. 43-8.
22.MacKinnon, R., káliumcsatornák. FEBS Lett, 2003. 555(1): 62-5. o.
23.Kuang, Q., P. Purhonen és H. Hebert: a káliumcsatornák szerkezete. Cell Mol Life Sci, 2015. 72 (19): O. 3677-93.
24.Isacoff, E. Y., L. Y. Jan és D. L. Minor, Jr., az élet szikrájának csatornái: perspektíva az ioncsatorna kutatásáról a neuron születése óta. Neuron, 2013. 80(3): 658-74. o.
25.Swartz, K. J., feszültség érzékelése a lipid membránokon. Természet, 2008. 456(7224): 891-7. o.
26.Nusser, Z.: az ioncsatornák differenciális szubcelluláris eloszlása és a neuronális funkciók sokfélesége. Curr Opin Neurobiol, 2012. 22(3): o. 366-71.
27.Lujan, R., káliumcsatornák szervezése az idegsejtek felületén. J Chem Neuroanat, 2010. 40(1): 1-20. o.
28.Abriel, H. és E. V. Zaklyazminskaya, szív channelopathiák: genetikai és molekuláris mechanizmusok. Gene, 2013. 517(1): 1-11. o.
29.Kullmann, D. M. és M. G. Hanna: öröklött ioncsatorna mutációk által okozott neurológiai rendellenességek. Lancet Neurol, 2002. 1 (3): p. 157-66.
30.Lehmann-Horn, F. és K. Jurkat-Rott: feszültségfüggő ioncsatornák és örökletes betegségek. Physiol Rev, 1999. 79(4): o. 1317-72.
31.Villa, C. és R. Combi, káliumcsatornák és Humán epilepsziás fenotípusok: frissített áttekintés. Front Cell Neurosci, 2016. 10: 81. o.
32.Long, S. B., E. B. Campbell és R. Mackinnon, egy emlős feszültségfüggő Rázócsalád kristályszerkezete K + csatorna. Tudomány, 2005. 309 (5736): 897-903. o.
33.Chen, X., et al., A KV1.2 Teljes hosszúságú rázógép káliumcsatornájának szerkezete normál módú alapú Röntgenkristályos finomítással. Proc Natl Acad Sci USA, 2010. 107(25): o. 11352-7.
34.Clayton, G. M., et al., A bakteriális ciklikus nukleotid által szabályozott csatorna transzmembrán régióinak szerkezete. Proc Natl Acad Sci USA, 2008. 105(5): o. 1511-5.
35.Payandeh, J., et al., A feszültséggel kötött nátriumcsatorna kristályszerkezete. Természet, 2011. 475 (7356): o. 353-8.
36.Zhang, X., et al., A nachbac feszültséggel kötött nátriumcsatorna ortológusának kristályszerkezete. Természet, 2012. 486(7401): p. 130-4.
37.Liao, M., et al., A TRPV1 ioncsatorna szerkezete elektron krio-mikroszkópiával meghatározva. Természet, 2013. 504 (7478): p. 107-12.
38.Long, S. B., et al., Feszültségfüggő k+ csatorna atomszerkezete lipidmembránszerű környezetben. Természet, 2007. 450 (7168): o. 376-82.