a glükóz-alanin ciklus vagy Cahill ciklus, amelyet Mallette, Exton és Park, valamint Felig et al. 1969 és 1970 között az extrahepatikus szövetek, például a vázizom, alaninként exportálják a piruvátot és az aminocsoportokat a májba, és glükózt kapnak a májból a véráramon keresztül.
a glükóz-alanin ciklus fő lépéseit az alábbiakban foglaljuk össze.
- amikor extrahepatikus szövetekben aminosavakat használnak energiához, a glikolízisből származó piruvátot aminocsoport-akceptorként használják, alanint, nem esszenciális aminosavat képezve.
- az alanin diffundál a véráramba és eléri a májat.
- a májban az alanin aminocsoportja átkerül a kb-ketoglutarátba piruvát, illetve glutamát képződése céljából.
- a glutamát aminocsoportja többnyire belép a karbamid ciklusba, és részben nitrogén donorként működik számos bioszintetikus úton.
a piruvát belép a glükoneogenezisbe, és glükózszintézisre használják. - az újonnan képződött glükóz diffundál a véráramba, és eléri a perifériás szöveteket, ahol a glikolízis következtében piruváttá alakul, amely képes elfogadni a szabad aminosavakból származó aminocsoportokat, ezáltal lezárva a ciklust.
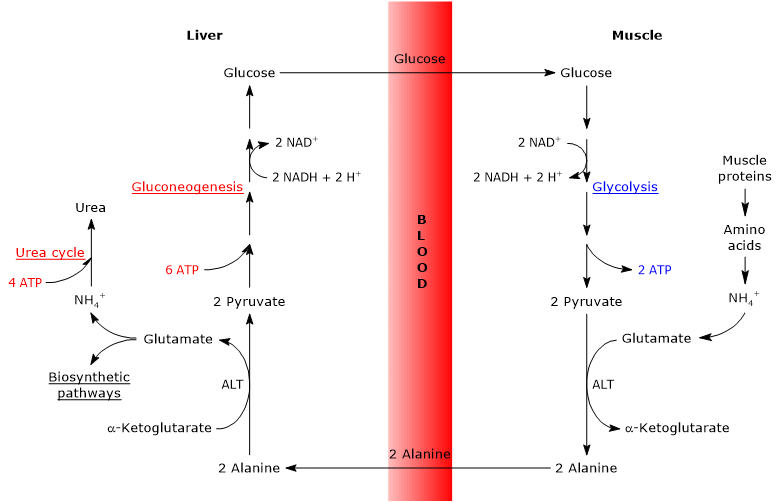
ezért a glükóz-alanin ciklus kapcsolatot biztosít a szénhidrát és az aminosav metabolizmus között, amint azt az alábbiakban vázlatosan leírjuk.
szőlőcukor (szőlőcukor) Xhamsterpiruvát (piruvát), alanin (alanin), piruvát (piruvát) stb
a glükóz-alanin ciklus nemcsak a vázizom, az első szövet, amelyben megfigyelték, és a máj között fordul elő, hanem más sejteket és extrahepatikus szöveteket is magában foglal, beleértve az immunrendszer sejtjeit, például a limfoid szerveket.
tartalom
- a glükóz-alanin ciklus lépései
- a Cahill ciklus a vázizomban
- a Cahill ciklus a májban
- transzaminázok
- a glükóz-alanin ciklus funkciói
- a glükóz-alanin ciklus energiaköltsége
- hasonlóságok és különbségek a Cahill ciklus és a Cori ciklus között
a glükóz-alanin ciklus lépései
a glükóz-alanin ciklus lépéseinek elemzése a vázizom és a máj közötti ciklus figyelembevételével történik.
mind az intracelluláris, mind az extracelluláris fehérjék folyamatosan hidrolizálódnak az alkotó aminosavakká és újraszintetizálódnak, és ezeknek a folyamatoknak a sebessége pontosan kiegyensúlyozott, ezáltal megakadályozva a zsírmentes tömeg elvesztését.
azonban katabolikus körülmények között, például intenzív és hosszan tartó testmozgás vagy éhezés esetén az izomfehérje lebontásának sebessége meghaladja a szintézist. Ez az aminosavak felszabadulásához vezet, amelyek közül néhányat energiára, másokat glükoneogenezisre használnak. Az aminosavak, különösen az elágazó láncú aminosavak vagy a BCAA (leucin, izoleucin és valin) szénvázainak oxidációja jelentős energiaforrás lehet az izom számára. Például körülbelül 90 perc megerőltető testmozgás után az izom aminosav-oxidációja biztosítja az összehúzódáshoz szükséges energia 10-15% – át.
az aminosavak szénvázainak energiafelhasználása magában foglalja az aminocsoport eltávolítását, majd az amino-nitrogén kiválasztását nem toxikus formában.
az aminocsoport eltávolítása transzaminálással történik, ami a következőképpen foglalható össze:
CA-Keto-sav + aminosav ca-új aminosav + új CA-keto-sav
az ilyen reakciók, amelyeket az aminotranszferázoknak vagy transzaminázoknak nevezett enzimek katalizálnak (EC 2.6.1), szabadon reverzibilisek.
elágazó láncú aminosavak, például, az aminocsoportot átviszik az eredeti aminosavból származó amino-ketoglutarátba vagy 2-oxoglutársavba, így az elágazó láncú aminotranszferáz vagy BCAT (EC 2.6 .1.42).
a Cahill-ciklus a vázizomban
a vázizomban az újonnan képződött glutamát ammóniával reagálva glutamint képezhet számos szövetben és szervben, például az agyban, amely a nitrogén szervek közötti transzportjának fő hordozója. A reakciót a citoszol glutamin szintetáz enzim (EC 6.3.1.2) katalizálja, és ATP-t fogyaszt.
Glutamát + NH4+ + ATP → Glutamin + ADP + Pi
ebben az esetben A glutamát levelek a Cahill ciklus.
Alternatív megoldásként, ellentétben azzal, ami a többi szövet többségében történik, az újonnan képződött glutamát átviheti az aminocsoportot a glikolízisből származó piruvátba, alanint és ketoglutarátot képezve. Ezt a transzaminációt az alanin-aminotranszferáz vagy az ALT (EC 2.6.1.2) katalizálja, amely enzim a legtöbb állati és növényi szövetben megtalálható.
glutamát + piruvát (alanin + 6612)-ketoglutarát
a közvetlenül a fehérje lebontásából származó alanin, valamint az izomfehérjék alaninban gazdagok, elhagyhatják a sejtet, és a véráramban a májba szállíthatják; ily módon az aminocsoport eléri a májat. Az a sebesség, amellyel a piruvát transzaminálásával képződött alanin a keringésbe kerül, arányos az intracelluláris piruváttermeléssel.
megjegyzés: az alanin és a glutamin a nitrogén és a szén fő forrásai a szervek közötti aminosav-anyagcserében.
a Cahill-ciklus a májban
a májban egyszer egy májalanin-aminotranszferáz katalizálja a transzaminációt, amelyben az alanin, a fő glükoneogén aminosav aminocsoport-donorként, a keto-ketoglutarát pedig a keto-keto-sav akceptorként működik. A reakció termékei a piruvát, azaz az alanin szénváza, valamint a glutamát.
alanin + CA-ketoglutarát Ca-glutamát + piruvát
glutamát, a glutamát-dehidrogenáz által katalizált reakcióban (EC 1.4.1.2), a mitokondriális mátrixban jelen lévő enzim ammóniumionot képez, amely belép a karbamid ciklusba, és a ketoglutarátot, amely beléphet a Krebs ciklusba. Ez a reakció egy anaplerotikus reakció, amely összekapcsolja az aminosav-anyagcserét a Krebs-ciklussal.
glutamát + H2O + NAD+ ca + ketoglutarát+ NH4 + + NADH+H +
azonban a glutamát az oxaloacetáttal is reagálhat aszpartát és Ca-ketoglutarát képződésére az aszpartát-aminotranszferáz által katalizált reakcióban (EC 2.6.1.1). Az aszpartát részt vesz a karbamid képződésében, valamint a purinok és pirimidinek szintézisében.
glutamát + oxaloacetát ~ aszpartát + ~ ketoglutarát
az előállított piruvátnak más metabolikus sorsa is lehet: ATP termelésre oxidálható, majd elhagyhatja a glükóz-alanin ciklust, vagy beléphet a glükoneogenezis útjába, és így folytathatja a ciklust.
az előállított glükóz felszabadul a májból a véráramba, és különböző szövetekbe kerül, amelyek megkövetelik, mint a vázizomzat, amelyben piruvát szintézisre használják. Az újonnan képződött piruvát viszont reagálhat a glutamáttal, ezáltal lezárva a ciklust.
transzaminázok
mint korábban említettük, az aminocsoport eltávolítása az aminosavakból transzaminálással történik (lásd fent az általános reakciót). Ezeket a reakciókat az aminotranszferázoknak vagy transzaminázoknak nevezett enzimek katalizálják.
citoszol enzimek, amelyek minden sejtben jelen vannak, és különösen bőségesek a májban, a vesében, a bélben és az izomban; koenzimként piridoxál-foszfátot vagy PLP-t, a B6-vitamin vagy a piridoxin aktív formáját igénylik, amely szorosan kötődik az aktív helyhez.
a transzaminációs reakciókban a szabad aminosavak aminocsoportja-a treonin és a lizin kivételével-kis számú, a három-ketosav, nevezetesen a piruvát, az oxaloacetát és a három-ketoglutarát felé irányul.
a sejtek különböző típusú aminotranszferázokat tartalmaznak: sokan specifikusak a kb-ketoglutarátra, mint a kb-keto-sav akceptorra, de különböznek az aminosav specifitásában, amelyből elnevezik őket. Ilyen például a fent említett alanin-aminotranszferáz, más néven alanin-transzamináz és glutamikus piruvikus transzferáz vagy GPT, valamint aszpartát-aminotranszferáz vagy AST, más néven glutamikus-oxaloecet transzamináz vagy GOT.
hangsúlyozni kell, hogy ezekben a reakciókban nincs nettó deamináció, az aminocsoportok nem veszítenek, mivel az amino-keto-akceptor aminizálódik, az aminosav pedig deaminálódik.
a glükóz-alanin ciklus funkciói
ennek a ciklusnak különböző funkciói vannak.
- nem toxikus formában szállítja a nitrogént a perifériás szövetekből a májba.
- piruvátot, egy glükoneogén szubsztrátot szállít a májba.
- eltávolítja a piruvátot a perifériás szövetekből. Ez az ATP magasabb glükóztermeléséhez vezet ezekben a szövetekben. Valójában a glikolízis során keletkező NADH bejuthat a mitokondriumokba, és oxidatív foszforilációval oxidálható.
- lehetővé teszi az alanin viszonylag magas koncentrációjának fenntartását a hepatocitákban, ami elegendő a fehérje lebomlásának gátlásához.
- szerepet játszhat a gazdaszervezet fertőző betegségek elleni védekezésében.
végül fontos hangsúlyozni, hogy a glükóz-alanin ciklusban nincs nettó glükózszintézis.
a glükóz-alanin ciklus energiaköltsége
a Cori-ciklushoz hasonlóan a glükóz-alanin ciklus energiaköltsége is 3-5 ATP.
a ciklus azon része, amely a perifériás szövetekben zajlik, 5-7 ATP termelését foglalja magában glükózmolekulánként:
- 2 az ATP-t glikolízissel állítják elő;
- 3-5 ATP származik NADH/FADH2 (lásd alább).
ehelyett a májban a glükoneogenezis és a karbamid ciklus 10 ATP-be kerül:
- 6 az ATP-t a glükoneogenezis során szintetizált glükózmolekulánként fogyasztják;
- 4 ATP-t fogyasztanak a karbamid-ciklusban szintetizált karbamid-molekulánként.
a glükóz-alanin ciklus, mint a Cori ciklus, az anyagcsere terhelésének egy részét az extrahepatikus szövetekből a májba tolja. A máj által fizetett energiaköltséget azonban igazolják azok az előnyök, amelyeket a ciklus az egész test számára hoz, mivel bizonyos körülmények között lehetővé teszi a fehérjék hatékony lebontását az extrahepatikus szövetekben (különösen a vázizomban), ami viszont lehetővé teszi glükoneogén szubsztrátok előállítását, valamint aminosavak felhasználását az extrahepatikus szövetekben.
hasonlóságok és különbségek a Cahill-ciklus és a Cori-ciklus között
van néhány analógia a két ciklus között, amelyeket alább sorolunk fel.
- a Cahill-ciklus részben átfedi a Cori-ciklust, amikor a piruvát glükózzá alakul, és a monoszacharid az extrahepatikus szövetekbe kerül, ahol a glikolitikus úton ismét piruváttá alakul.
- a glükoneogenezis útba való belépés hasonló a két ciklusban: mind az alanin, mind a laktát piruváttá alakul.
- a Cori-ciklushoz hasonlóan a glükóz-alanin ciklus különböző sejttípusok között zajlik, ellentétben az egyes sejtekben előforduló metabolikus útvonalakkal, például glikolízissel, Krebs-ciklussal vagy glükoneogenezissel
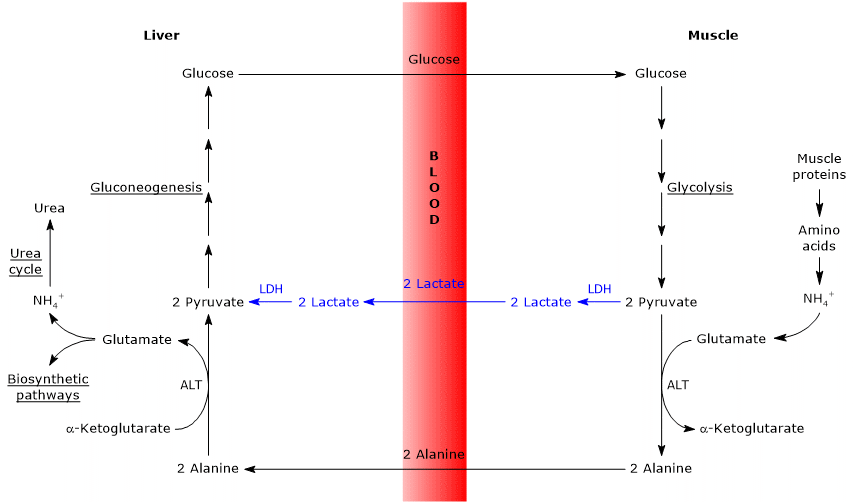
az alábbiakban néhány különbség van a két ciklus között.
- a fő különbség a három szén-köztitermékre vonatkozik, amelyek a perifériás szövetekből eljutnak a májba: Laktát a Cori ciklusban, alanin a glükóz-alanin ciklusban.
- egy másik különbség a perifériás szövetekben a glikolízis által termelt NADH sorsára vonatkozik.
a Cori-ciklusban a koenzim redukálószerként működik a piruvát laktáttá történő redukálására a laktát-dehidrogenáz által katalizált reakcióban (EC 1.1.1.27).
a glükóz-alanin ciklusban ez a redukció nem következik be, és a NADH elektronjai a malát-aszpartát és a glicerin-3-foszfát transzfereken keresztül a mitokondriumokba szállíthatók, létrehozva a NADH-t, az első transzfert, és a FADH2-t, a másik transzfert. A NADH és a FADH2 ATP hozama pedig 2,5, illetve 1,5. - végül az előző pontból egyértelmű, hogy a Cori-ciklustól eltérően a Cahill-ciklus oxigén és mitokondrium jelenlétét igényli a perifériás szövetekben.
Berg J. M., Tymoczko J. L. és Stryer L. Biokémia. 5. kiadás. W. H. Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill G. F. alanin: kulcsszerep a glükoneogenezisben. Tudomány 1970;167 (3920): 1003-4. doi: 10.1126 / tudomány.167.3920.1003
Gropper S. S., Smith J. L., Groff J. L. Fejlett táplálkozás és az emberi anyagcsere. Cengage Learning, 2009
Lecker S. H., Goldberg A. L. és Mitch W. E. fehérje lebomlás az ubiquitin–proteaszóma útvonalon normál és betegség állapotokban. J Am Soc Nephrol 2006;17(7): 1807-19. doi:10.1681 / ASN.2006010083
Mallette L. E., Exton J. H. és Park C. R. a glükoneogenezis szabályozása aminosavakból a perfundált patkánymájban. J Biol Chem 1969; 244 (20): 5713-23.
Nelson D. L., Cox M. M. Lehninger. A biokémia alapelvei. 6. Kiadás. W. H. Freeman and Company, 2012
Raju S. M., Madala B. Illusztrált orvosi biokémia. Jaypee Brothers Publishers, 2005
Wu G. aminosavak: biokémia és táplálkozás. CRC Press, 2013