MAE. 彼らはドラヴェ症候群(SCN1A)と移行焦点発作(KCNT1)と幼児期のてんかんを含む著名な遺伝的原因にリンクされているように、我々はゲノム時代に批判的に しかし、遺伝的原因が長い間疑われてきたが、とらえどころのないままである他の多くのてんかん症候群がある。 主に未踏のまま残っているてんかん症候群の一つは、また、ミオクローナルAstaticてんかん(MAE)またはミオクローナルAtonic発作とてんかんと呼ばれるドース症候群です。 てんかんの最近の研究では、我々はドゥース症候群の遺伝的アーキテクチャを検討し、SYNGAP1、NEXMIF(KIAA2022)、およびSLC6A1を含む個人の14%における単原性の原因を同定した。 我々の研究は、Doose症候群は遺伝的に異質であり、おそらく異なる遺伝的景観を有することを示唆している。
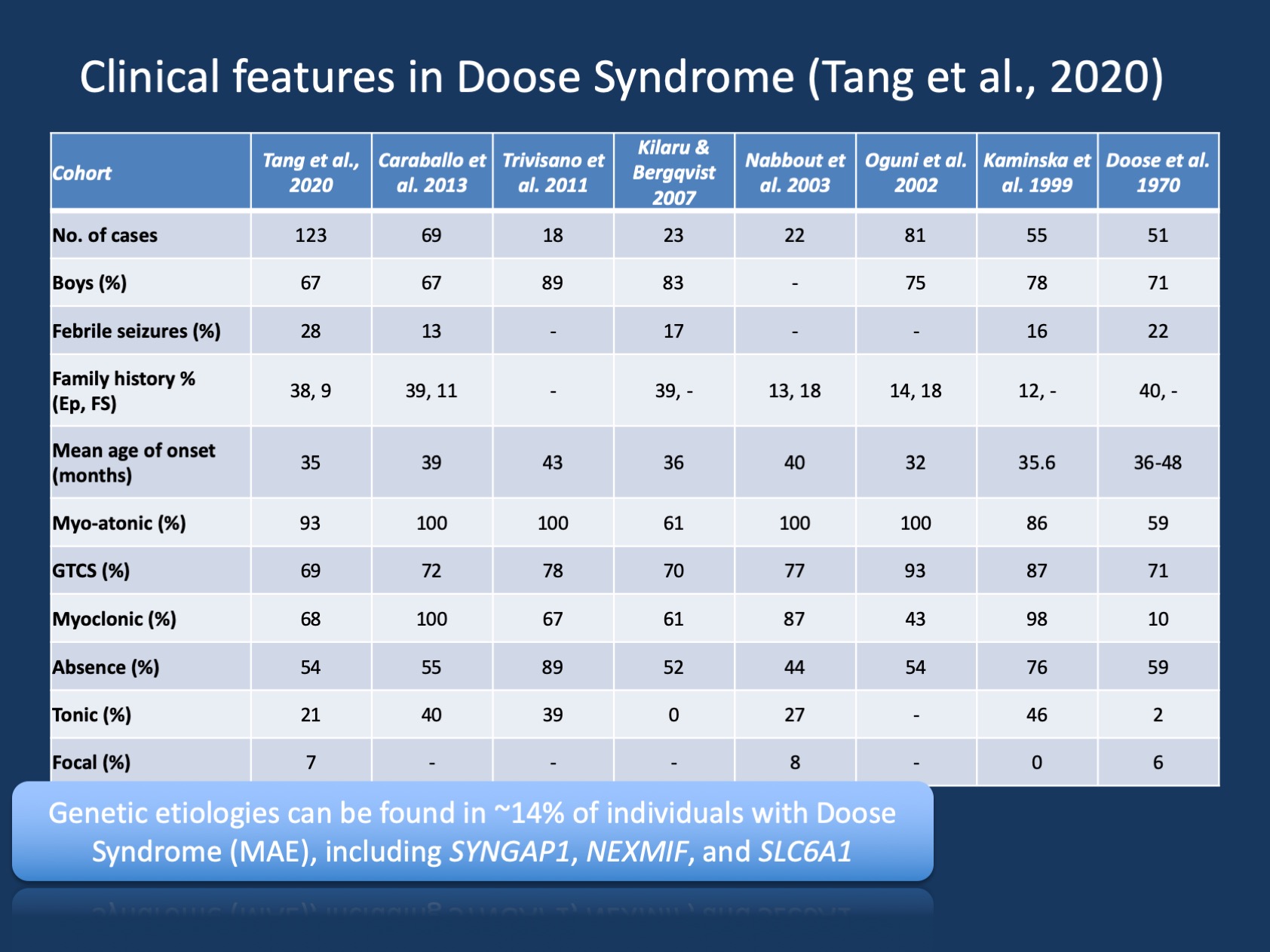
図1. Doose症候群(ミオクローナル性無緊張発作またはミオクローナル性Astaticてんかんを伴うてんかん)の臨床的特徴。 この表は、Tang et al.による最近の出版物から適応されている。、2020および1970年の最初の記述以来報告されているDoose症候群の大規模なコホートにおける臨床的特徴を比較する。 Doose症候群(MAE)はまれなてんかん症候群であるが、認識可能な臨床的実体である。 しかし、個人の>90%がSCN1Aに疾患を引き起こす変異体を有するDravet症候群とは対照的に、Doose症候群は遺伝的に異質である。
メイの歴史。 まず、いくつかの命名の問題を整理しましょう。 DooseシンドロームかMyoclonic Astatic癲癇(MAE)は現在公式に最も最近の命名規則を使用してMyoclonic Atonic発作を用いる癲癇と言われます。 しかし、私たちは通常、てんかん関連の用語がどのように使用されているかの公式の方法に自分自身を整列しようとしていますが、私はここで少し頑固 ドイツのキールの神経科で訓練を受けた小児神経科医として、私はこの状態をDOOSE症候群と呼び、MAEを省略して、ヨーロッパの小児てんかん学の創設者の一人であるHermann Doose(1927-2018)を称えます(memoriamのILAEへのリンク)。 多くの英語ネイティブスピーカーは、通常、発音が間違って取得–正しい発音は”Dohs-ah”であり、”ガチョウ”と韻を踏んでいません。
メイの臨床像。 Dooseは、典型的には重要な臨床観察を行うと信じられています: 1960年代に、キールの彼と彼の共同研究者は、ドロップ攻撃(無緊張発作)、ミオクローナル発作、一般化された強直間代発作、および一般化された脳波パターンの突然の発症によって特徴付けられた子供の異常なてんかんを認識し、典型的には二から五歳の間に発生しました。 この癲癇は前の典型的な開発の子供に普通起こり(下記を見なさい)、頻繁に発達の遅れおよび知的な不能で起因した。 Dooseらは,この新たに認められたてんかん症候群は,発熱によって引き起こされる全身性強直間代発作を伴うlennox-Gastaut症候群またはてんかんとは異なることを認識し,後者は後にDravet症候群として概念化された。
Dooseシンドローム(MAE)の臨床記述は長年にわたって安定していましたが、MAEは遺伝の基礎が発見され、目標とされた研究が新しい処置を可能にするかもしれ Tangと共同研究者による最近の出版物では、1970と2020の間の過去50年間の8つの研究をリストし、合計442人の記載された個人をリストしました。 したがって、MAEはまれですが、ほとんどの小児神経科医および小児てんかん専門医がこの状態を認識していることは十分に一般的です。 MAEを持つ個人の小さいサブセットだけ根本的な癲癇を説明する構造頭脳の調査結果か新陳代謝の異常があります–MAEの子供の大半で、neuroimagingおよび新陳代謝
メイの原因を見つける。 説明的なイメージ投射または新陳代謝の調査結果の不在は根本的な遺伝の原因のための心配を上げる。 これまでの研究では、家族歴を評価することによって疫学的研究を通じて遺伝的貢献を特定しようとしていましたが、この伝統的な方法は、てんかん遺伝学の最近の発見によって主に取って代わられています。 重度の小児てんかんの遺伝的基礎を評価することは、遺伝的疫学ではなく分子遺伝学によって行われている。 MAEの遺伝的アーキテクチャを評価することは、Epilepsiaに掲載されたTangと共同研究者による私たちの研究の目標の一つでした。
メイは一つの病気ですか? MAEでの遺伝的知見を説明する前に、MAEフィールド内で進行中の議論を紹介しましょう。 Dooseと共同研究者による最初の記述には、発作発症前に典型的な発達をした子供が主に含まれていました(>75%)、これは私たちの最近の研究(79%)に匹敵します。 しかし、前の発達の問題の有無にかかわらず、子供を比較するとき、私たちは同じ病気を見ているのですか、または前の目立たない発達の子供だけが典型的なMAEとみなされるべきですか? てんかんの歴史と結果を考慮すると、この質問は簡単に解決されませんが、根底にある遺伝的変化はいくつかの手がかりを提供するかもしれません。 遺伝の原因はより厳しいneurodevelopmental無秩序の子供でより頻繁に識別され、識別された遺伝の原因のすべての子供に癲癇に加えて複雑なneurodevelopmental無秩序がありました。 したがって、遺伝的原因はMAEの小児で観察されるが、通常はMAEおよび併存神経発達障害の小児でのみ観察され、MAEは遺伝的に不均一な状態であるだけでなく、遺伝的不均一性および併存疾患に関して小児期の他のてんかんと同様の特徴を有することを示唆している。 例えば、ウエスト症候群(乳児痙攣)では、遺伝的原因は、神経発達所見を有する小児でのみ同定され、神経発達後遺症なしに投薬に直接反応する小児では同定されない。
MAEの遺伝的スペクトルは,てんかん性脳症全体とは異なっている。 遺伝子検査は85人で行われ、12/85(14%)の個人は陽性の遺伝的所見を有していた。 三つの遺伝子は、SYNGAP1、NEXMIF(KIAA2022)、およびSLC6A1を含む二つの個体で発見されました。 遺伝子のこのトライアドは、以前に一般化された発作を伴う発達およびてんかん性脳症にリンクされています。 さらに、単一の個体は、KCNA2、SCN2A、STX1B、KCNB1、およびMECP2において疾患を引き起こす変異体を有することが見出された。 すべてのこれらの遺伝子は、以前に私たちのブログで議論され、一般化された発作と一般化された脳波の特徴を提示することが知られています。
いくつかの以前の報告では、SCN1Aの変異体が発見されていますが、これは私たちのコホートでは発見されませんでした。 加えて、CDKL5およびSLC2A1(GLUT1)を含む、他の一般的なてんかん遺伝子は特に存在しない。 これは、比較的小さなコホートから限られた結論しか引き出すことができないにもかかわらず、MAEの遺伝的景観は、他の発達およびてんかん性脳症とは MAEの診断収量はそれほど高くはない–14%は、発達およびてんかん性脳症で典型的に見られるよりもはるかに低い。 しかし、典型的な発達を有する個体を除外する場合、診断収量ははるかに高く、遺伝子検査はMAEを有する小児において価値があることを示唆している。 一般に、MAEを持つ単一の個人がSLC2A1の病気引き起こす変形を持っていなかったのに、遺伝の癲癇の治療可能な原因のための遺伝子検査は一般に非定型の一般化された癲癇で考慮されるかもしれません。
メイの行方不明の遺伝性。 遺伝子検査が個人の80%以上でMAEに陰性である場合、隠された遺伝的負担はどこにありますか? 2020年現在、私は二つの可能な説明を提案するだろう。 第一に、一般化されたてんかんの遺伝的負担は完全に未知ではない。 小児不在てんかん(CAE)や若年性ミオクロニックてんかん(JME)などの疾患に対する人口リスクの3 0%以上について解説した。 しかし、この説明は、単一遺伝子の原因ではなく、何千もの一般的な遺伝的変異体の相加的効果を参照して、多遺伝子リスクによって与えられています。 MAEは、この多遺伝子リスクが特に高い一般化されたてんかんの「極端な表現型」を表す可能性があると仮定することができます。 この仮説は検証可能であり、将来的には確実に追求されるでしょう。 さらに、ヒトゲノムにはエクソームよりも多くのものがあり、てんかんにおける最近の知見は、家族性成人ミオクローナルてんかん(FAME)における反復拡張のような非コーディング変異体の役割を強調している。 MAEを持つ多くの子供の驚くほど類似した臨床的特徴を考えると、全ゲノム配列決定を使用して、エクソーム外のMAEを持つ多くの子供の共通の遺伝的原因を探すことは依然として合理的であるかもしれません。 一緒に取って、多遺伝子リスクスコア(PRS)と全ゲノムシーケンシング(WGS)を評価することは、さらにMAEの遺伝的基盤を識別するための二つの潜在的な道です。
あなたが知る必要があるもの。 ドゥース症候群(ドゥースしょうこうぐん、)は、遺伝的てんかん症候群であり、原因は異質であると考えられている。 疾患を引き起こす変異体は、小児の14%に存在し、典型的には、発達遅延または自閉症などの追加の神経発達の特徴を有する小児で同定される。 SYNGAP1、NEXMIF(KIAA2022)、およびSLC6A1を含む遺伝子のトライアドは、他の発達およびてんかん脳症とはやや異なる共有の基礎となる生物学を示唆する可能性があ
Ingo Helbigはフィラデルフィア(CHOP)、米国の子供の病院で働く子供の神経科医および癲癇の遺伝学の研究者である。 彼はまた、ドイツのキール大学でてんかん遺伝学グループをリードしています。

