学習目標
このセクションの終わりまでに、あなたは次のことができます:
- 中性原子とイオンのルイス記号を書く
- 単純な分子の結合を描いたルイス構造を描く
我々は、原子および/またはイオンの間に形成される結合の様々なタイプを議論してきました。 すべての場合において、これらの結合は、原子間の価電子殻電子の共有または移動を含む。 このセクションでは、価電子殻電子と化学結合、すなわちルイス記号とルイス構造を描写するための典型的な方法を探求します。
ルイス記号
原子と単原子イオンの価電子配置を記述するためにルイス記号を使用します。 ルイス記号は、その価電子のそれぞれについて一つのドットで囲まれた元素記号で構成されています:
図1は、周期表の第三周期の元素のルイス記号を示しています。

図1が表示されます。 ルイス記号は、周期表の第三周期における各元素の価電子の数を示す。
ルイス記号は、ナトリウムとカルシウムのためにここに示されているように、原子からの陽イオンの形成を示すためにも使用することができます:

を持つナトリウム記号につ:

という文字は、イオン性化合物の形成中の電子の移動を示すルイス記号の使用を示

図2が表示されます。 カチオンは原子が電子を失うと形成され、ルイスドットが少なくなるのに対し、アニオンは原子が電子を得ることによって形成される。 電子の総数は変化しない。
ルイス構造
ルイス構造、分子と多原子イオンの結合を説明する図面に示されている共有結合の形成を示すためにルイス記号を使用します。 例えば、2つの塩素原子が塩素分子を形成するとき、それらは1対の電子を共有する:

ルイス構造は、各Cl原子が結合に使用されない3対の電子(孤立電子対と呼ばれる)と1つの共有電子対(原子間に書かれた)を有することを示している。 ダッシュ(または線)は、電子の共有ペアを示すために使用されることがあります:

単一の共有電子対は単結合と呼ばれます。 それぞれのCl原子は8つの価電子と相互作用します:孤立電子対の6つと単結合の2つ。
オクテット則
他のハロゲン分子(F2、Br2、I2、およびAt2)は塩素分子のような結合を形成します:原子間の1つの単結合と原子あたりの3つの これは、各ハロゲン原子が希ガス電子配置を有することを可能にする。 主基原子が八価電子を得るのに十分な結合を形成する傾向は、オクテット則として知られている。
原子が形成できる結合の数は、オクテット(八価電子)に到達するために必要な電子の数から予測することができることが多い;これは特に周期表の第二周期(C、N、O、F)の非金属に当てはまる。 例えば、第14族元素の各原子は、その最外殻に四つの電子を有し、したがって、オクテットに到達するために四つのより多くの電子を必要とする。 これらの4つの電子は、Ccl4中の炭素(四塩化炭素)およびSih4中のケイ素(シラン)についてここに示されるように、4つの共有結合を形成することによ 水素は原子価殻を満たすために2つの電子しか必要としないので、オクテット則の例外である。 遷移要素と内部遷移要素もオクテット規則に従いません:

という言葉の15族元素は、原子ルイスシンボルに五つの価電子を持っている:一つの孤立した対と三つの不対電子。 オクテットを得るために、これらの原子はNH3(アンモニア)のように3つの共有結合を形成する。 第16族の酸素および他の原子は、二つの共有結合を形成することによってオクテットを得る:
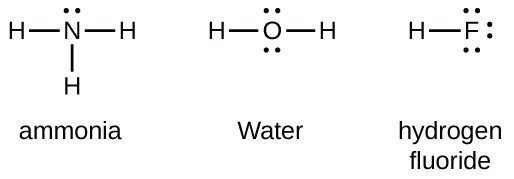
二重結合と三重結合
先に述べたように、原子のペアが一組の電子を共有するとき、これを単結合と呼びます。 しかし、原子のペアは、必要なオクテットを達成するために、電子の複数のペアを共有する必要があるかもしれません。 二重結合は、CH2O(ホルムアルデヒド)の炭素原子と酸素原子の間、およびC2H4(エチレン)の二つの炭素原子の間のように、一対の原子間で二対の電子が共有されているときに形成される。
という言葉は、窒素ガス(N2)のように、三つの電子対が原子のペアによって共有されているときに三重結合が形成される。):
オクテット則
でルイス構造を書く非常に単純な分子と分子イオンのために、我々は単に構成原子上の不対電子をペアリングすることによってルイス構造を書くことができます。 これらの例を参照してください:

より複雑な分子や分子イオンについては、ここで概説したステップバイステップの手順に従うことが有用です:
- 原子価(外殻)電子の総数を決定する。
- 分子の骨格構造を描き、原子を中心原子の周りに配置します。 (一般的に、最も電気陰性度の低い要素は中央に配置する必要があります。)各原子を単結合(一つの電子対)で中心原子に接続する。
- 残りの電子を末端原子(水素を除く)上に孤立電子対として分配し、各原子の周りにオクテットを完成させる。
- 残りのすべての電子を中心原子に置きます。
- 可能な限りオクテットを得るために、外側の原子の電子を再配置して中心原子と多重結合を作ります。
上記の手順を使用してPbr3のルイス構造を決定しましょう:
- ステップ1:原子価(外殻)電子の総数を決定する。
\ラージ\開始{アレイ}{l}\\ファントム{\ルール{0.8em}{0ex}}{\テキスト{PBr}}_{3}\\ファントム{\ルール{0.8em}{0ex}}\テキスト{P:5価電子/原子}\回\テキスト{1原子}=5\\下線{+\text{Br:7価電子/原子}\回\テキスト{3原子}=21}\\\\ファントム{\ルール{15。{0ex}}=\テキスト{26価電子}端\{アレイ}
- ステップ2:分子の骨格構造を描き、原子を中心原子の周りに配置します。 (一般的に、最も電気陰性度の低い要素は中央に配置する必要があります。)各原子を単結合(一つの電子対)で中心原子に接続する。

- ステップ3:残りの電子を末端原子(水素を除く)上の孤立電子対として分配し、各原子の周りにオクテットを完成させる。
 ステップ4:残りのすべての電子を中心原子に配置する。
ステップ4:残りのすべての電子を中心原子に配置する。

注:ステップ5:すべての原子がオクテットを持っているので、必要ありません。
CH2Oのルイス構造を決定しよう.
- ステップ1: 原子価(外殻)電子の総数を決定する。
\ラージ\開始{アレイ}{l}\\ファントム{\ルール{0.8em}{0ex}}{\テキスト{H}_{2}}\テキスト{CO}\\ファントム{\ルール{0.8em}{0ex}}\テキスト{H:1価電子/原子}\回\テキスト{2原子}=2\\\テキスト{C:4価電子/原子}\回\テキスト{1原子}=4\\\下線{+\テキスト{O:6価電子/原子}\テキスト{1原子}=4\\\下線{+\テキスト{O:6価電子/原子}\テキスト{1原子}=4\\\下線{+\テキスト{O:6価電子/原子}\テキスト{1原子}=4\\\下線{+\テキスト{O:6価電子/原子}\テキスト{1原子}=4\\\下線{+\テキスト{O:6価電子/原子}\テキスト{1原子}=4\\\下線{+\テキスト{O:6価電子/原子}\時間\テキスト{1原子}=6}\\\ファントム{ルール{15.95em}{0ex}}=\テキスト{12価電子}端\{アレイ}
- ステップ2:分子の骨格構造を描き、原子を中心原子の周りに配置します。 (一般的に、最も電気陰性度の低い要素は中央に配置する必要があります。)各原子を単結合(一つの電子対)で中心原子に接続する。

- ステップ3:残りの電子を末端原子(水素を除く)上の孤立電子対として分配し、各原子の周りにオクテットを完成させる。

- ステップ4:すべての電子が配置されているので、必要ありません。 しかし、炭素はオクテットを持たない、
- ステップ5: 可能な限りオクテットを得るために、中心原子との多重結合を作るために外側の原子の電子を再配置します。

例1:ルイス構造の記述
NASAのカッシーニ・ホイヘンス計画は、土星の衛星の1つであるタイタンに有毒なシアン化水素(HCN)の大きな雲を検出しました。 これらの分子のルイス構造は何ですか?
学習をチェック
二酸化炭素、CO2は化石燃料の燃焼の産物です。 CO2は地球規模の気候変動に関与しています。 CO2のルイス構造とは何ですか?
主な概念と概要
原子価電子構造は、ルイス記号(原子および単原子イオンの場合)およびルイス構造(分子および多原子イオンの場合)を描くことによ 孤立電子対、不対電子、および単結合、二重結合、または三重結合は、価電子がルイス構造の各原子の周りに位置する場所を示すために使用される。 ほとんどの構造、特に2番目の行の要素を含む構造は、すべての原子(Hを除く)が8つの電子に囲まれているオクテット則に従います。 オクテット則の例外は、奇数電子分子(フリーラジカル)、電子欠損分子、および超原子価分子に対して発生します。
演習
- 次の各イオンのルイス記号を書く:
- As3–
- I–
- Be2+
- O2–
- Ga3+
- Li+
- N3–
- 多くの単原子イオンは、以下の元素のリストから形成されたイオンを含む、海水中に見出される。 以下の元素から形成された単原子イオンのルイス記号を書く:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- 以下のイオン化合物のそれぞれのイオンのルイス記号と、それらが形成されている原子のルイス記号を書く:
- MgS
- Al2O3
- Gacl3
- K2O
- Li3N
- KF
- 以下に挙げるルイス構造において、MとXは周期表の第三周期における様々な元素を表す。 各元素の化学記号を使用して、各化合物の式を記述します:
- 高温のリン蒸気中に見られる不安定な形態のリンである二原子分子P2のルイス構造を記述する。
- 以下のルイス構造を記述します。
- H2
- Hbr
- Pcl3
- 次のルイス構造を記述します。
- O2
- H2CO
- Asf3
- Sicl4
用語集
二重結合:二つの原子間で二対の電子が共有されている共有結合
フリーラジカル:奇数の電子を含む分子
超価分子:価電子殻に八つ以上の電子を有する少なくとも一つの主基元素を含む分子
ルイス構造:分子またはイオン中の孤立電子対と結合する電子対を示す図
ルイス記号: 元素またはイオン内の各価電子を表すためにドットを使用する単原子イオンのシンボル
孤立電子対:共有結合を形成するために使用されていない価電子のペア
オクテットルール:主要なグループ原子が八価電子が各核と相互作用する構造を形成することを示すガイドライン
単結合:単一結合で接続された両方の原子と相互作用するものとして結合電子を数える
単結合:単一結合がある結合電子のペアは、二つの原子の間で共有されています
三重結合: 二つの原子の間に三対の電子が共有されている結合


 HCN:電子は残っていません
HCN:電子は残っていません




















