それは明白ではありません。 価電子は、化学結合において重要な電子である。 遷移金属の場合、”重要”という言葉は文脈によって異なります。
遷移金属に関しては、どの軌道が原子価軌道であるかを記述する方が簡単で実用的です(ランタニドやアクチニドでは困難になりますが)。
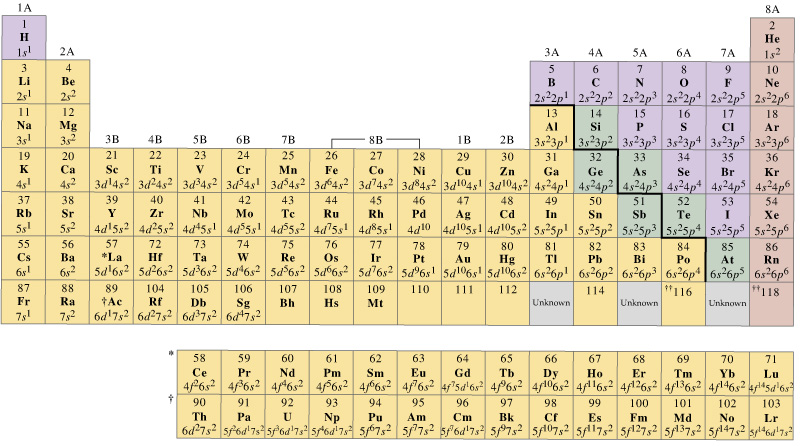
一般に、第一列の遷移金属は、それらの#4s#および#3d#を含む一連の価電子軌道を有するが、価電子の数は変化する。 例えば、
。..

- スカンジウムは、酸化状態が存在する(例えば、「ScCl」_3#)が、「Sc」^(+4)#以上ではないので、最大3個の価電子を有することは理にかなっている。 それが純粋な陽イオンを形成するのであれば、#+3#の酸化状態は3つの価電子を移動させる必要があったでしょう。
- クロムは、#+6#酸化状態(すなわち#”Cr”_2″O”_7^(2-)#、または#”CrO”_2″O”_7^(2-)#を達成することができるので、その#3d#電子を含む六つの価電子を持つことができる。”_4^(2-)#).
- 銅は#+1#酸化状態(例えば#”CuCl”#)を有する傾向があるので、その1つの#4s#電子をその価電子として最も頻繁に使用することは理にかなっています。 しかし、#+2#酸化状態も知られている(例えば#”CuCl”_2#)ので、その#bb(3d)#電子からもその価電子を取り出すことができます。
一方、1列目の遷移金属の原子価軌道は#4s#と#3d#軌道であると簡単に言うことができます。
だから、一般的に、遷移金属(およびランタニドとアクチニド)の価電子の数は予測不可能な方法で変化すると言うでしょうが、価電子軌道は十分な化学的勘で予測することができることがあります。
免責事項:しかし、ランタニドとアクチニドがどの軌道が原子価であるかを予測することは一般的に困難である。
例えば、アクチニドは#5f#と#6d#軌道を#7s#軌道に非常に近いエネルギーで持っているので、原子エネルギー計算を行うときに#7s#、#6d#、および#5f#を価数空間に推測して含めることができる(#6d#軌道が空であっても)。