有機構造における一般的な結合パターン
ルイス構造を描き、原子上の形式電荷を決定するための上記の方法は、初心者の有機化学者にとって不可欠な出発点であり、小さくて単純な構造を扱うときにはかなりうまくいく。 しかし、あなたが想像できるように、これらの方法は、より大きな構造を扱い始めると、不当に退屈で時間がかかります。 例えば、以下のルイス構造(DNAを構成する4つのヌクレオシド構成要素の1つ)を描き、原子ごとに原子価電子を加算することによってすべての正式な電荷を決定するように依頼するのは非現実的です。
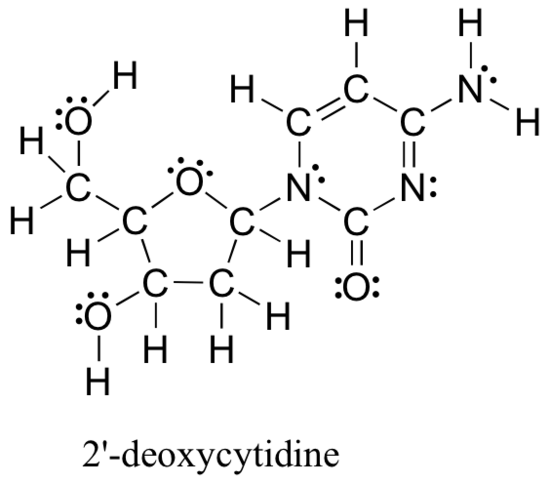
それでも、有機化学者、特に生物学的分子を扱う有機化学者として、このような大きな分子の構造を定期的に描くことがすぐに期待されます。 明らかに、あなたは迅速かつ効率的に大きな構造を描き、正式な料金を決定する能力を開発する必要があります。 幸いなことに、この能力はひどく来るのは難しいことではありません-それが取るすべては、いくつかのショートカットと共通の結合パターンを認識す
まず、有機化学者にとって最も重要な元素である炭素から始めましょう。 炭素は4価であると言われており、4つの結合を形成する傾向があることを意味します。 前のセクションの図のメタン、メタノール、エタン、エテン、エチンの単純な構造を見ると、各分子内に炭素原子が四つの結合を持ち、正式な電荷がゼロであることをすぐに認識する必要があります。
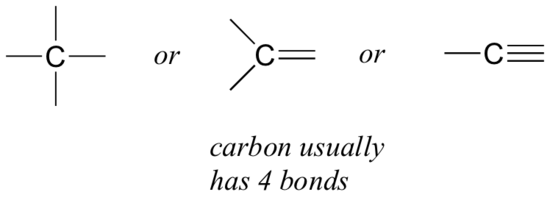
これは、私たちが見る有機分子のほとんど全体に保持するパターンですが、例外もあります。
二酸化炭素では、炭素原子は両側に酸素と二重結合を持っています(O=C=O)。 この章とこの本の後半では、炭素原子がそれぞれ正または負の正式な電荷を持つ”カルボカチオン”と”カルバニオン”と呼ばれる有機イオンの例を見ていきます。 炭素が3つの結合しかなく、満たされていない原子価殻を持っている場合(言い換えれば、オクテット則を満たさない場合)、それは正の正式な電荷を持
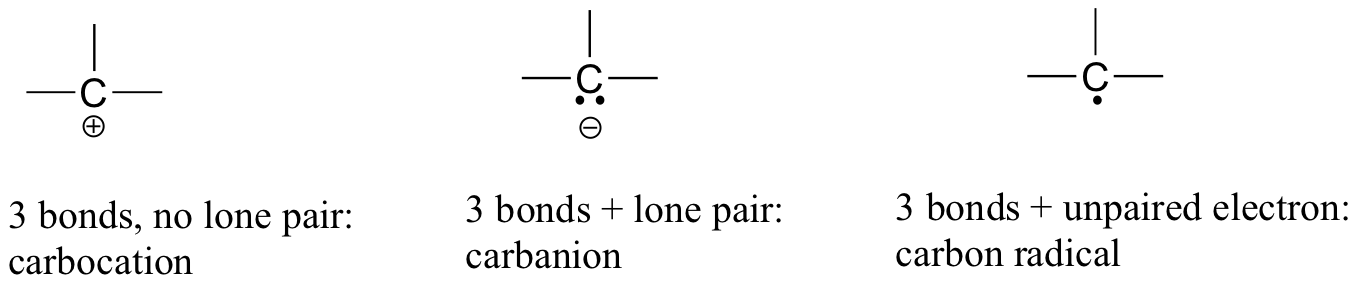
一方、それが3つの結合に孤立電子対を加えた場合、それは-1の正式な電荷を持つことになります。 別の可能性は、3つの結合と単一の不対(フリーラジカル)電子を有する炭素である:この場合、炭素はゼロの正式な電荷を有する。 (最後の1つの可能性は、炭素が2つの結合と1つの孤立電子対を持ち、それにゼロの正式な電荷を与える「カルベン」と呼ばれる反応性の高い種です。 あなたは、より高度な化学コースでカルベンに遭遇する可能性がありますが、彼らはこの本でそれ以上議論されることはありません)。
上記の例に対して、これらの正式な料金が正しいことを確認するために学んだ方法を確実に使用する必要があります。 さらに重要なのは、有機化学の研究をさらに進める前に、これらのパターン(および他の原子については後述するパターン)を認識し、迅速な検査によって正
水素のパターンは簡単です:水素原子は一つの結合しか持たず、正式な電荷はありません。 この規則の例外は、陽子H+と水素化物イオンH-であり、これは陽子に2つの電子を加えたものです。 私たちは生物に適用される有機化学にこの本に集中しているので、しかし、彼らは水溶液中でその形で存在するにはあまりにも反応性であるため、我々は、”裸の”陽子と水素化物をそのように見ることはありません。 それにもかかわらず、プロトンのアイデアは、酸-塩基化学を議論するときに非常に重要になり、水素化物イオンのアイデアは、有機酸化と還元反応を議論するときに非常に後で本の中で非常に重要になるでしょう。 しかし、原則として、有機分子中のすべての水素原子は1つの結合を持ち、正式な電荷はありません。
次は酸素原子に目を向けましょう。 通常、3つの方法で酸素結合が見られますが、これらはすべてオクテット則を満たしています。
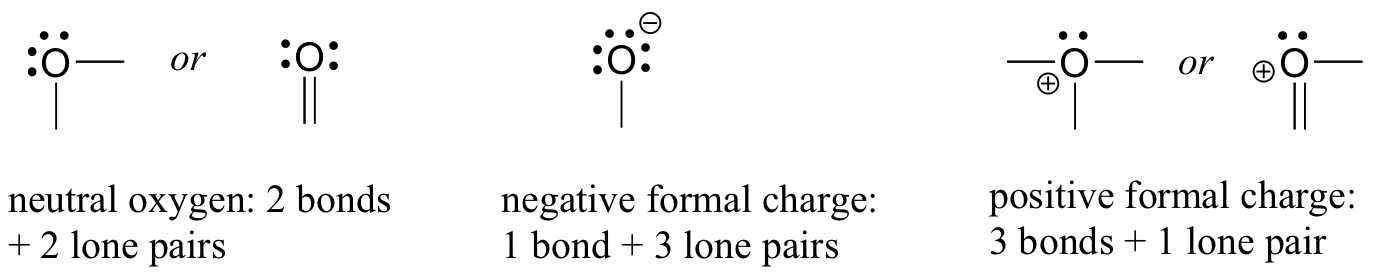
水のように2つの結合と2つの孤立したペアがある場合、正式な電荷はゼロになります。 水酸化物イオンのように、それが1つの結合と3つの孤立電子対を持っているならば、それは-1の形式的な電荷を持つでしょう。 ヒドロニウムイオンのように、3つの結合と1つの孤立電子対を持つ場合、それは+1の正式な電荷を持つことになります。
第17章でフリーラジカル化学について議論すると、酸素原子が一つの結合、一つの孤立電子対、一つの不対(フリーラジカル)電子を持ち、それにゼロの形式的な電荷を与えるなど、他の可能性があることがわかる。 しかし、今のところ、これらは第17章まで見られる事実上すべてを説明するので、三つの主要な非過激な例に集中してください。
窒素には二つの主要な結合パターンがあり、どちらもオクテット則を満たす:
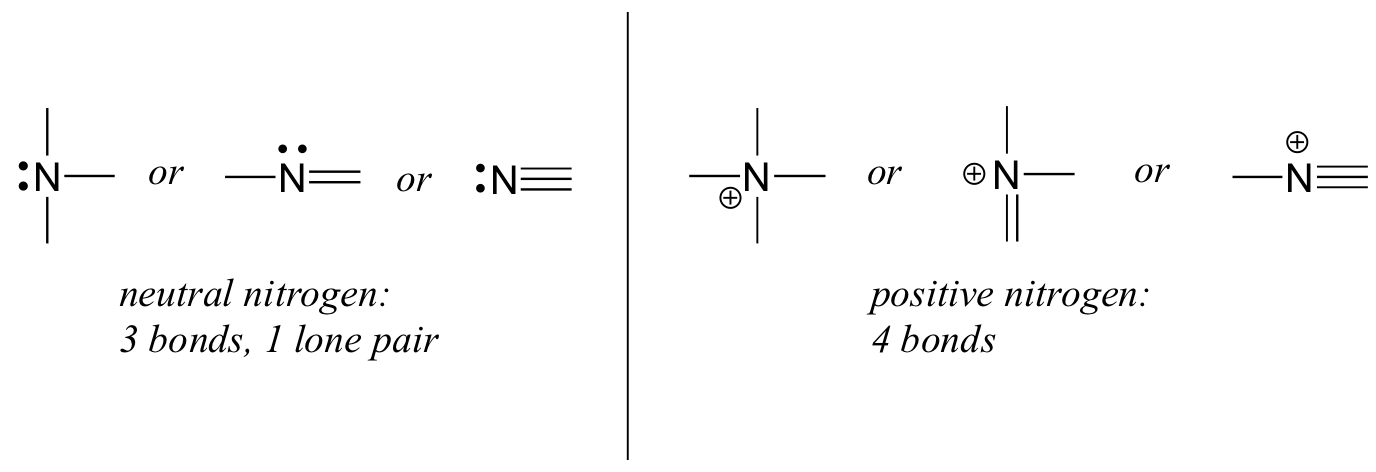
窒素が三つの結合と孤立電子対を持っている場合、それはゼロの正式な電荷を持っています。 それが4つの結合(そして孤立した対を持たない)を持っているならば、それは+1の形式的な電荷を持っています。 かなり珍しい結合パターンでは、負に帯電した窒素は二つの結合と二つの孤立電子対を有する。
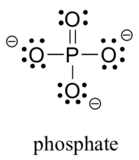
二つの第三の行の要素は、一般的に生物学的有機分子で発見されています:硫黄とリン。 これらの元素は両方とも実験室化学に関連する他の結合パターンを持っているが、生物学的な文脈では、硫黄はほとんど常に酸素と同じ結合/形式電荷パターンに従うが、リンはリン酸イオン(PO43-)の形で存在し、(ほとんど常に酸素との結合)、孤立対はなく、形式電荷はゼロである。 周期表の3行目の要素は、s軌道とp軌道と同様に価電子殻にd軌道を持ち、したがってオクテット則に束縛されないことに注意してください。
最後に、ハロゲン(フッ素、塩素、臭素、ヨウ素)は実験室や薬用有機化学では非常に重要ですが、天然に存在する有機分子ではあまり一般的ではあ 有機化合物中のハロゲンは、通常、一つの結合、三つの孤立電子対、およびゼロの正式な電荷を持つ見られています。 時には、特に臭素の場合、ハロゲンが2つの結合(通常は3員環)、2つの孤立電子対、および+1の形式電荷を有する反応性種に遭遇することがある。

これらのルールは、あなたがそれらについて考える必要さえないように学び、内面化されれば、正式な料金で完全な大きな有機構造を非常に迅速に描
ルイス構造を描くことのこつを得たら、示された形式的な電荷(またはその欠如)に一致するように各原子の周りに適切な数の電子が存在すると仮定できるので、ヘテロ原子上に孤立電子対を描くことは必ずしも必要ではない。 時折、しかし、そうすることが説明をより明確にするのに役立つならば、孤立したペアが描かれる。