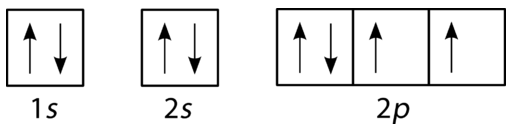
Orbital Filling Diagram
軌道充填ダイアグラムは、特定の原子内のすべての電子の配置を表現するより視覚的な方法です。 軌道充填図では、個々の軌道は円(または正方形)として表示され、サブレベル内の軌道は水平に隣同士に描画されます。 各サブレベルは、その主エネルギーレベルとサブレベルによってラベル付けされます。 電子は円の内側に矢印で示されています。 上向きの矢印は一方のスピン方向を示し、下向きの矢印はもう一方の方向を示します。 水素、ヘリウム、リチウムの軌道充填図を下の図に示します。
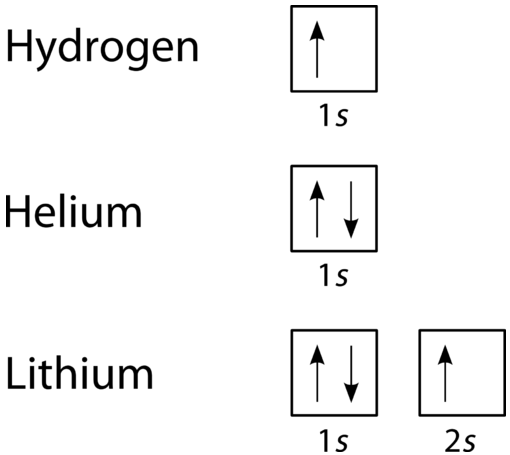
Aufbauプロセスによると、サブレベルと軌道はエネルギーが増加する順に電子で満たされています。 \(S\)サブレベルは1つの軌道で構成されているため、2番目の電子はヘリウムのように最初の電子と単純に対になります。 次の要素はリチウムであり、次の利用可能なサブレベルである\(2s\)を使用する必要があります。
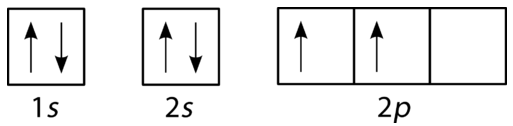
炭素の充填図を下の図に示します。 炭素には2つの\(2p\)電子があり、それぞれがそれ自身の\(2p\)軌道を占めています。
酸素は4つの\(2p\)電子を持っています。 各\(2p\)軌道に1つの電子が入った後、4番目の電子は最初の\(2p\)軌道に配置され、その軌道の他の電子とは反対のスピンを持つことができます。\(2p\)軌道は、\(2p\)軌道に配置されています。