the glucose-alanine cycle,or Cahill cycle,proposed for the first time by mallette,Exton and Park,And Felig et al. 1969年から1970年の間に、肝外組織、例えば骨格筋、アラニンとしてピルビン酸およびアミノ基を肝臓に輸出し、血流を介して肝臓からグルコースを受け取る一連のステップで構成されている。
グルコース-アラニンサイクルの主なステップを以下に要約する。
- 肝外組織ではアミノ酸がエネルギーに使用される場合、解糖に由来するピルビン酸がアミノ基受容体として使用され、非必須アミノ酸であるアラニンを形成する。
- アラニンは血流中に拡散し、肝臓に到達する。
- 肝臓では、アラニンのアミノ基がα-ケトグルタル酸に移動し、それぞれピルビン酸とグルタミン酸を形成する。
- グルタミン酸のアミノ基は主に尿素サイクルに入り、一部は多くの生合成経路で窒素供与体として作用する。
ピルビン酸は糖新生に入り、グルコース合成に使用される。 - 新たに形成されたグルコースは血流中に拡散し、末梢組織に到達し、解糖により遊離アミノ酸からアミノ基を受け入れることができるピルビン酸
したがって、グルコース-アラニンサイクルは、以下に概略的に説明するように、炭水化物とアミノ酸代謝との間のリンクを提供する。
グルコース→ピルビン酸→アラニン→ピルビン酸→グルコース
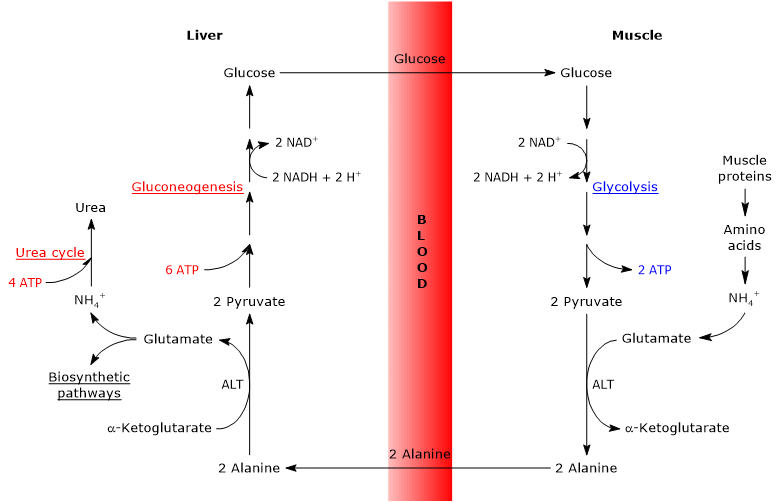
グルコースアラニンサイクルは、骨格筋、それが観察された最初の組織、および肝臓の間だけでなく、リンパ器官などの免疫系の細胞を含む他の細胞および肝外組織を含む。
内容
- グルコースアラニンサイクルのステップ
- 骨格筋におけるケーヒルサイクル
- 肝臓におけるケーヒルサイクル
- トランスアミナーゼ
- グルコースアラニンサイクルの機能
- グルコースアラニンサイクルのエネルギーコスト
- ケーヒルサイクルとコリサイクルの類似点と相違点
グルコースアラニンサイクルのステップ
グルコースアラニンサイクルのステップの分析は、骨格筋と肝臓のサイクルを考慮して行われている。
細胞内および細胞外タンパク質は、構成アミノ酸に連続的に加水分解され、再合成され、これらのプロセスが起こる速度が正確にバランスされ、無脂
しかし、激しい運動や長時間の運動や絶食などの異化条件下では、筋肉タンパク質の分解速度は合成を超えています。 これはアミノ酸の解放をもたらし、そのうちのいくつかはエネルギーに使用され、他は糖新生のために使用される。 そして、アミノ酸、特に分岐鎖アミノ酸またはBCAA(ロイシン、イソロイシンおよびバリン)の炭素骨格の酸化は、筋肉にとって重要なエネルギー源であり得る。 例えば、激しい運動の約90分後、筋肉中のアミノ酸酸化は、収縮に必要なエネルギーの10-15%を提供する。
アミノ酸の炭素骨格をエネルギーに利用するには、アミノ基の除去、次いで非毒性形態のアミノ窒素の排泄が必要である。
α-アミノ基の除去は、トランスアミノ化によって起こり、それは以下のように要約することができる:
α-ケト酸+アミノ酸⇒新しいアミノ酸+新しいα-ケト酸
アミノトランスフェラーゼまたはトランスアミナーゼ(EC2.6.1)と呼ばれる酵素によって触媒されるこのような反応は、自由に可逆的である。
分岐鎖アミノ酸は、例えば、分岐鎖アミノトランスフェラーゼまたはBCATによって触媒される反応において、α-ケトグルタル酸または2-オキソグルタル酸にアミノ基を移動させ、元のアミノ酸に由来するグルタミン酸およびα-ケト酸を形成する(EC2.6.1.42).
骨格筋のケーヒルサイクル
骨格筋では、新たに形成されたグルタミン酸はアンモニアと反応してグルタミンを形成する可能性があり、脳などの多くの組織や器官では、窒素の臓器間輸送の主要な手段である。 この反応は細胞質酵素グルタミン合成酵素(EC6.3.1.2)によって触媒され、ATPを消費する。
グルタミン酸+NH4++ATP→グルタミン+ADP+Pi
この場合、グルタミン酸はケーヒルサイクルを離れる。
あるいは、他の組織の大部分で起こるのとは対照的に、新たに形成されたグルタミン酸は、アミノ基を解糖に由来するピルビン酸に移し、アラニンおよびα-ケトグルタル酸を形成する可能性がある。 このトランスアミノ化は、ほとんどの動物および植物組織に見られる酵素であるアラニンアミノトランスフェラーゼまたはALT(EC2.6.1.2)によって触媒される。
グルタミン酸+ピルビン酸塩⇒アラニン+α-ケトグルタル酸
アラニンはタンパク質分解から直接生成され、筋肉タンパク質はアラニンが豊富で、細胞を離れて血流によって肝臓に運ばれることがあり、このようにしてアミノ基は肝臓に到達する。 また,ピルビン酸のトランスアミノ化によって形成されたアラニンが循環中に移動する速度は細胞内ピルビン酸産生に比例する。
注:アラニンおよびグルタミンは、器官間アミノ酸代謝における窒素および炭素の主要な供給源である。
肝臓のケーヒルサイクル
肝臓に入ると、肝臓のアラニンアミノトランスフェラーゼがトランスアミノ化を触媒し、主要なグルコノゲンアミノ酸であるアラニンがアミノ基供与体として作用し、α-ケトグルタル酸がα-ケト酸受容体として作用する。 反応の生成物はピルビン酸、すなわちアラニンの炭素骨格、およびグルタミン酸である。
アラニン+α-ケトグルタル酸Γグルタミン酸+ピルビン酸
グルタミン酸、グルタミン酸デヒドロゲナーゼ(EC1.4.1.2)、ミトコンドリアマトリックスに存在する酵素は、尿素サイクルに入るアンモニウムイオンを形成し、クレブスサイクルに入ることができるα-ケトグルタル酸を形成する。 この反応は、アミノ酸代謝とクレブス周期を結びつけるアナプレロチン反応である。
グルタミン酸+H2O+NAD+γ α-ケトグルタル酸+NH4++NADH+H+
しかし、グルタミン酸はまた、アスパラギン酸アミノトランスフェラーゼ(EC2.6.1.1)によって触媒される反応で、オキサロ酢酸と反応してアスパラギン酸およびα-ケトグルタル酸を形成することができる。 アスパラギン酸塩は、尿素の形成だけでなく、プリンおよびピリミジンの合成にも関与している。
グルタミン酸+Oxaloacetate≤Aspartate+α-Ketoglutarate
また作り出されるピルビン酸塩は異なった新陳代謝の運命があるかもしれません:それはATPの生産のために酸化させ、次にブドウ糖-アラニン周期を去るか、または糖新生の細道を書き入れ、こうして周期で続けることができます。
生成されたグルコースは肝臓から血流に放出され、それを必要とする様々な組織、骨格筋に送達され、ピルビン酸塩合成に使用される。 次に、新たに形成されたピルビン酸はグルタミン酸と反応し、サイクルを閉じることができる。
トランスアミナーゼ
前述のように、アミノ酸からのアミノ基の除去は、トランスアミノ化によって起こる(一般的な反応については上記を参照)。 これらの反応は、アミノトランスフェラーゼまたはトランスアミナーゼと呼ばれる酵素によって触媒される。
これらは細胞質酵素であり、すべての細胞に存在し、特に肝臓、腎臓、腸および筋肉に豊富であり、活性部位に緊密に結合した補酵素として、ビタミンB6
トランスアミノ化反応では、スレオニンとリジンを除く遊離アミノ酸のアミノ基は、ピルビン酸、オキサロ酢酸およびα-ケトグルタル酸を中心とする少数のα-ケト酸に向かってチャネル化される。
細胞には異なる種類のアミノトランスフェラーゼが含まれており、多くはα-ケト酸受容体としてα-ケトグルタル酸に特異的であるが、アミノ酸に特異性が異なっており、そこから命名された。 例としては、前述のアラニンアミノトランスフェラーゼ、アラニントランスアミナーゼおよびグルタミン酸ピルビン酸トランスフェラーゼまたはGPTとも呼ばれる、アスパラギン酸アミノトランスフェラーゼまたはAST、また、グルタミン酸オキサロ酢酸トランスアミナーゼまたはGOTとも呼ばれる。
α-ケト酸受容体がアミノ化され、アミノ酸がアミノ化されるので、これらの反応には正味の脱アミノ化はなく、アミノ基の損失もないことを強調すべきである。
グルコースアラニンサイクルの機能
このサイクルには様々な機能があります。
- 窒素を非毒性の形態で末梢組織から肝臓に輸送します。
- 糖新生基質であるピルビン酸塩を肝臓に輸送する。
- 末梢組織からピルビン酸を除去します。 これはこれらのティッシュのブドウ糖からのATPのより高い生産をもたらします。 実際、解糖の間に作り出されるNADHはmitochondriaに入り、酸化リン酸化によって酸化することができます。
- これは、タンパク質の分解を阻害するのに十分な肝細胞中のアラニンの比較的高濃度を維持することができます。
- 感染症に対する宿主防御の役割を果たしている可能性がある。
最後に、グルコース-アラニンサイクルにはグルコースの正味の合成がないことを強調することが重要です。
グルコース-アラニンサイクルのエネルギーコスト
Coriサイクルと同様に、グルコース-アラニンサイクルも3-5ATPに等しいエネルギーコストを有する。
末梢組織で起こるサイクルの一部は、グルコースの分子あたり5-7ATPの産生を伴う:
- 2 ATPは解糖によって産生され、
- 3-5ATPはNADH/FADH2から誘導される(下記参照)。
代わりに肝臓では、糖新生と尿素サイクルは10ATPを要します:
- 6 ATPは合成されたグルコースの分子あたりの糖新生の間に消費されます;
- 4ATPは合成された尿素の分子あたりの尿素サイクルで消費されます。
グルコース-アラニンサイクルは、Coriサイクルと同様に、代謝負荷の一部を肝外組織から肝臓にシフトさせる。 しかし、肝臓によって支払われたエネルギーコストは、特定の条件では、肝外組織(特に骨格筋)におけるタンパク質の効率的な分解を可能にし、肝外組織におけるエネルギーのためのアミノ酸の使用だけでなく、糖新生基質を得ることを可能にするので、サイクルが全身にもたらす利点によって正当化される。
ケーヒルサイクルとコリサイクルの類似点と相違点
2つのサイクルの間にはいくつかの類似点があり、以下に列挙する。
- ピルビン酸がグルコースに変換され、単糖が肝外組織に輸送され、解糖経路を介して再びピルビン酸に変換されると、ケーヒルサイクルは部分的にコリ
- 糖新生経路への参入は、アラニンと乳酸の両方がピルビン酸に変換されるという二つのサイクルで類似している。
- Coriサイクルのように、グルコース-アラニンサイクルは、個々の細胞内で起こる解糖、クレブスサイクルまたは糖新生などの代謝経路とは異なり、異なる細胞
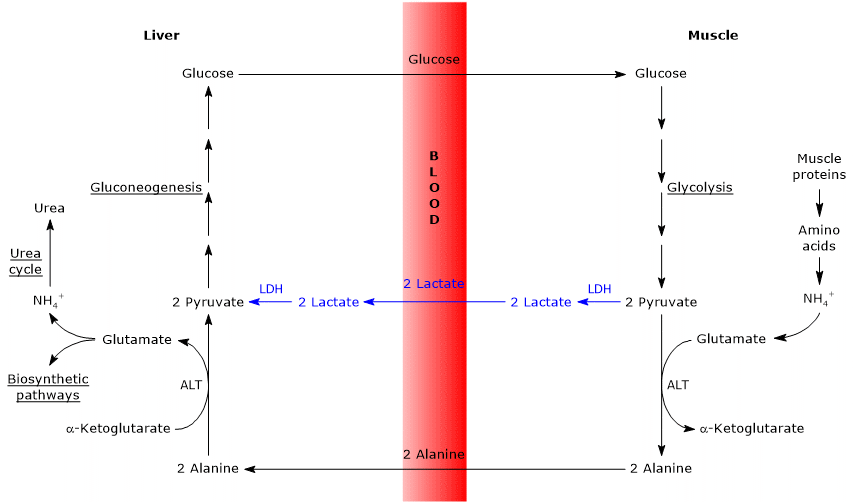
以下、二つのサイクルの間にいくつかの違いがある。
- 主な違いは、末梢組織から肝臓に到達する三つの炭素中間体に関係しています: Cori周期の乳酸塩、およびブドウ糖アラニン周期のアラニン。
- 別の違いは、末梢組織における解糖によって産生されるNADHの運命に関するものである。
コリサイクルでは、補酵素は乳酸デヒドロゲナーゼ(EC1.1.1.27)によって触媒される反応において、ピルビン酸を乳酸に還元する還元剤として作用する。
グルコース-アラニンサイクルでは、この還元は起こらず、NADHの電子はリンゴ酸-アスパラギン酸およびグリセロール3-リン酸シャトルを介してミトコンドリアに輸送され、最初のシャトルであるNADHと他のシャトルであるFADH2が生成される。 そして、NADHおよびFADH2からのATPの収率は、それぞれ2.5および1.5である。 - 最後に、前の点から、コーリサイクルとは異なり、ケーヒルサイクルは末梢組織に酸素とミトコンドリアの存在を必要とすることが明らかである。
Berg J.M.,Tymoczko J.L.,And Stryer L.Biochemistry. 第5版。 W.H.Freeman and Company,2002
Felig P.,Pozefsk T.,Marlis E.,Cahill G.F.Alanine:key role in gluconeogenesis. Science1 9 7 0;1 6 7(3 9 2 0):1 0 0 3−4. 土井:10.1126/科学。167.3920.1003
Gropper S.S.,Smith J.L.,Groff J.L. 高度の栄養物および人間の新陳代謝。 Cengage Learning,2009
Lecker S.H.,Goldberg A.L.and Mitch W.E.正常および疾患状態におけるユビキチン–プロテアソーム経路によるタンパク質分解。 J Am Soc Nephrol2006;17(7):1807-19. ドイ:10.1681/ASN.2006010083
Mallette L.E.、Exton J.H.、およびPark C.R.灌流ラット肝臓におけるアミノ酸からの糖新生の制御。 J Biol Chem1 9 6 9;2 4 4(2 0):5 7 1 3−2 3.
ネルソンD.L.、コックスM.M.Lehninger。 生化学の原理。 第6版。 W.H.Freeman and Company,2012
Raju S.M.,Madala B. 医療生化学を説明した。 Jaypee Brothers Publishers,2005
Wu G.Amino acids:biochemistry and nutrition. CRCプレス,2013