말렛,엑스톤 및 박,및 펠릭 등에 의해 처음으로 제안된 글루코오스-알라닌 주기,또는 케이힐 주기. 1969 년과 1970 년 사이에 간외 조직(예:골격근)이 피루 베이트 및 아미노 그룹을 알라닌으로 간으로 내보내고 혈류를 통해 간에서 포도당을받는 일련의 단계로 구성됩니다.
포도당-알라닌 사이클의 주요 단계가 아래에 요약되어 있습니다.
- 간외 조직에서 아미노산이 에너지에 사용될 때,해당 과정에서 유래 된 피루 베이트는 아미노기 수용체로 사용되어 비 필수 아미노산 인 알라닌을 형성합니다.
- 알라닌은 혈류로 확산되어 간에 도달합니다.
- 간에서 알라닌의 아미노 그룹은 각각 피루 베이트 및 글루타메이트를 형성하기 위해 제 2-케 토글 루타 레이트로 옮겨진다.
- 글루타메이트의 아미노 그룹은 대부분 우레아 사이클에 들어가고 부분적으로 많은 생합성 경로에서 질소 공여체 역할을합니다.
피루 베이트는 포도당 생성에 들어가 포도당 합성에 사용됩니다. - 새로 형성된 포도당은 혈류로 확산되어 말초 조직에 도달하여 해당 과정으로 인해 유리 아미노산으로부터 아미노기를 받아 들일 수있는 피루 베이트로 전환되어 사이클을 닫습니다.
따라서,글루코오스-알라닌 사이클은 아래에 개략적으로 설명된 바와 같이 탄수화물과 아미노산 대사 사이의 연관성을 제공한다.
포도당 피루브산 피루브산 피루브산 피루브산 피루브산 피루브산 피루브산 피루브산 피루브산 피루브산
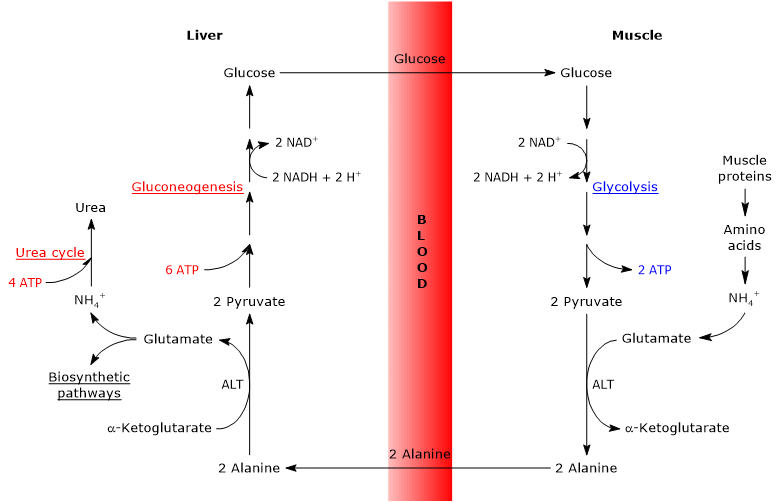
글루코오스-알라닌 순환은 골격근,관찰된 첫 번째 조직 및 간 사이뿐만 아니라 림프 기관과 같은 면역계의 세포를 포함한 다른 세포 및 간외 조직을 포함한다.
내용
- 글루코오스-알라닌 사이클의 단계
- 골격근에서의 케이힐 사이클
- 간에서의 케이힐 사이클
- 트랜스아미나제
- 포도당-알라닌 순환의 기능
- 포도당-알라닌 순환의 에너지 비용
- 케이힐 순환과 코리 순환의 유사점과 차이점
포도당-알라닌 순환의 단계
포도당-알라닌 순환의 단계 분석은 골격근과 간 사이의 순환을 고려하여 이루어진다.
세포내 단백질과 세포외 단백질은 모두 구성 아미노산으로 연속적으로 가수분해되어 재합성되며,이러한 과정이 일어나는 속도는 정확하게 균형을 이루어 무 지방 질량의 손실을 방지한다.
그러나 강렬하고 장기간의 운동 또는 금식과 같은 이화 작용 조건 하에서 근육 단백질 분해 속도는 합성을 초과합니다. 이것은 아미노산의 해방으로 이어지며,그 중 일부는 에너지를 위해 사용되고 다른 일부는 포도당 생성을 위해 사용됩니다. 그리고 아미노산,특히 분지 사슬 아미노산 또는 발린(류신,이소류신 및 발린)의 탄소 골격의 산화는 근육에 중요한 에너지 원이 될 수 있습니다. 예를 들면,격렬한 운동의 대략 90 분 후에,근육에 있는 아미노산 산화는 수축에 필요로 한 에너지의 10-15%를 제공합니다.
에너지를 위한 아미노산의 탄소 골격의 이용은 비독성 모양에 있는 아미노 질소의 아미노 그룹의 제거 및 그 후에 배설물을 관련시킵니다.
이러한 반응은 아미노 전이 효소 또는 트랜스 아미나 제(적능력 2.6.1)라고 불리는 효소에 의해 촉매되는 자유롭게 가역적이다.
분지쇄 아미노산은,예를 들어,아미노기를 케토글루타레이트 또는 2-옥소글루타르산으로 전달하여,글루타메이트를 형성하고,분지쇄 아미노 트랜스퍼라제 또는 비캣에 의해 촉매되는 반응에서 원래의 아미노산으로부터 유래된 케토산을 형성한다(적능력 2.6.1.42).
골격근의 케이힐 사이클
골격근에서 새로 형성된 글루타메이트는 암모니아와 반응하여 질소의 기관 간 수송을위한 주요 차량 인 뇌와 같은 많은 조직과 기관에 대해 글루타민을 형성 할 수 있습니다. 이 반응은 세포질 효소 글루타민 합성 효소(적능력 6.3.1.2)에 의해 촉매되고,세포질 효소를 소비한다.이 경우,글루타메이트는 케이힐 사이클을 떠난다.
대안으로,그리고 대부분의 다른 조직에서 일어나는 것과는 대조적으로,새로 형성된 글루타메이트는 아미노 그룹을 해당 작용으로부터 유래 된 피루 베이트로 전달하여 알라닌 및 제 2-케 토글 루타 레이트를 형성 할 수있다. 이 트랜스 아민은 대부분의 동물 및 식물 조직에서 발견되는 효소 인 알라닌 아미노 전이 효소 또는 알트(적능력 2.6.1.2)에 의해 촉매됩니다.
글루타메이트+피루 베이트 알라닌+케토 글루 타 레이트
생성 된 알라닌과 단백질 분해에서 직접 파생 된 근육 단백질은 알라닌이 풍부하여 세포를 떠나 혈류에 의해 간으로 운반 될 수 있습니다.이 방법으로 아미노 그룹은 간에 도달합니다. 그리고 피루 베이트의 트랜스 아미 네이션에 의해 형성된 알라닌이 순환으로 전달되는 속도는 세포 내 피루 베이트 생산에 비례합니다.
참고:알라닌과 글루타민은 인터 오르간 아미노산 대사에서 질소와 탄소의 주요 공급원입니다.
간에서의 케이힐 사이클
간에서 일단,간 알라닌 아미노 전이 효소는 주요 글루코 네오 제닉 아미노산 인 알라닌이 아미노기 공여체로서 작용하고,케토 글루 타 레이트가 케토 산 수용체로서 작용하는 트랜스 아민을 촉매한다. 반응의 생성물은 피루 베이트,즉 알라닌의 탄소 골격 및 글루타메이트이다.
알라닌+케토글루타레이트 글루타메이트+피루베이트
글루타메이트,글루타메이트 탈수소 효소에 의해 촉매되는 반응에서(적능력 1.4.1.미토콘드리아 매트릭스에 존재하는 효소 인 2)는 우레아 사이클에 들어가는 암모늄 이온을 형성하고,크렙스 사이클에 들어갈 수있는 케토 글루 타 레이트를 형성한다. 이 반응은 아미노산 대사와 크렙스 사이클을 연결하는 아나 페로 틱 반응입니다.그러나,글루타메이트는 또한 옥살로 아세테이트와 반응하여 아스파테이트 및 아스파테이트-케토글루타레이트를 형성할 수 있는데,이는 아스파테이트 아미노 트랜스퍼라제에 의해 촉매되는 반응이다(적능력 2.6.1.1). 아스파 테이트는 우레아의 형성뿐만 아니라 퓨린 및 피리 미딘의 합성에 관여한다.
글루타메이트+옥살로 아세테이트 아스파 테이트+케토 글루 타 레이트
또한 생성 된 피루 베이트는 다른 대사 운명을 가질 수있다:그것은 포도당-알라닌 순환을 위해 산화 될 수 있고,그 다음 포도당-알라닌 순환을 떠나거나,글루코 네오 생성 경로를 입력하고,따라서 사이클에서 계속된다.
생산 된 포도당은 간에서 혈류로 방출되어 골격근으로서 피루 베이트 합성에 사용되는 다양한 조직으로 전달됩니다. 차례로,새로 형성된 피루 베이트는 글루타메이트와 반응하여주기를 닫을 수 있습니다.
트랜스아미나제
앞서 언급한 바와 같이,아미노산으로부터의 아미노기의 제거는 트랜스아미네이션을 통해 일어난다(일반적인 반응에 대해서는 위 참조). 이러한 반응은 아미노 전이 효소 또는 트랜스 아미나 제라고 불리는 효소에 의해 촉매됩니다.
이들은 세포질 효소이며,모든 세포에 존재하며 특히 간,신장,내장 및 근육에 풍부합니다.
트랜스아민화 반응에서,트레오닌과 라이신을 제외한 유리 아미노산의 아미노기는,소수의-케토산,특히 피루브산,옥살로아세테이트 및-케토글루타레이트로 표출된다.
세포에 이르기까지 다양한 유형의 aminotransferases:많은 관련 서비스를 개발했습니다 α-케 토글 루타 레이트로 α-keto acid 수락자,하지만에 차이가 특이성을 위해 아미노산,그들이 지정됩니다. 예 앞서 언급한 알라닌 아미노이라고도 알라닌 transaminase 및 글루타민 피루브 전이 또는 GPT 및 aspartate aminotransferase 또는 AST,또한 글루타민산-여기 활성 아세트 transaminase 또는 얻었다.
이러한 반응에는 순 탈아미네이션이 없고,아미노기의 손실이 없으며,케토산 수용체가 아미네이션되고 아미노산이 탈아미네이션되기 때문이다.
글루코오스-알라닌 사이클의 기능
이 사이클은 다양한 기능을 갖는다.
- 그것은 말초 조직에서 간으로 비 독성 형태로 질소를 운반합니다.
- 그것은 글루코 네오 제닉 기질 인 피루 베이트를 간으로 운반합니다.
- 말초 조직에서 피루 베이트를 제거합니다. 이것은 이 조직에 있는 포도당에서에 대한 포도당의 더 높은 생산으로 이끌어 냅니다. 사실,해당 과정 동안 생성 된 나드는 미토콘드리아로 들어가서 산화 적 인산화를 통해 산화 될 수 있습니다.
- 단백질 분해를 억제하기에 충분한 간세포에서 상대적으로 높은 농도의 알라닌을 유지할 수 있습니다.
- 전염병에 대한 숙주 방어에 역할을 할 수 있습니다.
마지막으로,포도당-알라닌 사이클에서 포도당의 순 합성이 없다는 것을 강조하는 것이 중요합니다.
글루코오스-알라닌 사이클의 에너지 비용
코리 사이클과 마찬가지로 글루코오스-알라닌 사이클도 3-5 회 에너지 비용을 갖는다.
주변 조직에서 일어나는 주기의 부분은 포도당의 분자 당 5-7 의 탄산수소의 생산을 관련시킵니다:
- 2 그 결과,그 결과,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질,화학 물질.
대신 간에서,글루코 네오 생성 및 요소 사이클 비용 10:
- 6
- 4 합성된 우레아 분자당 우레아 사이클에서 소비된다.
포도당-알라닌주기는 코리주기와 마찬가지로 대사 부담의 일부를 간외 조직에서 간으로 이동시킵니다. 그러나 간에서 지불하는 에너지 비용은 특정 조건에서 간외 조직(특히 골격근)에서 단백질의 효율적인 분해를 허용하기 때문에주기가 몸 전체에 가져 오는 이점에 의해 정당화되며,이는 간외 조직에서의 에너지를위한 아미노산의 사용뿐만 아니라 글루코 네오 제닉 기질을 얻을 수있게합니다.
케이힐 사이클과 코리 사이클의 유사점과 차이점
두 사이클 사이에는 몇 가지 유사점이 있으며,아래에 나와 있습니다.
- 피루브산이 포도당으로 전환되고 단당류가 간외 조직으로 운반될 때 케이힐 주기는 코리 주기와 부분적으로 겹쳐지며,이 주기에서 해당 경로를 통해 다시 피루브산으로 전환된다.
- 글루코 네오 생성 경로로의 진입은 두 사이클에 대해 유사하다:알라닌과 락 테이트는 모두 피루 베이트로 전환된다.
- 코리주기와 마찬가지로 포도당-알라닌주기는 개별 세포 내에서 발생하는 해당 과정,크렙스 순환 또는 포도당 생성과 같은 대사 경로와 달리 다른 세포 유형 사이에서 발생합니다
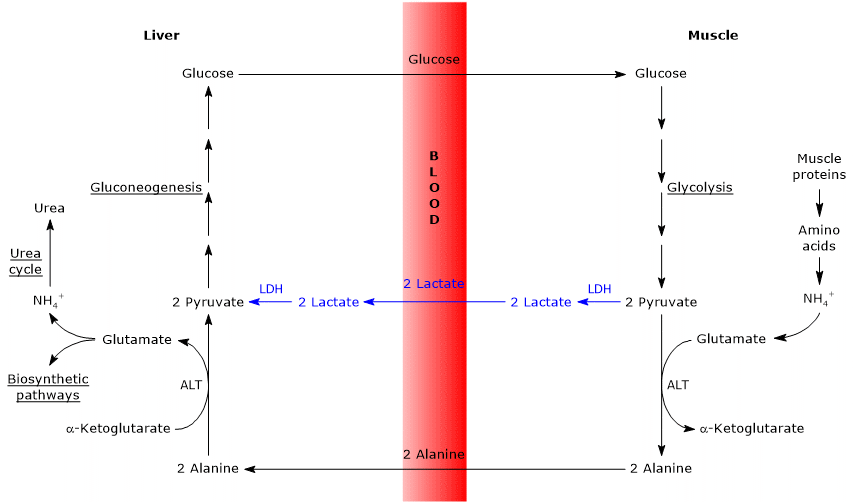
이하에서는 두 사이클 사이의 약간의 차이가 있다.
- 주요 차이점은 말초 조직에서 간에 도달하는 3 개의 탄소 중간체에 관한 것이다.: 코리 사이클의 젖산,포도당-알라닌 사이클의 알라닌.
- 또 다른 차이점은 말초 조직에서 해당 과정에 의해 생성 된 나드의 운명에 관한 것이다.
코리 사이클에서,보효소는 젖산 탈수소 효소에 의해 촉매되는 반응에서 젖산으로의 피루 베이트를 감소시키는 환원제로서 작용한다(적능력 1.1.1.27).
글루코오스-알라닌 사이클에서,이 감소는 일어나지 않으며,나드의 전자는 말 레이트-아스파 테이트 및 글리세롤 3-포스페이트 셔틀을 통해 미토콘드리아로 운반되어 첫 번째 셔틀 인 나드와 다른 셔틀 인 파드 2 를 생성 할 수있다. 그 결과,이 수치는 2.5 와 1.5 입니다. - 마지막으로,이전 시점에서,코리 사이클과 달리 케이힐 사이클은 말초 조직에 산소와 미토콘드리아의 존재를 필요로한다는 것이 분명하다.1990 년대 초반부터 1990 년대 초반까지,1990 년대 초반부터 1990 년대 초반까지,1990 년대 초반까지,1990 년대 초반까지,1990 년대 초반까지,1990 년대 초반까지,1990 년대 초반까지. 5 판. 2002 년
과학 1970;167(3920):1003-4. 도이:10.1126/과학.167.3920.1003
진보된 영양 및 인간적인 물질 대사. 이 연구에서는 유비퀴틴–프로테아좀 경로에 의한 단백질 분해가 정상 및 질병 상태에서의 유비퀴틴-프로테아 좀 경로에 의한 것으로 나타났다. 2006;17(7):1807-19. 도이:10.1681/아씨.2006010083
말렛 엘이,엑톤 제이 에이치,및 박씨 알 관류 된 쥐 간에서 아미노산으로부터의 글루코 네오 제네시스 제어. 1969;244(20):5713-23.
넬슨 디 엘.,콕스 엠.엠.레 닝거. 생화학 원리. 6 판. 2012 년
라주 에스엠,마달라 비 일러스트 의료 생화학. 2005 년
우 지.아미노산:생화학 및 영양. 2013