Vanlige bonding mønstre i organiske strukturer
metodene anmeldt ovenfor for å tegne Lewis strukturer og bestemme formelle kostnader på atomer er et viktig utgangspunkt for en nybegynner organisk kjemiker, og arbeidet ganske vilje når du arbeider med små, enkle strukturer. Men som du kan forestille deg, blir disse metodene urimelig kjedelige og tidkrevende når du begynner å håndtere større strukturer. Det ville være urealistisk, for eksempel å be Deg om å tegne Lewis-strukturen nedenfor (av en av DE fire nukleosidbyggeblokkene SOM utgjør DNA) og bestemme alle formelle ladninger ved å legge opp valenselektronene på et atom-for-atom basis.
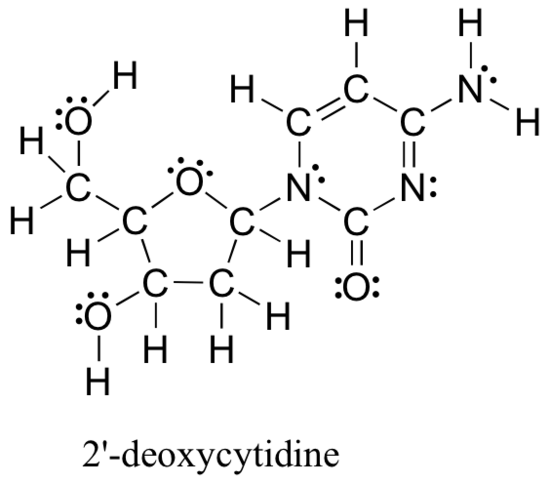
og likevel, som organiske kjemikere, og spesielt som organiske kjemikere som arbeider med biologiske molekyler, forventes du snart å tegne strukturen til store molekyler som dette med jevne mellomrom. Det er klart at du må utvikle evnen til raskt og effektivt å tegne store strukturer og bestemme formelle kostnader. Heldigvis er denne evnen ikke veldig vanskelig å komme forbi-alt som trengs er noen snarveier og litt øvelse på å gjenkjenne vanlige bindingsmønstre.
la oss starte med karbon, det viktigste elementet for organiske kjemikere. Karbon sies å være tetravalent, noe som betyr at det har en tendens til å danne fire bindinger. Hvis du ser på de enkle strukturer av metan, metanol, etan, eten og etyn i figurene fra forrige avsnitt, bør du raskt gjenkjenne at i hvert molekyl har karbonatomet fire bindinger og en formell ladning på null.
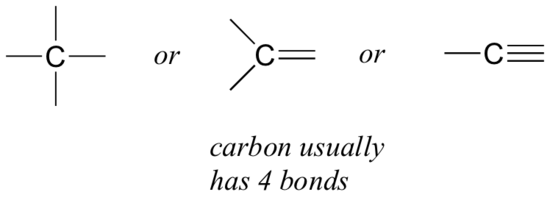
dette er et mønster som holder gjennom de fleste organiske molekylene vi vil se, men det er også unntak.
i karbondioksid har karbonatomet dobbeltbindinger til oksygen på begge sider (O=C=O). Senere i dette kapitlet og gjennom denne boken vil vi se eksempler på organiske ioner kalt ‘carbocations’ og carbanions’, der et karbonatom bærer en positiv eller negativ formell ladning, henholdsvis. Hvis et karbon bare har tre bindinger og et ufylt valensskall (med andre ord, hvis det ikke oppfyller oktettregelen), vil det ha en positiv formell ladning.
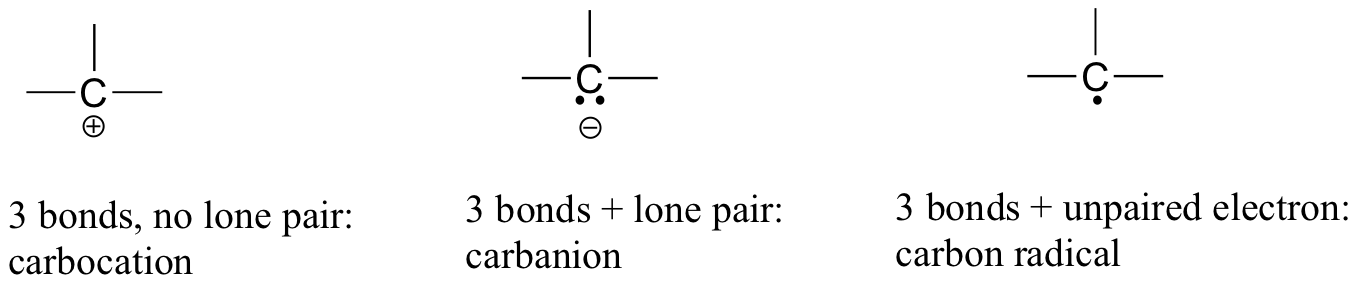
hvis den derimot har tre obligasjoner pluss et ensomt par elektroner, vil det ha en formell ladning på -1. En annen mulighet er et karbon med tre bindinger og en enkelt, uparget (fri radikal) elektron: i dette tilfellet har karbonet en formell ladning på null. (En siste mulighet er en svært reaktiv art kalt en karben, hvor et karbon har to bindinger og ett lone par elektroner, noe som gir det en formell ladning på null. Du kan støte på karbener i mer avanserte kjemi kurs, men de vil ikke bli diskutert videre i denne boken).
du bør absolutt bruke metodene du har lært for å sjekke at disse formelle kostnadene er riktige for eksemplene gitt ovenfor. Enda viktigere, du trenger, før du går mye lenger i studiet av organisk kjemi, å bare gjenkjenne disse mønstrene (og mønstrene beskrevet nedenfor for andre atomer) og kunne identifisere karboner som bærer positive og negative formelle kostnader ved en rask inspeksjon.
mønsteret for hydrogen er enkelt: hydrogenatomer har bare en binding, og ingen formell ladning. Unntakene fra denne regelen er proton, H+ og hydrid ion, H -, som er et proton pluss to elektroner. Fordi vi konsentrerer oss i denne boken om organisk kjemi som brukes på levende ting, vil vi imidlertid ikke se ‘nakne’ protoner og hydrider som sådan, fordi de er for reaktive til å være til stede i den formen i vandig løsning. Ikke desto mindre vil ideen om et proton være svært viktig når vi diskuterer syrebasekjemi, og ideen om et hydrid-ion vil bli svært viktig mye senere i boken når vi diskuterer organiske oksidasjons-og reduksjonsreaksjoner. Som regel har alle hydrogenatomer i organiske molekyler en binding, og ingen formell ladning.
La oss neste tur til oksygenatomer. Vanligvis vil du se en oksygenbinding på tre måter, som alle oppfyller oktettregelen.
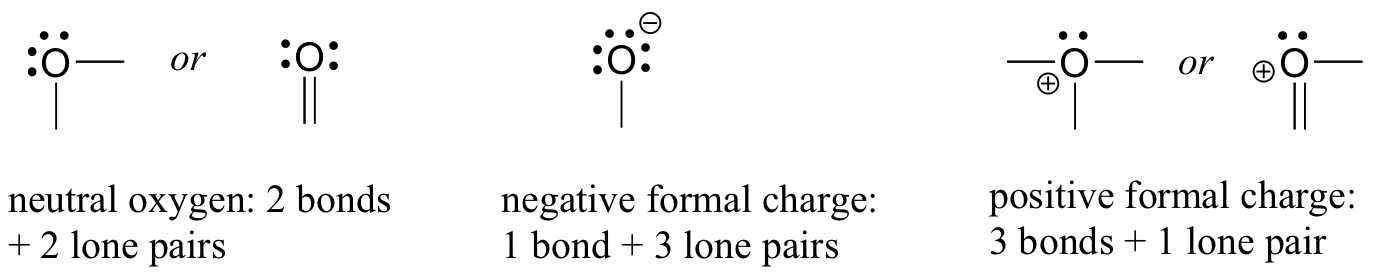
hvis den har to bindinger og to ensomme par, som i vann, vil den ha en formell ladning på null. Hvis den har en binding og tre ensomme par, som i hydroksidion, vil den ha en formell ladning på-1. Hvis den har tre bindinger og ett enkelt par, som i hydroniumion, vil den ha en formell ladning på + 1.
Når vi kommer til vår diskusjon om fri radikal kjemi i kapittel 17, vil vi se andre muligheter, for eksempel hvor et oksygenatom har en binding, et ensomt par og en uparget (fri radikal) elektron, noe som gir den en formell ladning på null. For nå, derimot, konsentrere seg om de tre viktigste ikke-radikale eksempler, da disse vil stå for nesten alt vi ser før kapittel 17.
Nitrogen har to store bindingsmønstre, som begge oppfyller oktettregelen:
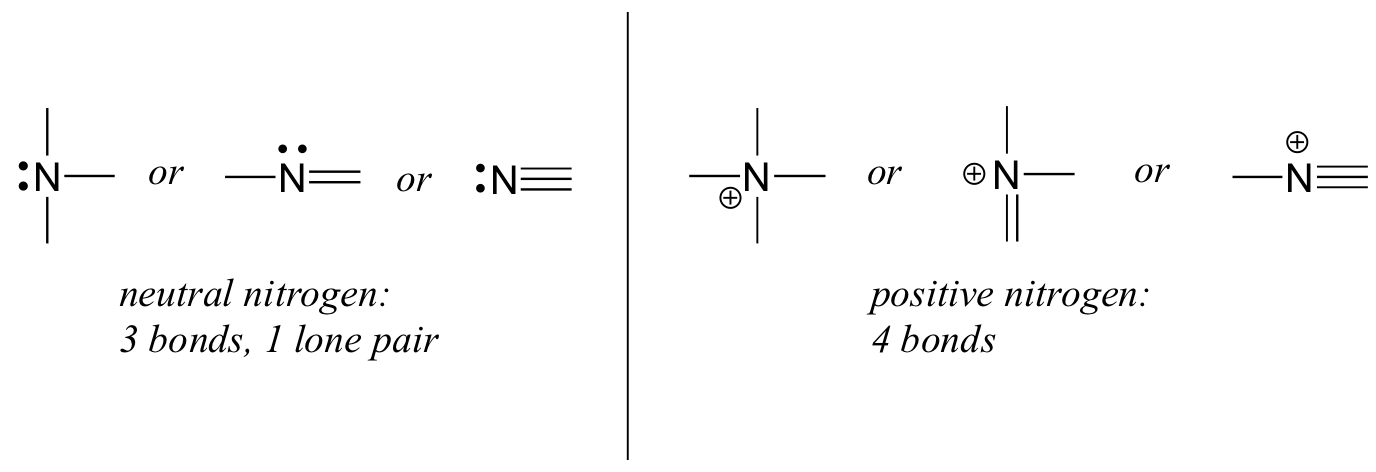
hvis et nitrogen har tre bindinger og et enkelt par, har det en formell ladning på null. Hvis den har fire obligasjoner( og ingen enslige par), har den en formell kostnad på + 1. I et ganske uvanlig bindingsmønster har negativt ladet nitrogen to bindinger og to ensomme par.
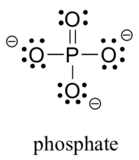
To tredje radelementer finnes ofte i biologiske organiske molekyler: svovel og fosfor. Selv om begge disse elementene har andre bindingsmønstre som er relevante i laboratoriekjemi, følger svovel i en biologisk sammenheng nesten alltid det samme bindingsmønsteret som oksygen, mens fosfor er tilstede i form AV fosfation (PO43 -), hvor det har fem bindinger (nesten alltid til oksygen), ingen ensomme par og en formell ladning på null. Husk at elementer i den tredje raden i det periodiske bordet har d-orbitaler i deres valensskall samt s-og p-orbitaler, og dermed ikke er bundet av oktettregelen.
Endelig er halogenene (fluor, klor, brom og jod) svært viktige i laboratorie-og medisinsk organisk kjemi, men mindre vanlige i naturlig forekommende organiske molekyler. Halogener i organiske forbindelser ses vanligvis med en binding, tre ensomme par og en formell ladning på null. Noen ganger, spesielt når det gjelder brom, vil vi møte reaktive arter der halogenet har to bindinger( vanligvis i en tre-ledd ring), to ensomme par og en formell ladning på +1.

disse reglene, hvis lært og internalisert slik at du ikke engang trenger å tenke på dem, vil tillate deg å tegne store organiske strukturer, komplett med formelle kostnader, ganske raskt.
Når Du Har fått tak i å tegne Lewis-strukturer, er det ikke alltid nødvendig å tegne ensomme par på heteroatomer, da du kan anta at riktig antall elektroner er tilstede rundt hvert atom for å matche den angitte formelle ladningen (eller mangelen derav). Av og til, selv om, ensomme par trekkes hvis du gjør det bidrar til å gjøre en forklaring mer tydelig.