Reaksjonshastigheter
Variasjon av priser når du endrer halogen
Reaksjonshastigheter øker i rekkefølgen HF-HCl-HBr-HI. Hydrogenfluorid reagerer mye langsommere enn de andre tre, og blir normalt ignorert i å snakke om disse reaksjonene.
når hydrogenhalogenidene reagerer med alkener, må hydrogen-halogenbindingen brytes. Bindingsstyrken faller når DU går FRA HF TIL HI, og hydrogen-fluorbindingen er spesielt sterk. Fordi det er vanskelig å bryte bindingen mellom hydrogen og fluor, er tilsetningen AV HF bundet til å være sakte.
Variasjon av priser når du endrer alken
dette gjelder både usymmetriske alkener og symmetriske. For enkelhet eksemplene nedenfor er alle symmetriske seg – men de trenger ikke å være.
Reaksjonshastigheten øker etter hvert som alken blir mer komplisert-i betydningen antall alkylgrupper (som metylgrupper) festet til karbonatomene i hver ende av dobbeltbindingen. For eksempel:
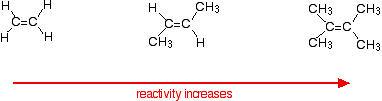
det er to måter å se på årsakene til dette-som begge trenger du å vite om mekanismen for reaksjonene.
Alkener reagerer fordi elektronene i pi-bindingen tiltrekker seg ting med en hvilken som helst grad av positiv ladning. Alt som øker elektrontettheten rundt dobbeltbindingen, vil hjelpe dette.
Alkylgrupper har en tendens til å «skyve» elektroner bort fra seg selv mot dobbeltbindingen. Jo flere alkylgrupper du har, jo mer negativt blir området rundt dobbeltbindingene.
jo mer negativt ladet den regionen blir, desto mer vil den tiltrekke seg molekyler som hydrogenklorid.
den viktigste grunnen ligger imidlertid i stabiliteten til mellomionet dannet under reaksjonen. De tre eksemplene som er gitt ovenfor, produserer disse karbokasjonene (karboniumioner) i halvveis av reaksjonen:
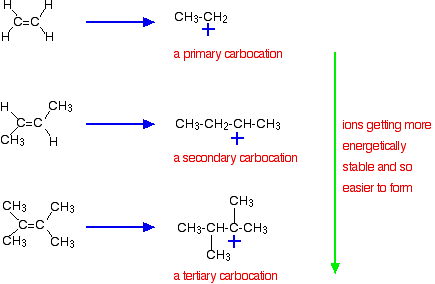
stabiliteten til de mellomliggende ioner styrer aktiveringsenergien for reaksjonen. Når du går mot de mer kompliserte alkenene, faller aktiveringsenergien for reaksjonen. Det betyr at reaksjonene blir raskere.