glukose – alanin syklus, Eller Cahill syklus, foreslått for første gang Av Mallette, Exton Og Park, Og Felig et al. mellom 1969 og 1970, består av en rekke trinn gjennom hvilke ekstrahepatiske vev, for eksempel skjelettmuskulatur, eksporterer pyruvat og aminogrupper som alanin til leveren, og mottar glukose fra leveren via blodbanen.
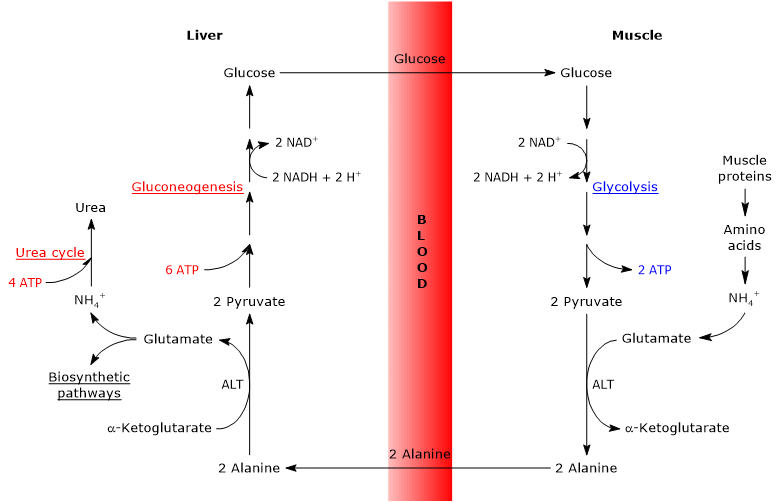
hovedtrinnene i glukose – alaninsyklusen er oppsummert nedenfor.
- når i ekstrahepatiske vev brukes aminosyrer til energi, brukes pyruvat, avledet fra glykolyse, som aminogruppeacceptor, som danner alanin, en ikke-essensiell aminosyre.
- alanin diffunderer inn i blodet og når leveren.
- i leveren overføres aminogruppen av alanin til α-ketoglutarat for å danne henholdsvis pyruvat og glutamat.
- aminogruppen glutamat går for det meste inn i ureasyklusen, og fungerer delvis som en nitrogendonor i mange biosyntetiske veier.
Pyruvat går inn i glukoneogenese og brukes til glukosesyntese. - den nylig dannede glukosen diffunderer inn i blodet og når perifert vev der, på grunn av glykolyse, omdannes til pyruvat som kan akseptere aminogrupper fra de frie aminosyrene, og dermed lukke syklusen.
derfor gir glukose – alaninsyklusen en sammenheng mellom karbohydrat og aminosyremetabolisme, som skjematisk beskrevet nedenfor.
Glukose Hryvnja Pyruvat → Alanine Hryvnja Pyruvat → Glukose
glukose-alanin-syklusen forekommer ikke bare mellom skjelettmuskulaturen, det første vevet der det ble observert, og leveren, men involverer andre celler og ekstrahepatiske vev, inkludert celler i immunsystemet, som lymfoide organer.
INNHOLD
- trinnene i glukose – alaninsyklusen
- Cahill-syklusen i skjelettmuskulatur
- Cahill-syklusen i leveren
- Transaminaser
- funksjoner av glukose-alanin syklusen
- Energikostnaden for glukose-alanin syklusen
- Likheter og forskjeller Mellom cahill syklus og Cori syklus
trinnene i glukose-alanin syklusen
analysen av trinnene i glukose-alanin syklusen er gjort med tanke på syklusen mellom skjelettmuskulatur og leveren.
både intracellulære og ekstracellulære proteiner hydrolyseres kontinuerlig til aminosyrene og resyntesiseres, og hastigheten som disse prosessene oppstår, balanseres nøyaktig, og forhindrer dermed tap av fettfri masse.
men under katabolske forhold, som intens og langvarig trening eller fasting, overstiger hastigheten på muskelproteinbrudd syntese. Dette fører til frigjøring av aminosyrer, hvorav noen brukes til energi og andre for glukoneogenese. Og oksidasjonen av karbonskjelettene av aminosyrer, spesielt forgrenede aminosyrer eller BCAA (leucin, isoleucin og valin), kan være en betydelig energikilde for muskelen. For eksempel, etter ca 90 minutter med anstrengende trening, gir aminosyre oksidasjon i muskel 10-15% av energien som trengs for sammentrekning.
utnyttelsen av karbonskjelettene av aminosyrer for energi innebærer fjerning av aminogruppen, og deretter utskillelsen av aminotrogen i en giftfri form.
fjerningen av α-aminogruppen skjer ved transaminering, som kan oppsummeres som følger:
α-Keto syre + Aminosyre ⇄ Ny aminosyre + Ny α-keto syre
slike reaksjoner, katalysert av enzymer kalt aminotransferaser eller transaminaser (EC 2.6.1) er fritt reversible.
Forgrenede aminosyrer, for eksempel, overfører aminogruppen til α-ketoglutarat eller 2-oksoglutarsyre, for å danne glutamat og α-keto-syre avledet fra den opprinnelige aminosyren, i en reaksjon katalysert av forgrenet kjedeaminotransferase eller BCAT (EC 2.6 .1.42).
Cahill-syklusen i skjelettmuskulatur
i skjelettmuskulatur kan det nydannede glutamatet reagere med ammoniakk for å danne glutamin, for mange vev og organer, som hjernen, det viktigste kjøretøyet for interorgan transport av nitrogen. Reaksjonen katalyseres av det cytosoliske enzymet glutaminsyntetase (EC 6.3.1.2), og forbruker EN ATP.
Glutamat + NH4+ + ATP → Glutamin + ADP + Pi
i dette tilfellet forlater glutamat cahill-syklusen.
Alternativt, og i motsetning til hva som skjer i de fleste andre vev, kan det nydannede glutamatet overføre aminogruppen til pyruvat, avledet fra glykolyse, for å danne alanin og α-ketoglutarat. Denne transamineringen katalyseres av alaninaminotransferase ELLER ALAT (EC 2.6.1.2), et enzym som finnes i de fleste dyre-og plantevev.
Glutamat + Pyruvat ⇄ Alanin + α-Ketoglutarat
alaninen produsert og som stammer direkte fra proteinbrudd, og muskelproteiner er rike på alanin, kan forlate cellen og bli båret av blodet til leveren; på denne måten når aminogruppen leveren. Og hastigheten ved hvilken alanin dannet ved transaminering av pyruvat overføres til sirkulasjonen, er proporsjonal med den intracellulære pyruvatproduksjonen.
Merk: alanin og glutamin er de viktigste kildene til nitrogen og karbon i interorgan aminosyre metabolisme.
Cahill-syklusen i leveren
En leveralaninaminotransferase katalyserer En transaminering Der alanin, den viktigste glukoneogene aminosyren, virker som en aminogruppedonor og α-ketoglutarat som en α-ketosyre. Produktene av reaksjonen er pyruvat, dvs. karbonskjelettet av alanin og glutamat.
Alanin + α-Ketoglutarat ⇄ Glutamat + Pyruvat
Glutamat, i reaksjonen katalysert av glutamatdehydrogenase (EC 1.4.1 .2), et enzym som er tilstede i mitokondriellmatrisen, danner ammoniumion, som går inn i ureasyklusen, og α-ketoglutarat, som kan komme Inn I Krebs syklusen. Denne reaksjonen er en anaplerotisk reaksjon som forbinder aminosyremetabolismen Med Krebs-syklusen.
Glutamat + H2O + nad+ ⇄ α-ketoglutarat + nh4 + + NADH + H+
glutamat kan imidlertid også reagere med oksaloacetat for å danne aspartat og α-ketoglutarat, i en reaksjon katalysert av aspartataminotransferase (ec 2.6.1.1). Aspartat er involvert i dannelsen av urea så vel som i syntesen av puriner og pyrimidiner.
Glutamat + Oksaloacetat ⇄ Aspartat + α-Ketoglutarat
også produsert pyruvat kan ha forskjellige metabolske skjebner: det kan oksyderes for ATP-produksjon, og deretter forlate glukose-alaninsyklusen, eller gå inn i glukoneogeneseveien, og dermed fortsette i syklusen.
den produserte glukosen frigjøres fra leveren inn i blodet og leveres til forskjellige vev som krever det, som skjelettmuskulatur, der den brukes til pyruvatsyntese. I sin tur kan det nydannede pyruvat reagere med glutamat, og dermed lukke syklusen.
Transaminaser
som tidligere nevnt skjer fjerningen av aminogruppen fra aminosyrer gjennom transaminering (se ovenfor for den generelle reaksjonen). Disse reaksjonene katalyseres av enzymer som kalles aminotransferaser eller transaminaser.
de er cytosoliske enzymer, tilstede i alle celler og spesielt rikelig i lever, nyre, tarm og muskel; de krever pyridoksalfosfat ELLER PLP, den aktive formen av vitamin B6 eller pyridoksin, som et koenzym, som er tett bundet til det aktive stedet.
i transamineringsreaksjoner kanaliseres aminogruppen av frie aminosyrer, unntatt treonin og lysin, mot et lite antall α-ketosyrer, særlig pyruvat, oksaloacetat og α-ketoglutarat.
Celler inneholder forskjellige typer aminotransferaser: mange er spesifikke for α-ketoglutarat som α-ketosyreacceptor, men varierer i spesifisitet for aminosyren, som de er oppkalt etter. Eksempler er den nevnte alaninaminotransferase, også kalt alanintransaminase og glutamin pyruvisk transferase ELLER gpt, og aspartataminotransferase eller AST, også kalt glutamin-oksaloeddiktransaminase eller GOT.
det bør understrekes at det ikke er netto deaminering i disse reaksjonene, ingen tap av aminogrupper, da den α-keto-syreacceptoren amineres og aminosyren deamineres.
funksjoner av glukose-alanin syklusen
denne syklusen har ulike funksjoner.
- det transporterer nitrogen i en giftfri form fra perifert vev til leveren.
- det transporterer pyruvat, et glukoneogent substrat, til leveren.
- det fjerner pyruvat fra perifert vev. DETTE fører til en høyere PRODUKSJON AV ATP fra glukose i disse vevene. FAKTISK KAN NADH produsert under glykolyse komme inn i mitokondriene og oksyderes gjennom oksidativ fosforylering.
- det tillater å opprettholde en relativt høy konsentrasjon av alanin i hepatocytter, tilstrekkelig til å hemme proteindegradering.
- Det kan spille en rolle i vertsforsvar mot smittsomme sykdommer.
Endelig er Det Viktig å understreke at det ikke er netto syntese av glukose i glukose-alaninsyklusen.
Energikostnad for glukose-alanin syklusen
som Cori syklusen har også glukose-alanin syklusen en energikostnad, lik 3-5 ATP.
den delen av syklusen som foregår i perifert vev innebærer produksjon av 5-7 ATP per molekyl glukose:
- 2 ATP produseres ved glykolyse;
- 3-5 ATP stammer FRA NADH / FADH2 (se nedenfor).
I stedet i leveren koster glukoneogenese og ureasyklusen 10 ATP:
- 6 ATP forbrukes i løpet av glukoneogenesen per molekyl glukose syntetisert;
- 4 ATP forbrukes i ureasyklusen per molekyl urea syntetisert.
glukose-alaninsyklusen, som Cori-syklusen, skifter en del av metabolsk byrde fra ekstrahepatisk vev til leveren. Imidlertid er energikostnaden betalt av leveren begrunnet av fordelene som syklusen bringer til hele kroppen, da det i spesielle forhold tillater en effektiv nedbrytning av proteiner i ekstrahepatisk vev (spesielt skjelettmuskulatur), som igjen gjør det mulig å oppnå glukoneogene substrater samt bruk av aminosyrer for energi i ekstrahepatisk vev.
Likheter og forskjeller mellom Cahill syklus og Cori syklus
det er noen analogier mellom de to syklusene, som er oppført nedenfor.
- Cahill-syklusen overlapper Delvis Cori-syklusen når pyruvat omdannes til glukose og monosakkaridet transporteres til ekstrahepatisk vev, hvor det omdannes igjen til pyruvat via glykolytisk vei.
- inngangen til glukoneogeneseveien er lik for de to syklusene: både alanin og laktat omdannes til pyruvat.
- i Likhet Med Cori-syklusen forekommer glukose-alanin-syklusen mellom forskjellige celletyper, i motsetning til metabolske veier som glykolyse, Krebs-syklus eller glukoneogenese som forekommer i individuelle celler
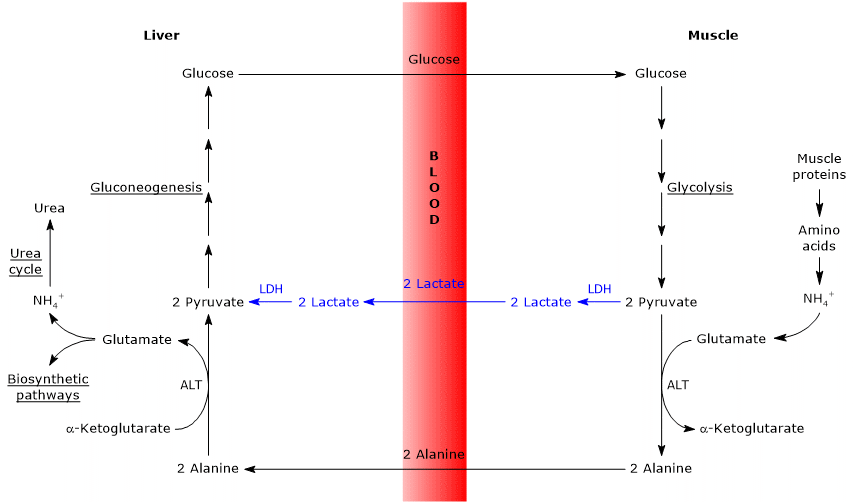
nedenfor er noen forskjeller mellom de to syklusene.
- hovedforskjellen gjelder det tre karbon-mellomproduktet som fra perifert vev når leveren: laktat i Cori-syklusen og alanin i glukose – alanin-syklusen.
- En annen forskjell gjelder skjebnen TIL NADH produsert av glykolyse i perifert vev.
I Cori-syklusen virker koenzymet som reduksjonsmiddel for å redusere pyruvat til laktat, i reaksjonen katalysert av laktatdehydrogenase (EC 1.1.1.27).
i glukose – alaninsyklusen forekommer denne reduksjonen ikke, og elektronene I NADH kan transporteres inn i mitokondriene via malat-aspartat-og glyserol-3-fosfat-skyttelbussene, og genererer NADH, den første skyttelbussen, OG FADH2, den andre skyttelbussen. OG utbyttet AV ATP FRA NADH OG FADH2 er henholdsvis 2,5 og 1,5. - Til slutt, fra det forrige punktet, er det klart at, i motsetning Til Cori-syklusen, krever cahill-syklusen tilstedeværelse av oksygen og mitokondrier i perifert vev.
Berg J. M., Tymoczko J. L., Og Stryer L. Biokjemi. 5. Utgave. Wh Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill Gf Alanin: nøkkelrolle i glukoneogenese. Vitenskap 1970;167(3920):1003-4. doi:10.1126 / vitenskap.167.3920.1003
Gropper S. S., Smith J. L., Groff J. L. Avansert ernæring og menneskelig metabolisme. Cengage Learning ,2009
Lecker Sh, Goldberg Al og Mitch We protein degradering av ubiquitin–proteasomveien i normale og sykdomstilstander. J Am Soc Nephrol 2006; 17 (7): 1807-19. doi: 10.1681 / ASN.2006010083
Mallette L. E., Exton J. H., Og Park C. R. Kontroll av glukoneogenese fra aminosyrer i perfusert rottelever. J Biol Chem 1969; 244 (20): 5713-23.
Nelson D. L., Cox M. M. Lehninger. Prinsipper for biokjemi. 6. Utgave. W. H. Freeman og Kompani, 2012
Raju S. M., Madala B. Illustrert medisinsk biokjemi. Jaypee Brothers Publishers, 2005
Wu G. Aminosyrer: biokjemi og ernæring. CRC Press, 2013