Læringsmål
ved slutten av denne delen vil du kunne:
- Skriv Lewis symboler for nøytrale atomer og ioner
- Tegn Lewis strukturer som viser bindingen i enkle molekyler
vi har diskutert de ulike typer bindinger som dannes mellom atomer og / eller ioner. I alle tilfeller involverer disse bindingene deling eller overføring av valensskall elektroner mellom atomer. I denne delen vil vi utforske den typiske metoden for å skildre valensskallelektroner og kjemiske bindinger, Nemlig Lewis-symboler og Lewis-strukturer.
Lewis Symboler
Vi bruker Lewis symboler for å beskrive valenselektronkonfigurasjoner av atomer og monatomiske ioner. Et Lewis-symbol består av et elementært symbol omgitt av en prikk for hver av sine valenselektroner:
Figur 1 viser Lewis-symbolene for elementene i den tredje perioden i det periodiske bordet.

Figur 1. Lewis symboler illustrerer antall valenselektroner for hvert element i den tredje perioden av det periodiske bordet.
Lewis symboler kan også brukes til å illustrere dannelsen av kationer fra atomer, som vist her for natrium og kalsium:

på Samme måte kan de brukes til å vise dannelsen av anioner fra atomer, som vist nedenfor for klor og svovel:

Figur 2 viser Bruk Av Lewis symboler for å vise overføring av elektroner under dannelsen av ioniske forbindelser.

Figur 2. Kationer dannes når atomer mister elektroner, representert ved færre Lewis prikker, mens anioner dannes av atomer som får elektroner. Det totale antall elektroner endres ikke.
Lewis Strukturer
Vi bruker Også Lewis symboler for å indikere dannelsen av kovalente bindinger, som er vist I Lewis strukturer, tegninger som beskriver bindingen i molekyler og polyatomiske ioner. For eksempel, når to kloratomer danner et klormolekyl, deler de ett par elektroner:

Lewis-strukturen indikerer at Hvert Cl-atom har tre par elektroner som ikke brukes i binding (kalt ensomme par) og ett felles par elektroner (skrevet mellom atomene). En dash (eller linje) brukes noen ganger til å indikere et delt par elektroner:

et enkelt delt par elektroner kalles en enkeltbinding. Hvert Cl-atom interagerer med åtte valenselektroner: de seks i de ensomme parene og de to i enkeltbindingen.
Oktettregelen
de andre halogenmolekylene (F2, Br2, I2 og At2) danner bindinger som de i klormolekylet: en enkeltbinding mellom atomer og tre ensomme par elektroner per atom. Dette gjør at hvert halogenatom kan ha en edelgasselektronkonfigurasjon. Tendensen til hovedgruppeatomer til å danne nok bindinger til å oppnå åtte valenselektroner er kjent som oktettregelen.
antall bindinger som et atom kan danne kan ofte forutsies fra antall elektroner som trengs for å nå en oktett (åtte valenselektroner); dette gjelder spesielt for ikke-metaller i den andre perioden av det periodiske bordet (C, N, O og F). For eksempel har hvert atom i et gruppe 14-element fire elektroner i sitt ytterste skall og krever derfor fire flere elektroner for å nå en oktett. Disse fire elektronene kan oppnås ved å danne fire kovalente bindinger, som illustrert her for karbon I CCl4 (karbontetraklorid) og silisium I SiH4 (silan). Fordi hydrogen bare trenger to elektroner for å fylle valensskallet, er det et unntak fra oktettregelen. Overgangselementene og de indre overgangselementene følger heller ikke oktettregelen:

Gruppe 15 elementer som nitrogen har fem valenselektroner i atom Lewis symbol: en ensom par og tre uparede elektroner. For å oppnå en oktett danner disse atomene tre kovalente bindinger, som I NH3 (ammoniakk). Oksygen og andre atomer i gruppe 16 får en oktett ved å danne to kovalente bindinger:
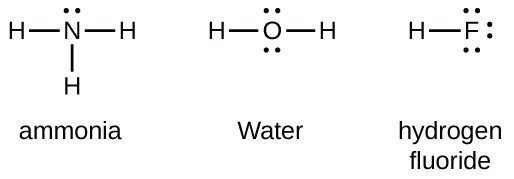
Dobbelt-Og Trippelbindinger
som tidligere nevnt, når et par atomer deler ett par elektroner, kaller vi dette en enkeltbinding. Et par atomer kan imidlertid trenge å dele mer enn ett par elektroner for å oppnå den nødvendige oktetten. En dobbeltbinding dannes når to par elektroner deles mellom et par atomer, som mellom karbon-og oksygenatomer I CH2O (formaldehyd) og mellom de to karbonatomer I C2H4 (etylen):
en trippelbinding dannes når tre elektronpar deles av et par atomer, som i nitrogengass (N2):
Skrive Lewis Strukturer Med Oktettregelen
for svært enkle molekyler og molekylære ioner, kan Vi skrive Lewis strukturer ved bare å parre Opp de uparede elektronene på de bestandige atomer. Se disse eksemplene:

for mer kompliserte molekyler og molekylære ioner er det nyttig å følge den trinnvise prosedyren som er skissert her:
- Bestem totalt antall valens (ytre skall) elektroner.
- Tegn en skjelettstruktur av molekylet, ordne atomene rundt et sentralt atom. (Generelt bør det minste elektronegative elementet plasseres i midten.) Koble hvert atom til det sentrale atom med en enkeltbinding (ett elektronpar).
- Fordel de gjenværende elektronene som lone par på terminalatomene (unntatt hydrogen), og fullfør en oktett rundt hvert atom.
- Plasser alle gjenværende elektroner på det sentrale atom.
- Omorganiser elektronene til de ytre atomene for å lage flere bindinger med det sentrale atom for å oppnå oktetter der det er mulig.
la Oss bestemme Lewis-strukturen Til PBr3 ved hjelp av trinnene ovenfor:
- Trinn 1: Bestem totalt antall valens (ytre skall) elektroner.
\stor \ begin{array}{l}\ \ phantom {\rule {0.8 em}{0ex}} {\text{PBr}}_{3} \ \ phantom {\rule{0.8 em}{0ex}} \ text{P: 5 valenselektroner / atom} \ times \ text{1 atom}=5\ \ understrek {+\text{Br: 7 valenselektron / atom} \ times \ text{3 atomer} = 21}\\ \ \ phantom {\rule{15.95em}{0ex}}= \ tekst{26 valenselektroner} \ end{array}
- Trinn 2: Tegn en skjelettstruktur av molekylet, ordne atomene rundt et sentralt atom. (Generelt bør det minste elektronegative elementet plasseres i midten.) Koble hvert atom til det sentrale atom med en enkeltbinding (ett elektronpar).

- Trinn 3: Fordel de resterende elektronene som ensomme par på terminalatomer( unntatt hydrogen), og fullfør en oktett rundt hvert atom.
-
 Trinn 4: Plasser alle gjenværende elektroner på det sentrale atom.
Trinn 4: Plasser alle gjenværende elektroner på det sentrale atom.

Merk: Trinn 5: er ikke nødvendig siden alle atomer har en oktett.
la Oss bestemme Lewis-strukturen TIL CH2O.
- Trinn 1: Bestem totalt antall valens (ytre skall) elektroner.
\stor \begin{array}{l}\\ phantom {\rule{0.8 em}{0ex}} {\text{h}_{2}}\text{CO}\\ phantom {\rule{0.8 em}{0ex}} \text{h: 1 valenselektron/atom}\times\text{c: 4 valenselektroner/atom}\times \text{1 atom}=4\\understrek {+\text {o: 6 valenselektroner/atom}\times \text{1 atomer}=6}\\ \\phantom {\rule {15.95 em} {0ex}}=\text{12 valenselektroner}\ end{array}
- Trinn 2: Tegn en skjelettstruktur av molekylet, ordne atomene rundt et sentralt atom. (Generelt bør det minste elektronegative elementet plasseres i midten.) Koble hvert atom til det sentrale atom med en enkeltbinding (ett elektronpar).

- Trinn 3: Fordel de resterende elektronene som ensomme par på terminalatomer( unntatt hydrogen), og fullfør en oktett rundt hvert atom.

- Trinn 4: ikke nødvendig, siden alle elektroner er plassert. Karbon har imidlertid ikke en oktett,
- Trinn 5: Omarrangere elektronene til de ytre atomer for å lage flere bindinger med det sentrale atom for å oppnå oktetter der det er mulig.

Eksempel 1: Skrive Lewis Structures
NASAS Cassini-Huygens-oppdrag oppdaget en stor sky av giftig hydrogencyanid (HCN) På Titan, En Av Saturns måner. Hva Er Lewis strukturer av disse molekylene?
Sjekk Din Læring
Karbondioksid, CO2, er et produkt av forbrenning av fossilt brensel. CO2 har vært involvert i globale klimaendringer. Hva Er Lewis-strukturen AV CO2?
Sentrale Begreper Og Sammendrag
Valens elektroniske strukturer kan visualiseres ved å tegne Lewis symboler (for atomer og monatomiske ioner) Og Lewis strukturer (for molekyler og polyatomiske ioner). Lone par, uparede elektroner og enkle, doble eller trippelbindinger brukes til å indikere hvor valenselektronene befinner seg rundt hvert atom i En Lewis-struktur. De fleste strukturer—spesielt de som inneholder andre radelementer—adlyder oktettregelen, der hvert atom (unntatt H) er omgitt av åtte elektroner. Unntak fra oktettregelen forekommer for odde-elektronmolekyler (frie radikaler), elektron-mangelfulle molekyler og hypervalente molekyler.
Øvelser
- Skriv Lewis-symbolene for hver av følgende ioner:
- As3–
- I –
- Be2 +
- O2–
- Ga3+
- Li+
- N3–
- mange monatomiske ioner finnes i sjøvann, inkludert ioner dannet fra følgende liste over elementer. Skriv Lewis-symbolene for de monatomiske ioner dannet av følgende elementer:
- Cl
- Na
- Ca
- K
- Br
- Sr
- F
- Skriv Lewis symboler av ioner i hver av de følgende ioniske forbindelser Og Lewis symboler av atom som de er dannet:
- MgS
- Al2O3
- GaCl3
- kf
- I Lewis strukturer oppført nedenfor, M og X representerer ulike elementer i den tredje perioden av det periodiske system. Skriv formelen for hver forbindelse ved hjelp av kjemiske symboler for hvert element:
- Skriv Lewis-strukturen For det diatomiske molekylet P2, en ustabil form for fosfor som finnes i fosfordamp med høy temperatur.
- Skriv Lewis strukturer for følgende:
- H2
- HBr
- PCl3
- Skriv Lewis strukturer for følgende:
- O2
- H2CO
- AsF3
- SiCl4
Ordliste
dobbeltbinding: kovalent binding hvor to par elektroner deles mellom to atomer
friradikal: molekyl som inneholder et ulikt antall elektroner
hypervalent molekyl: molekyl som inneholder minst ett hovedgruppeelement som har mer enn åtte elektroner i valensskallet
Lewis struktur: diagram som viser ensomme par og bindingspar av elektroner i et molekyl eller en ion
lewis symbol: symbol for et element eller monatomisk ion som bruker en prikk for å representere hvert valenselektron i elementet eller ion
lone par: to (et par) valenselektroner som ikke brukes til å danne en kovalent binding
oktettregel: retningslinje som sier at hovedgruppeatomer vil danne strukturer der åtte valenselektroner interagerer med hver kjerne, og teller bindingselektroner som interagerer med begge atomer forbundet med bindingen
enkeltbinding: binding i hvilken et enkelt par elektroner deles mellom to atomer
trippelbinding: bond der tre par elektroner deles mellom to atomer


 HCN: ingen elektroner forblir
HCN: ingen elektroner forblir




















