Bevisene Bak Naturlige Intervensjoner For Alkoholfrie Fatty Liver Disease: Planter, Næringsstoffer Og Probiotika For Behandling Av Denne Vanlige Sykdom
gitt økningen i alkoholfrie fatty liver disease (NAFLD) i både voksne og pediatri og mangel på en indikert farmasøytisk behandling,, naturlige strategier for behandling av denne tilstanden stå godt klar som «nest beste.»Flere kosttilskudd og botanicals har blitt studert klinisk og viser løfte om behandling AV NAFLD og dens inflammatoriske motpart, ikke-alkoholisk steatohepatitt (NASH). Gitt hvor mange av disse terapiene adresserer faktorene som bidrar TIL utviklingen AV NAFLD, tar det ikke mye resonnement for å forstå hvordan de effektivt kan adressere noen av årsakene til sykdom, i stedet for bare å ta opp et symptom.
Fem supplerende tiltak med klinisk eller epidemiologisk bevis for deres bruk i INNSTILLINGEN AV NAFLD er fosfatidylkolin, som gir fosfolipider og kolin, Vitamin E, både som alfa-tokoferoler og en blanding av delta og gamma-tokotrienoler, melketistelfrøekstrakt, berberin og probiotika.
- Fettlever Endringer: Korrelert Med En Fosfatidyl Kolin Mangel?
- Vitamin E
- Melketistel
- Berberin
- Probiotika
- Konklusjon
- Dr. Carrie Decker, nd uteksaminert med æresbevisninger Fra National College Of Natural Medicine (nå National University Of Natural Medicine) I Portland, Oregon. Dr. Decker ser pasienter eksternt, med fokus på gastrointestinal sykdom, humørforstyrrelser, spiseforstyrrelser, autoimmun sykdom og kronisk tretthet. Før Han ble en naturopatisk lege, Var Dr. Decker ingeniør og oppnådde høyere grader i biomedisinsk og maskinteknikk fra Henholdsvis University of Wisconsin-Madison og University Of Illinois I Urbana-Champaign. Dr. Decker fortsetter å nyte akademisk forskning og skriving og bruker disse ferdighetene til å støtte integrativ medisinutdanning som forfatter og bidragsyter til ulike ressurser. Dr. Decker støtter Allergy Research Group som medlem av deres utdannings-og produktutviklingsteam.
- Kilder:
- Spengler EK, Loomba R. Anbefalinger for diagnose, henvisning til leverbiopsi og behandling av ikke-alkoholisk fettleversykdom og ikke-alkoholisk steatohepatitt. Mayo Clinic Proceedings (Engelsk). 2015;90(9):1233–1246.
- Berardis S, Sokal E. Pediatrisk ikke-alkoholholdig fettleversykdom: et økende folkehelseproblem. Eur J Pediatr. 2014 Februar; 173 (2): 131-9.
- Jadeja R, et al. Herbal medisiner for behandling av ikke-alkoholisk steatohepatitt: nåværende scenario og fremtidsutsikter. Evid Basert Komplement Alternativ Med. 2014:648308.
- Pomorski T, Et al. Lipidfordeling og transport på tvers av cellemembraner. Semin Celle Dev Biol. 2001 April; 12 (2): 139-48.
- Yamaji-Hasegawa A, Et al. Asymmetrisk fordeling av fosfolipider i biomembraner. Biol Pharm Bull. 2006 August; 29 (8): 1547-53.
- Heişğ AA, et al. Biliær lipidsekresjon. Turk J Gastroenterol. 2007 Juni; 18 (2): 65-70.
- Fischer LM, et al. Kjønn og menopausal status påvirker menneskelige diettbehov for næringsstoffet kolin. Er J Clin Nutr. 2007 Mai; 85 (5): 1275-85.
- Wallace TC, Et al. Vanlige Kolininntak Er Forbundet Med Egg – Og Proteinmatforbruk i Usa. Næringsstoff. 2017 August 5; 9 (8).
- Zeisel SH. Genresponselementer, genetiske polymorfier og epigenetikk påvirker det menneskelige diettbehovet for kolin. Iubmb Livet. 2007 Juni; 59 (6): 380-7.
- Zeisel SH. Genresponselementer, genetiske polymorfier og epigenetikk påvirker det menneskelige diettbehovet for kolin. Iubmb Livet. 2007 Juni; 59 (6): 380-7.
- Guerrerio AL, Et al. Kolininntak i en stor kohort av pasienter med ikke-alkoholisk fettleversykdom. Er J Clin Nutr. 2012 April; 95 (4): 892-900.
- Ma X, et al. Polyenylfosfatidylkolin demper ikke-alkoholisk leverfibrose og akselererer regresjonen. J Hepatol. 1996 Mai;24 (5): 604-13.
- Lieber CS, et al. Fosfatidylkolin beskytter mot fibrose og cirrhose i bavian. Gastroenterologi. 1994 Jan;106(1):152-9.
- Chanussot F, Et al. Forebygging av diett (n-6) flerumettede fosfatidylkholiner av intrahepatisk kolestase indusert av ciklosporin A hos dyr. Livet Sci. 2003 Juni 13;73 (4): 381-92.
- Karaman A, Et al. Beskyttende effekt av flerumettet fosfatidylkolin på leverskade indusert av biliær obstruksjon hos rotter. J Pediatr Surg. 2003 September; 38 (9): 1341-7.
- Karaman A, Et al. Beskyttende effekt av flerumettet fosfatidylkolin på leverskade indusert av biliær obstruksjon hos rotter. J Pediatr Surg. 2003 September; 38 (9): 1341-7.
- Stremmel W, et al. Mukosal beskyttelse av fosfatidylkolin. Dig Dis. 2012; 30 Tillegg 3: 85-91.
- Parlesak A, et al. Konjugerte primære gallsalter reduserer permeabiliteten av endotoksin gjennom intestinale epitelceller og synergiserer med fosfatidylkolin i undertrykkelse av inflammatorisk cytokinproduksjon. Crit Care Med. 2007 Oktober; 35 (10): 2367-74.
- Mitzscherling K, Et al. Fosfatidylkolin reverserer etanolindusert økning i transepitelial endotoksinpermeabilitet og avskaffer transepitelial leukocyttaktivering. Alkohol Clin Exp Res. 2009 Mar; 33 (3): 557-62.
- Buzzetti E, et al. Multiple-hit patogenesen av ikke-alkoholisk fettleversykdom (NAFLD). Stoffskifte. 2016 August; 65 (8):1038-48.
- El Hadi H, Et al. Vitamin E Som Behandling For Ikke-Alkoholisk Fettleversykdom: Virkelighet eller Myte? Antioksidanter (Basel). 2018 Jan 16;7(1).
- Bugianesi E, Et al. En randomisert kontrollert studie av metformin versus vitamin E eller normativ diett ved ikke-alkoholisk fettleversykdom. Am J Gastroenterol. 2005 Mai; 100 (5): 1082-90.
- Sanyal AJ, Et al. Pioglitazon, vitamin e eller placebo for ikke-alkoholisk steatohepatitt. N Engl J Med. 2010 Mai 6;362 (18): 1675-85.
- Lavine JE. Vitamin e behandling av alkoholisk steatohepatitis hos barn: pilotstudie. J Pediatr. 2000 Juni; 136 (6): 734-8.
- Peh HY, et al. Vitamin e terapi utover kreft: Tokoferol versus tocotrienol. Pharmacol Ther. 2016 Juni; 162: 152-69.
- Qureshi AA, et al. Doseavhengig modulering av lipidparametere, cytokiner og rna ved delta-tocotrienol hos hyperkolesterolemiske individer begrenset TIL Aha Step-1 diett. Brit J Av Med & Med Res. 2015;6(4):351-66.
- Qureshi AA, et al. Virkningen av delta-tocotrienol på inflammatoriske biomarkører og oksidativt stress i hyperkolesterolemiske fag. Clin Exp Kardiologi. 2015;6(4):1000367.
- Zaiden N, et al. Gamma delta-tocotrienoler reduserer hepatisk triglyseridsyntese og VLDL-sekresjon. J Atheroscler Trombus. 2010 Oktober 27;17 (10): 1019-32.
- Magosso E, Et al. Tocotrienoler for normalisering av hepatisk ekkogen respons i ikke-alkoholisk fettlever: en randomisert placebokontrollert klinisk studie. Nutr J. 2013 Desember 27;12(1):166.
- Pervez MA, Et al. Effekter Av Delta-tocotrienol-Tilskudd på Leverenzymer, Betennelse, Oksidativt stress og Hepatisk Steatose hos Pasienter med Ikke-Alkoholisk Fettleversykdom. Turk J Gastroenterol. 2018 Mar;29(2):170-176.
- Abenavoli L, Et al. Melkdistel i leversykdommer: fortid, nåtid, fremtid. Phytother Res. 2010 Okt;24 (10): 1423-32.
- Valenzuela A, Et al. Selektivitet av silymarin på økningen AV gsh-innholdet i forskjellige vev av rotten. Planta Med. 1989 Oktober; 55 (5): 420-2.
- Rui YC. Fremskritt i farmakologiske studier av silymarin. Mem Inst Oswaldo Cruz. 1991; 86 Suppl 2: 79-85.
- Gu M, et al. Silymarin Forbedrer Metabolsk Dysfunksjon Assosiert Med Diettindusert Fedme via Aktivering Av Farnesyl X-Reseptor. Foran Pharmacol. 2016 September 28; 7: 345.
- Ali AH, Et al. Nylige fremskritt i utviklingen av farnesoid X-reseptoragonister. Ann Transl Med. 2015 Jan;3(1):5.
- Traussnigg S, et al. Effekt og sikkerhet av den ikke-steroide farnesoid X-reseptoragonisten PX-104 hos pasienter MED ikke-alkoholisk fettleversykdom (NAFLD). Zeitschrift fü Gastroenterologi. 2017 Mai;55(05):A71.
- Zhong S, Et al. Den terapeutiske effekten av silymarin ved behandling av ikke-alkoholisk fettsykdom: en meta-analyse (PRISMA) av randomiserte kontrollforsøk. Medisin (Baltimore). 2017 Desember; 96 (49): e9061.
- Hajiaghamohammadi AA, ET al. Effekter av metformin -, pioglitazon-og silymarinbehandling på Ikke-alkoholisk Fettleversykdom: en randomisert kontrollert pilotstudie. Hepat Man. 2012 August; 12 (8): e6099.
- Birdsall TC, et al. Berberin: terapeutisk potensial for en alkaloid som finnes i flere medisinske planter. Altern Med Åp 1997; 2: 94-103.
- Imanshahidi M, Et al. Farmakologiske og terapeutiske effekter Av Berberis vulgaris Og dets aktive bestanddel, Berberin. Phytother Res. 2008 Aug; 22 (8): 999-1012.
- Zhu X, Et al. De Potensielle Mekanismene Til Berberin i Behandlingen av Ikke-Alkoholisk Fettleversykdom. Molekyl. 2016 Oktober 14;21 (10).
- Lan J, et al. Meta-analyse av effekten og sikkerheten av berberin ved behandling av type 2 diabetes mellitus, hyperlipemi og hypertensjon. J Ethnopharmacol. 2015 Februar 23;161:69-81.
- Sol R, et al. Oralt Administrert Berberin Modulerer Hepatisk Lipidmetabolisme ved Å Endre Mikrobiell Gallesyremetabolisme og Intestinal Fxr-Signalvei. Mol Pharmacol. 2017 Februar; 91 (2): 110-122.
- Guo T, Et al. Berberin Forbedrer Hepatisk Steatose og Undertrykker Lever – Og Fettvevbetennelse hos Mus med Diettindusert Fedme. Sci Rep. 2016 Mar 3;6: 22612.
- Schattenberg JM, et al. JNK1 men IKKE JNK2 fremmer utviklingen av steatohepatitt hos mus. Hepatologi. 2006 Jan;43(1):163-72.
- Han J, et al. Modulerende tarmmikrobiota som en antidiabetisk mekanisme av berberin. Med Sci Monit. 2011; 17: RA164-7.
- Gu L, et al. Berberin forbedrer tarmepitelskader og nedregulerer myosin – lettkjedekinaseveier i en musemodell av endotoksinemi. J Infisere Dis. 2011 Juni 1;203 (11): 1602-12.
- Li N, et al. Berberin demper proinflammatorisk cytokin-indusert tett koblingsforstyrrelse i en in vitro-modell av intestinale epitelceller. Eur J Pharm Sci. 2010 April 16;40 (1): 1-8.
- Ma X, et al. Patogenesen Av Diabetes Mellitus Ved Oksidativt Stress Og Betennelse: Dets Inhibering Av Berberin. Foran Pharmacol. 2018 Juli 27; 9: 782.
- Yan HM, et al. Effekt Av Berberin Hos Pasienter med Ikke-Alkoholisk Fettleversykdom. PLoS One. 2015 August 7;10 (8): e0134172.
- MA ÅÅ, et al. Effekter av probiotika på ikke-alkoholisk fettleversykdom: en meta-analyse. World J Gastroenterol. 2013 Oktober 28;19 (40): 6911-8.
- Vajro P, et al. Effekter Av Lactobacillus rhamnosus stamme GG i pediatrisk fedme-relatert leversykdom. J Pediatr Gastroenterol Nutr. 2011 Juni; 52 (6): 740-3.
- Alisi A, et al. Randomisert klinisk studie: de gunstige effektene AV VSL # 3 hos overvektige barn med ikke-alkoholisk steatohepatitt. Aliment Pharmacol Ther. 2014 Juni; 39 (11): 1276-85.
- Pé-Rubio KG, et al. Effekt av berberinadministrasjon på metabolsk syndrom, insulinfølsomhet og insulinsekresjon. Metab Syndr Relatert Disord. 2013 Oktober; 11 (5): 366-9.
- Iacono A, et al. Probiotika som en fremvoksende terapeutisk strategi for å behandle NAFLD: fokus på molekylære og biokjemiske mekanismer. J Nutr Biochem. 2011 August; 22 (8): 699-711.
- Honda Y, Et al. Effekt av glutation for behandling av ikke-alkoholisk fettleversykdom: en åpen, enkeltarmet, multisenter, pilotstudie. BMC Gastroenterol. 2017 August 8;17(1):96.
- Dentico P, et al. . Recenti Prog Med. 1995 Juli-August; 86 (7-8): 290-3.
- Khoshbaten M, Et al. N-acetyl-cystein forbedrer leverfunksjonen hos pasienter med alkoholfri fettleversykdom. Hepatitt Mon. 2010;10(1):12-16.
- Muto C, Et al. Gamma-tocotrienol reduserer triacylglycerolnivået i rotte primære hepatocytter gjennom regulering av fettsyremetabolismen. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, Et al. Omega-3 tilskudd og alkoholfri fettleversykdom: en systematisk gjennomgang og meta-analyse. J Hepatol. 2012;56(4):944-51.
Fettlever Endringer: Korrelert Med En Fosfatidyl Kolin Mangel?
Fosfatidylkolin (PC) er avgjørende for helsen til alle cellene i kroppen og er en av de viktigste fosfolipidene som cellemembraner består av., PC består av over 90% av det totale gallefosfolipidinnholdet og letter fettemulgering, absorpsjon og transport. Studier har vist at anbefalt tilstrekkelig inntak (AI) av kolin (Se Tabell 1) kanskje ikke er tilstrekkelig for å forebygge symptomer på mangel som fettleverendringer eller muskelskade. I tillegg fant en nylig studie at bare 8% AV AMERIKANSKE voksne møter den anbefalte ai av kolin, med vegetarianere, postmenopausale kvinner og menn med størst risiko for utilstrekkelighet., Genetiske polymorfismer kan også øke behovet for kolin, som også er en kilde til metylgrupper i kroppen.
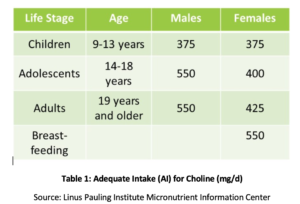
hos postmenopausale kvinner med NAFLD har redusert kolininntak vist seg å være signifikant forbundet med økt risiko for fibrose. HOS dyr har PC vist seg å beskytte mot fibrose forbundet med leverbetennelse. Økt INNTAK AV PC har vist seg å øke biliær lipidsekresjon, og dermed forhindre kolestase og påfølgende leverskade via mange mekanismer, inkludert undertrykkelse av nukleær faktor kappa B (NF-kB), en godt forstått molekylær utløser av betennelse., I en dyremodell av galleobstruksjon, har supplerende PC vist seg å redusere leverskade, ductal proliferasjon og fibrose.
PC er også viktig for tarmens helse og er en primær komponent i det beskyttende tarmslimlaget. I cellekulturer har BEHANDLING med PC vist seg å redusere migrasjonen av endotoksin gjennom intestinale epitelceller, og ytterligere undertrykke den tilhørende inflammatoriske cytokinresponsen. PC reduserer også endotoksintranslokasjon i innstillingen av alkoholindusert økning i intestinal permeabilitet. Denne gunstige effekten har blitt foreslått som en av mekanismene VED HVILKEN PC kan betraktes som terapeutisk ved alkoholisk leversykdom.
Vitamin E
som et oksidativt stressslag og redusert antioksidantforsvar har blitt foreslått som en faktor som leder utviklingen AV NAFLD, bør det ikke være overraskende at antioksidanter har blitt undersøkt som en potensiell behandling for tilstanden.
 E-Vitamin Har blitt studert i flere kliniske studier for BEHANDLING AV NAFLD, både som frittstående og tilleggsbehandling. I en gjennomgang av disse studiene varierte doseringen av vitamin E fra 400 til 1200 IE/dag og studievarigheten var fra 24 uker til mer enn to år. Funnene var generelt positive, og viste at når vitamin E ble inkludert, ble det sett forbedringer i histologi, steatose og/eller transaminasenivåer., I pediatri MED NAFLD, har Vitamin E også blitt studert som en terapi. I en åpen pilotstudie med 11 barn MED NAFLD ble det funnet at tilskudd på mellom 400 til 1200 IE Vitamin E i fire til ti måneder normaliserte transaminase-og alkalisk fosfatasenivåer under behandlingen, men de returnerte til unormale når behandlingen ble stoppet. Hepatisk ekkogenitet endret seg ikke i løpet av behandlingen.
E-Vitamin Har blitt studert i flere kliniske studier for BEHANDLING AV NAFLD, både som frittstående og tilleggsbehandling. I en gjennomgang av disse studiene varierte doseringen av vitamin E fra 400 til 1200 IE/dag og studievarigheten var fra 24 uker til mer enn to år. Funnene var generelt positive, og viste at når vitamin E ble inkludert, ble det sett forbedringer i histologi, steatose og/eller transaminasenivåer., I pediatri MED NAFLD, har Vitamin E også blitt studert som en terapi. I en åpen pilotstudie med 11 barn MED NAFLD ble det funnet at tilskudd på mellom 400 til 1200 IE Vitamin E i fire til ti måneder normaliserte transaminase-og alkalisk fosfatasenivåer under behandlingen, men de returnerte til unormale når behandlingen ble stoppet. Hepatisk ekkogenitet endret seg ikke i løpet av behandlingen.
Tocotrienoler Er den mindre studerte familien av de naturlig forekommende former for vitamin E, med tokoferolene, oftere funnet i naturen, dominerende vitenskapelig forskning. Imidlertid er tocotrienoler potente antioksidanter, sitert i noen undersøkelser som å ha 40 til 60 ganger antioxidantpotensialet av tokoferoler. Tocotrienoler har vist seg å forbedre total kolesterol og dets fraksjoner, redusere total OG LDL kolesterol med 15 til 20%,, og triglyserider opp til nesten 30%. Tocotrienoler har også vist seg å ha antiinflammatoriske og antioksidanteffekter in vivo, senke høyfølsomme C – REAKTIVT protein (hs-CRP) nivåer og redusere LDL oksidasjon.
Tocotrienoler har også blitt studert som BEHANDLING FOR NAFLD. Hos pasienter med ULTRALYDDIAGNOSTISERT NAFLD ble 200 mg blandede tokotrienoler (hentet fra palmeolje, med høy gammafraksjon og ytterligere 61 mg alfa-tokoferoler) tatt to ganger daglig i ett år vist å signifikant normalisere hepatisk ekkogen respons og remisjonsrate sammenlignet med placebo. I en annen studie, inkludert pasienter med ULTRALYDDIAGNOSTISERT NAFLD og transaminaseøkning, reduserte 300 mg tokotrienoler (en 90:10 delta: gamma-blanding) to ganger daglig i 12 uker signifikant aspartataminotransferase (ASAT), alaninaminotransferase (ALAT), hs-CRP og malondialdehyd (en markør for oksidativt stress) nivåer samt fettleverindeksscore sammenlignet med placebo.
Melketistel
Melketistel (Silybum marianum) er muligens den mest kjente leverbeskyttende botaniske. Silymarin, en blanding av de aktive bestanddelene i melketistel, og silibinin, den mest aktive forbindelsen som finnes i den, har blitt vist i dyreforsøk for å redusere leverskade forårsaket av acetaminofen, alkohol, jernoverbelastning og stråling blant andre kjente levertoksiske stoffer. Silymarin har vist seg å øke nivåene av glutation, en kraftig antioksidant, i både leveren og tarmen. Det reduserer også lipidperoksydasjon, noe som skader cellemembraner, endrer funksjonen og muligens forårsaker celledød.
Silibinin og silymarin har vist seg å aktivere en nukleær gallesyrereseptor kjent som farnesoid X-reseptor (fxr) i leveren, nedregulerende inflammatoriske veier og korrigere insulinresistens og dyslipidemi indusert av høyfett diett (HFD) mating. FXR er en viktig regulator av gallsyre, glukose og lipidbalanse i kroppen. Medisiner som interagerer MED FXR på samme måte som disse melketistelavledede forbindelsene, undersøkes også for behandling AV NAFLD og de relaterte metabolske utfordringene.
Kliniske studier har også vist at melketistel forbedrer ulike parametere forbundet med NAFLD. En 2017 meta-analyse fant at behandling med melketistel reduserer ALAT og ASAT med henholdsvis -5,08 IE/L og -5,44 IE/L hos pasienter med NAFLD. Doser varierte fra 140 mg en gang daglig til 200 mg tre ganger daglig, i en varighet på 8 til 24 uker. Ved den laveste dosen på 140 mg daglig, etter 8 uker, ble det sett signifikante forbedringer i fastende blodsukker( FBG), lipidprofil og seruminsulinnivåer i tillegg til asat og alat-reduksjoner fra 56 til 37.Henholdsvis 77 IE/L og 78,73 TIL 53,05 IE/L.
Berberin
Berberin, orangish-gul alkaloid funnet i planter som Oregon drue rot og bark, goldenseal, og berberis, er en annen botanisk-avledet stoff som har mange mekanismer som det kan bidra til å beskytte MOT NAFLD og støtte sin oppløsning.,,
den antidiabetiske og lipidbalanserende effekten av berberin er vist i flere kliniske studier, og  kan være midler som berberin positivt påvirker leverfunksjonen. Berberin har vist seg å endre metabolismerelatert genuttrykk og gallsyremetabolisme via veier som involverer FXR også. I dyrestudier har berberin vist seg å ha effekt av å forhindre hfd-assosiert fedme og hepatisk triglyseridakkumulering i villtype (normale) mus, men ikke hos de som hadde genetisk eliminering av intestinal fxr-uttrykk. Berberin har også vist seg å undertrykke fedme-assosiert betennelse og hepatisk steatose hos mus ved å redusere fosforylering av det inflammatoriske komplekset kjent som JNK1, en proteinkinase som er involvert i utviklingen av steatohepatitt. JNK1 aktiveres sterkt av miljøstressorer og proinflammatoriske cytokiner.
kan være midler som berberin positivt påvirker leverfunksjonen. Berberin har vist seg å endre metabolismerelatert genuttrykk og gallsyremetabolisme via veier som involverer FXR også. I dyrestudier har berberin vist seg å ha effekt av å forhindre hfd-assosiert fedme og hepatisk triglyseridakkumulering i villtype (normale) mus, men ikke hos de som hadde genetisk eliminering av intestinal fxr-uttrykk. Berberin har også vist seg å undertrykke fedme-assosiert betennelse og hepatisk steatose hos mus ved å redusere fosforylering av det inflammatoriske komplekset kjent som JNK1, en proteinkinase som er involvert i utviklingen av steatohepatitt. JNK1 aktiveres sterkt av miljøstressorer og proinflammatoriske cytokiner.
Berberin virker også i tarmen. Det påvirker ikke bare tarmmikrobialbalansen, men påvirker også tarmpermeabiliteten direkte, og forbedrer tett kryssintegritet hos dyr som er utsatt for endotoksemi eller cellekulturer behandlet med proinflammatoriske cytokiner.Direkte antiinflammatoriske effekter har også blitt påvist.
fordelene med berberin i NAFLD er også vist klinisk i en randomisert, parallellkontrollert, åpen klinisk studie. Hos pasienter MED NAFLD ble berberin vist å gjenopprette normal hepatisk arkitektur, lipid og blodsukkermetabolisme, med signifikante forbedringer sett over befolkningen som bare implementerte livsstilsendringer.
Probiotika
Gitt forholdet mellom de mange fordøyelsessystemforstyrrelser og leverenzym høyde, er det ikke overraskende at probiotika også har blitt studert som en behandling FOR NAFLD. En nylig meta-analyse oppsummerer godt de kollektive funnene.
ett hundre trettifire pasienter diagnostisert MED NAFL/nash ved leverbiopsi ble inkludert i denne analysen, og hver intervensjon som ble brukt i de fire randomiserte, kontrollerte studiene som var kvalifisert for denne meta-analysen, var unik (Lactobacillus bulgaricus og Streptococcus thermophilus i tre måneder; Lactobacillus GG i åtte uker; Bifidobacterium longum og fructooligosaccharides (FOS) i 24 uker; og en proprietær kombinasjon Av Lactobacillus plantarum, L. delbrueckii, l. acidophilus, l. rhamnosus og bifidobacterium bifidum I SEKS MÅNEDER). Dosen av probiotika varierte fra 500 millioner til 12 milliarder kolonidannende enheter (Cfu) daglig. Probiotiske behandlinger ble vist å redusere ALT-og AST-nivåene betydelig med henholdsvis -23,71 UI/L og -19,77 UI/L. Signifikante forbedringer i total kolesterol, tumornekrosefaktor (TNF)-α nivåer og insulinresistens ble også observert.
Ytterligere to kliniske studier undersøkte probiotika som behandling for pediatrisk NAFLD. I en dobbeltblind, placebokontrollert pilotstudie, tolv barn, med en gjennomsnittsalder på 10 år.7 år gammel, med ultralyddiagnostisert fettleverendringer og vedvarende transaminaseøkning, ble gitt 12 milliarder Cfuer Av l. rhamnosus gg eller placebo daglig i 8 uker. Behandling med probiotiske signifikant redusert ALAT nivåer sammenlignet med placebo, men lever ekkogenisitet og ASAT nivåer ikke endres. I tillegg reduserte anti-peptidoglykan-polysakkaridantistoffer, en indikator på bakterier eller bakteriell membrantranslokasjon gjennom tarmbarrieren, signifikant hos barn som fikk probiotisk sammenlignet med placebo. Den andre studien undersøkte behandling av barn som hadde biopsi-bevist NAFLD MED VSL # 3, en høypotensblanding av 8 probiotiske stammer (inkludert Streptococcus thermophilus, 3 Bifidobacteria spp., og 4 Lactobacillus spp.), sammenlignet med placebo. Hos barn som fikk probiotisk ble fettlever score signifikant forbedret med sannsynligheten for at ingen, lett, moderat eller alvorlig fettlever ved slutten av studien var 21%, 70%, 9% og 0% sammenlignet med 0%, 7%, 76% og 17% i placebogruppen.
Konklusjon
det finnes et bredt spekter av sikre og effektive alternativer som støtter gjenopprettelsen av helse hos DE MED NAFLD. Selv om hver enkelt person kan ha forskjellige underliggende mekanismer som bidrar til leverdysfunksjon og inflammatoriske endringer, kan hver av disse støttende naturlige stoffene—og mange andre (Se Tabell 2) – støtte normal leverfunksjon hos personer med disse utfordringene.
Tabell 2: Ernærings-og botaniske tiltak FOR NAFLD. Næringsstoffer som disse bør brukes under veiledning av en kvalifisert og lisensiert helsepersonell.
| Næringsstoff | Dosering | Mekanisme |
| Fosfatidylkolin (PC), en kilde til kostholdig kolin | 1,5 g to ganger daglig med måltider (PC) ELLER 200 mg to ganger daglig (kolin) | Kolin er en vanlig diettmangel. PC er nødvendig for produksjon av galle og beskyttende gastrointestinal mucosa barriere. |
| melk tistel frø | 140 til 200 mg en til tre ganger daglig | Hepatoprotective. Støtter lever glutation nivåer, stabiliserer galle salt eksport pumpe (bsep), og aktiverer FXR veier. |
| Berberin HCl | 500 mg to til tre ganger daglig | Forbedrer serumglukose og lipidprofiler, og reduserer også hepatisk fettinnhold. |
| Probiotika, inkludert stammer Som B. longum, b. bifidum, s. thermophilus, L. rhamnosus, l. acidophilus og L. plantarum | 12 milliarder kolonidannende enheter (Cfuer) daglig | Forbedret tarmepitelbarrierefunksjon og redusert tarm-og systemisk inflammasjon. |
| Acetyl-glutation | 300 mg daglig | Forbedrer avgiftende evne til hepatocytter. |
| N-acetylcystein (NAC) | 500-600 mg to ganger daglig,best tatt på tom mage | nac blokkerer forplantningen av lipidperoksydasjon og støtter hepatisk glutation nivåer. |
| Vitamin e (tokoferoler)
ELLER Tokotrienoler |
400 til 1200 IE daglig med mat
200 til 300 mg to ganger daglig med mat |
Beskyttende antioksidant.
Tocotrienoler demper triglyseridakkumulering ved å regulere fettsyresyntase-og karnitinpalmitoyltransferase-enzymer, noe som fører til reduksjon av leverbetennelse og endoplasmatisk retikulumspenning. |
| Omega-3 essensielle fettsyrer | 2-4 g daglig, med måltider | Omega-3 flerumettede fettsyrer er kjent for å nedregulere sterol regulatorisk elementbindende protein-1c og oppregulere peroksisom proliferatoraktivert reseptor alfa, og dermed favorisere fettsyreoksydasjon og redusere steatose. |