Innledning
Spenning-gated kalium kanaler danner en stor og mangfoldig familie som er evolusjonært bevart. Det er 40 humane spenningsstyrte kaliumkanalgener som tilhører 12 underfamilier. DISSE KV-kanalene viser brede fordelinger i nervesystemet og andre vev. For eksitable celler som nevroner, kardiomyocytter og muskler regulerer KV-kanaler bølgeformen og avfyringsmønsteret av handlingspotensialer. KV-kanaler kan også regulere cellevolum, spredning og migrasjon av et bredt spekter av celletyper.
Spenning-gated kalium (KV) kanaler tilhører en av de største og svært evolusjonært konserverte ion kanal familier . Hver KV-kanal inneholder fire like eller identiske pore-forming α – underenheter, og den kan også inneholde tilleggskanaler som kan påvirke kanalfunksjonen og / eller lokaliseringen . Hver poreformende underenhet av KV-kanaler inneholder seks transmembransegmenter (S1-S6), med de fire første transmembransegmentene (S1-S4) som spenningsføler og de to siste transmembransegmentene som flankerer en poresløyfe (S5-P-S6) som poredomene. I tillegg til kromosomplasseringen av hvert kv-kanalgen i menneske, mus og rotte, har de fysiologiske og farmakologiske egenskapene til kanalen og dens vevsfordeling og patofysiologi blitt gitt Av Ionkanaldatabasen av Underkomiteen For Spenningsstyrte kaliumkanaler I Nomenklaturkomiteen For International Union Of Pharmacology (NC-IUPHAR). Denne artikkelen presenterer en introduksjon til mangfoldet og funksjonene til spenningsstyrte kaliumkanaler.
Evolusjonær bevaring av kaliumkanaler
K+-selektiviteten som oppsto i prokaryoter, er bevart i et stort antall kaliumkanaler med bemerkelsesverdig mangfold . Som vist i Figur 1, et evolusjonært tre av spenning-gated kation kanal superfamily kan foreslås basert på sammenligning av kanalgener i det menneskelige genom med de i genomene til andre metazoans inkludert mus, kylling, puffer fisk, tunicate, bananflue, mygg, nematode og sjøanemone . Dette evolusjonære treet ser for seg en enkelt opprinnelse Av K + – selektiviteten for innadrettede kaliumkanaler (Kir), spenningsstyrte kaliumkanaler (KV) og to-porekaliumkanaler(K2P). Det er imidlertid viktig å merke seg at en tydelig K + – selektivitet sannsynligvis er forbundet med den evolusjonært konserverte organelle k+ – kanalen som ligger i endosomer og lysosomer .
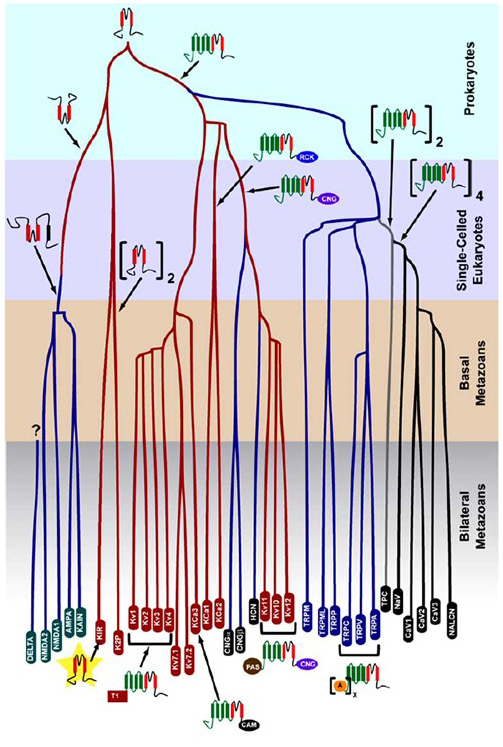
Figur 1. Et evolusjonært tre for genesis av spenning-gated kation kanal superfamily. Basert på genom-brede analyser av ionekanaler fra cnidarians og bilaterale metazoans , viser dette evolusjonære treet en felles opprinnelse For k + – selektiviteten til kaliumkanaler( med familienavn i røde ovaler), som er relatert til tetramere sykliske nukleotidstyrte kationkanaler (CNG), hyperpolariseringskontrollerte kationkanaler (HCN) og TRP-kanaler, de dimere tpc-kanalene Og De Monomere Na+, Ca2+ og NALCN-kanalene. Grenlengdene reflekterer ikke tiden. Genfamilienavnene nederst markerer individuelle grener. Ionotrope glutamatreseptorer er inkludert basert på hypotesen om at de stammer fra en inversjon av kaliumkanalporeformende domene med to transmembrane segmenter (rød). Spenningsfølerdomenet har fire transmembrane segmenter (grønn). A: ankryin gjentar; CAM: calmodulin-bindende domene; CNG: syklisk nukleotidbindende domene; PAS: PER-ARNT-Sim domene; RCK: regulator for konduktans Av K + domene; T1: tetramerization domene.
Mangfold av spenningsstyrte kaliumkanaler
det menneskelige genom inneholder ~80 kaliumkanalgener hvorav 40 gener koder for spenningsstyrte kaliumkanalporeformende underenheter som faller inn i 12 underfamilier (Fig . 2). Fysiologisk oppdelt I a-type kaliumkanaler som viser rask inaktivering og forsinkede likeretterkaliumkanaler uten rask inaktivering, er DISSE KV-kanalene molekylært og funksjonelt varierte. Rask inaktivering, som kan påvirke aksjonspotensialets varighet under repeterende avfyring, er tydelig I KV1-kanaler som inneholder KV1.4 Eller Kvß 1, KV3 kanaler og KV4 kanaler . Den forsinkede likeretter kalium gjeldende opprinnelig preget Av Hodgkin Og Huxley for sin rolle i aksjon potensial sannsynlig tilsvarer blekksprut KV1 kanaler som kan stole PÅ RNA redigering for å oppnå den fleksible funksjonelle mangfold som mange små aksoner av de gigantiske fiber lobe nevroner sikring for å danne blekksprut gigantiske axon med større aksjonspotensial ledningsrate .
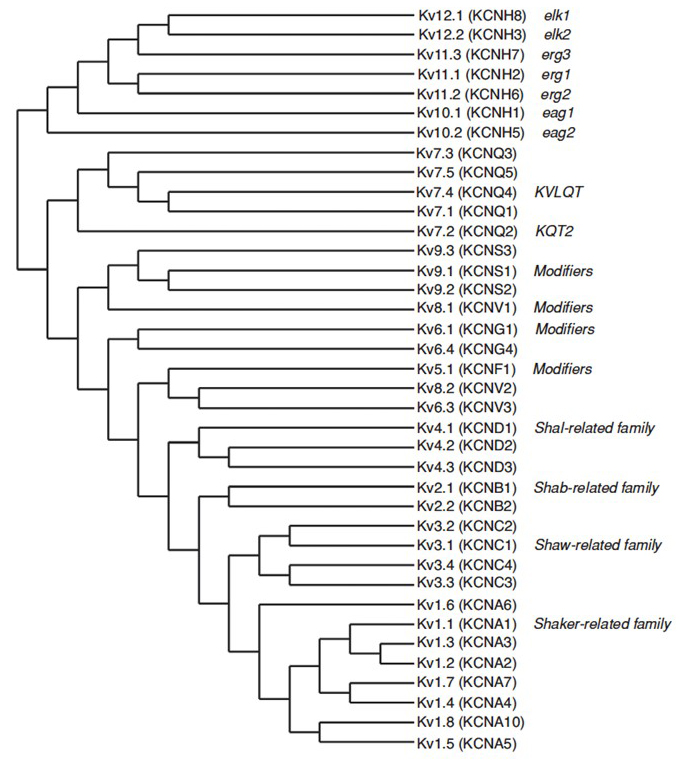
Figur 2. Fylogenetisk tre FOR KV1-12 familier. Dette fylogenetiske treet genereres basert på analyser av det hydrofobe domenet som inneholder de seks transmembrane segmentene (S1-S6). Både IUPHAR og HGNC (i parentes) navnene er vist, sammen med andre vanlige navn for disse spenningsstyrte kaliumkanaler.
Bemerkelsesverdig mangfold AV KV kanaler kan oppnås på grunn AV miks OG match AV KV kanal underenheter. Innenfor hver AV KV1 -, KV2 -, KV3 -, KV4-og KV7-familiene kan homomere og heteromere kanaler dannes med en rekke funksjonelle egenskaper . KV2 familiemedlemmer kan også samle MED KV5, KV6, KV8 ELLER KV9 familiemedlemmer med mer begrensede uttrykksmønstre i nervesystemet og glatte muskler , som illustrert skjematisk I Fig. 3.

Figur 3. KV kanal mangfold via miks og match av pore-forming kanal underenheter. (A) de tetrameriske KV-kanalene med forskjellige egenskaper og distribusjon omfatter homomere KV1, KV2, KV3, KV4 og KV7-kanaler, heteromere kanaler dannet av forskjellige medlemmer innenfor hver AV DISSE kv-kanalfamiliene, og heteromere kanaler dannet ved montering AV KV2-familiemedlemmer MED KV5, KV6, KV8 eller KV9-familiemedlemmer . KV5, KV6, KV8 OG KV9 familier gir opphav til homomere kanaler som er elektrisk stille sannsynlig på grunn av deres oppbevaring i endoplasmatisk retikulum, derfor er DE referert TIL SOM KVS. (B) Sammenstilling AV KV2-og KVS-familiemedlemmer involverer deres cytoplasmatiske n-og C-terminale domener. (C, D) Montering AV kv2 og KVS familiemedlemmer gir opphav til heteromere kanaler med forskjellig spenningsavhengighet (C) og gating mekanismer (D) i forhold til homomere kanaler dannet AV KV2 familiemedlemmer .
Funksjonelle forskjeller i spenningsavhengighet OG kinetikk AV KV-kanaler ligger til grunn for deres differensielle bidrag til handlingspotensial modulering (Fig. 4). MENS kv1 -, KV4-og KV7-kanaler krever lave nivåer av membrandepolarisering for aktivering, aktiveres KV2-og KV3-kanaler ved større depolarisering. Den tidligere, lav spenning aktivert, KV kanaler kan påvirke terskelen for aksjonspotensial generasjon og antall aksjonspotensialer generert under depolarisering eller eksitatoriske synaptiske potensialer. I kontrast kan de høyspente aktiverte KV-kanalene modulere aksjonspotensialets varighet og avfyringsmønster . Kinetikken TIL KV-kanaler påvirker også måtene de bidrar til handlingspotensialgenerering. Mens LAV spenning aktivert KV1 kanaler med rask aktivering kan påvirke aksjonspotensial terskel og bølgeform, høy spenning aktivert KV3 kanaler OG KV2 kanaler kan aktiveres sekvensielt under en aksjon potensial på grunn av forskjellen i deres aktivering kinetikk, OG KV2 kanaler kan ha mer langvarige effekter på grunn av deres langsom inaktivering kinetikk. VIDERE KAN KV4-kanaler med rask inaktivering bidra til forskjellen i aksjonspotensialet bølgeform under repeterende avfyring, på grunn AV undertrykkelse AV KV4-kanalaktiviteten ved depolarisering .
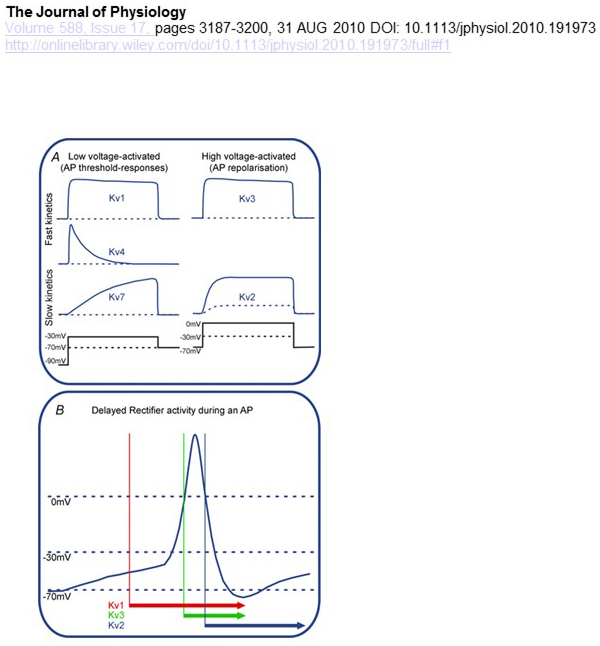
Figur 4. Funksjonelle forskjeller I kv-kanaler og deres bidrag til handlingspotensialet. (A) Forskjellige kv-kanaler har forskjellig spenningsavhengighet for aktivering og forskjellig kinetikk . (B) lav spenning aktivert KV1 kanaler med rask kinetikk åpne som cellen er depolarisert mot terskelen for aksjonspotensial generasjon. MENS BÅDE KV2 og KV3 kanaler er høyspent aktivert, ÅPNER KV3 kanaler raskere ENN KV2 kanaler under et aksjonspotensial. KV2-kanaler kan også ta lengre tid å lukke etter et handlingspotensial .
Potensielle terapeutiske anvendelser av kaliumkanalmodulatorer
evnen til kaliumkanalmodulatorer til å endre handlingspotensial avfyringsmønstre har reist spørsmålet om de kan være av terapeutisk verdi . Som angitt I Fig. 5, ulike nevrologiske og psykiske lidelser kan innebære endringer i handlingspotensialet avfyringsmønstre, som kan moduleres AV KV – kanalaktivatorer og blokkere . Spenningsstyrte kaliumkanaler kan også spille en rolle i celleproliferasjon og migrasjon; KV kanal modulatorer har derfor blitt vurdert for potensielle behandlinger av kreft vekst og metastase . I Fig. 6, KV1. 2 kanalstrukturen brukes skjematisk for å illustrere AT KV-kanalmodulatorer kan hemme kanalaktivitet enten ved å okkludere kanalgjennomtrengningsbanen, som i tilfelle av ytre-pore-blokkerende toksiner og indre poreblokkere, eller via deres interaksjon med spenningssensoren for å stabilisere kanalens lukkede tilstand, som i tilfelle av gating modifier-toksiner. Alternativt virker noen små molekyler ved å binde seg til gatemaskineriet som gatemodifikatorer, eller ved å samhandle med grensesnittet mellom α-og β-underenhetene for å endre kanalaktiviteten .
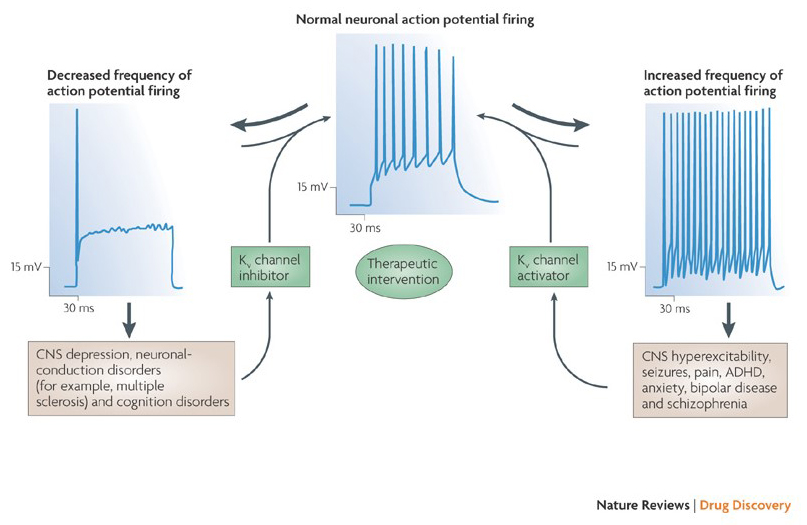
Figur 5. Potensielle anvendelser AV KV kanal modulatorer. Fordi unormale virkningspotensiale fyringsmønstre har vært forbundet med sykdommer som epilepsi og multippel sklerose, HAR KV-kanalaktivatorer og-hemmere blitt vurdert for potensiell terapeutisk behandling av sykdommer som involverer endring av nevronal eksitabilitet .
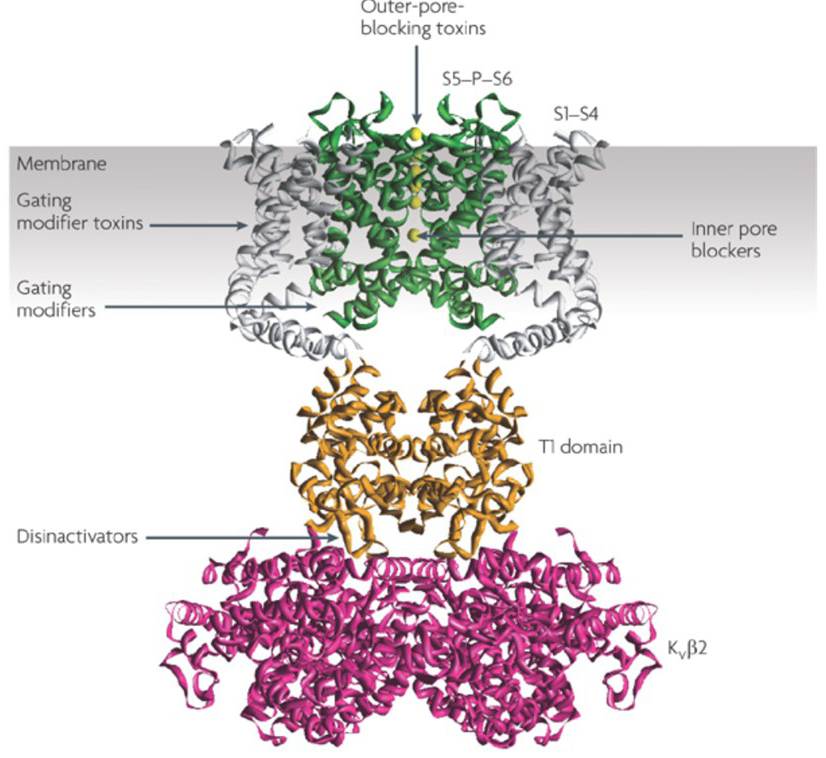
Figur 6. Eksempler på virkningsmåter AV KV kanal modulatorer. Det er flere forskjellige måter for peptidtoksiner og små molekyler å modulere KV – kanalaktivitet. KV1. 2-strukturen er vist med poredomenene (S5-P-S6) i grønt, spenningssensordomenene (S1-S4) i grått, t1-tetramerizasjonsdomenene i oransje og kvß 2 hjelpeunderenheter i magenta . Ytre poreblokkerende toksiner fra skorpioner, sjøanemoner, slanger og kjeglesnegler kan binde seg til ytre vestibulen og blokkere ion-gjennomtrengning. Gating modifier giftstoffer fra edderkopper som hanatoksin kan samhandle med spenningssensoren for å øke stabiliteten i lukket tilstand, forårsaker høyre skift av spenningsavhengighetskurven for kanalaktivering. Det er også små molekylkanalmodulatorer som binder seg til de indre poreblokkerne, gatehengslene( gatemodifikatorer) eller grensesnittet mellom de α – og β-underenhetene (disinaktivatorer) .
Spenningsstyrt kaliumkanalstruktur
den bemerkelsesverdige selektiviteten til kaliumkanaler, som gjør Det mulig For k+-ioner å gå gjennom kanalporen med størrelsesordener større letthet enn De mindre Na+-ionene Og med nær diffusjonsbegrenset hastighet , forklares av ryggradskarbonylene i selektivitetsfilteret for å koordinere K+ – ioner som i stor grad er fjernet av deres hydratiseringsskjell , slik at mer Enn En k+ – ion vil bevege seg gjennom dette smaleste segmentet av kanalen.pore i tandem (fig. 7 – – en lang pore for enkeltfil K + ion permeasjon som betinget .
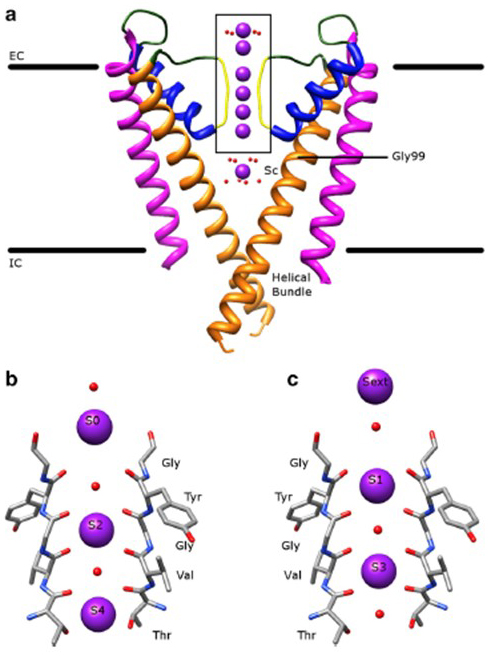
Figur 7. Pore-domenet til kaliumkanaler. (A) Struktur Av KcsA i ledende tilstand (PDB: 1K4C) , med ytre helikser i magenta, indre helikser i oransje, porehelikser i blått og selektivitetsfilteret i gult. K + – ioner er i lilla mens de omkringliggende vannmolekylene er i rødt. EC: ekstracellulær; ic: intracellulær. (b, c) selektivitet filteret i eske regionen KcsA strukturen er vist Med K+ ioner opptar Enten S2 Og S4 posisjoner (b) eller s1 og S3 posisjoner (c), for å illustrere k+ ion permeasjon i enkelt fil .
spenningsavhengigheten AV kv-kanalaktivering kommer fra deres spenningssensordomener . Som vist I Fig. 8, KV kanaler og relaterte kanaler som spenning-gated natrium kanaler OG TRPV1 kanaler i samme superfamily har lignende arrangementer av deres pore domener og spenning sensor domener. Spenningssensordomenet til en underenhet interagerer med poredomenet til en nærliggende underenhet i en domenebyttekonfigurasjon, og i en spenningssensor kan de positivt ladede argininrester På S4 interagere med negativt ladede sure rester i nabohelikser (Fig. 9).
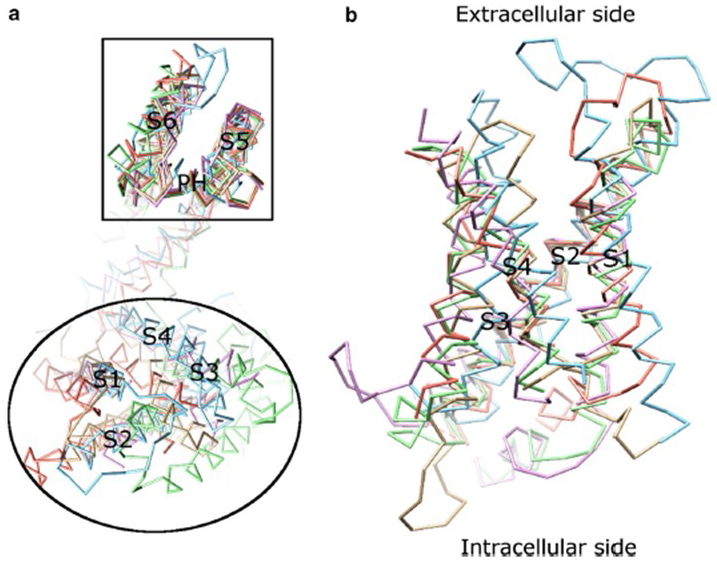
Figur 8. Spenningssensordomenet til spenningsstyrte kaliumkanaler. (A) Justering av poredomenet (S5-P-S6) av forskjellige ionkanaler avslører at deres spenningssensordomener (S1-S4) kan ta på seg en rekke orienteringer (sett fra den ekstracellulære siden). (b) Overlapping av spenningssensordomenet TIL KV1.2 (PDB: 3LUT, lys magenta) med spenningssensordomenene Til MlotiK1 (PDB: 3beh, lysebrun) , NaVAb (PDB: 3rvy, lysegrønn) , NaVRh (PDB: 4DXW, lys oransje) og TRPV1 (PDB: 3j5p, lyseblå) (sett fra membranen) .
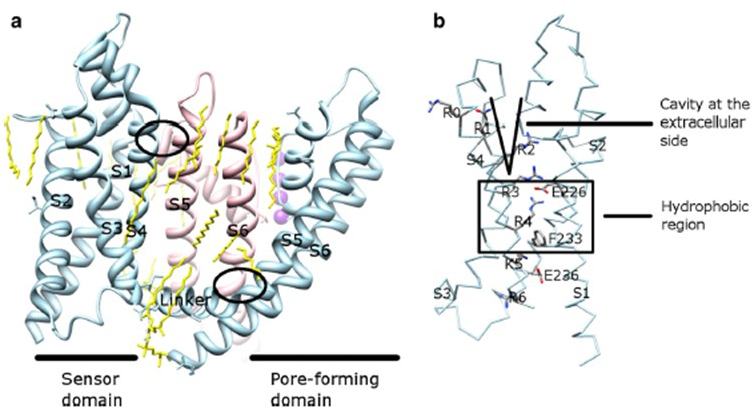
Figur 9. Kontakter mellom pore-domenet og spenningsfølerdomenet TIL KV-kanaler. (A) KV1. 2-KV2.1 chimera (PDB: 2R9R) med spenningssensordomenet til en underenhet (lyseblå) som kontakter poredomenet til en nærliggende underenhet (rosa). Kontaktene på den intracellulære siden involverer samspillet Mellom s4-s5 linker Med S6, og kontaktene på den ekstracellulære siden involverer samspillet Mellom S1 og porehelixen . Lipider (gul) som omgir kanalen og mellom poredomenet og spenningssensordomenet, kan påvises i krystallstrukturen. (B) Grunnleggende rester Av S4 og sure rester i n rheten i spenningssensordomenet .
Kanalopatier knyttet Til Spenningsstyrte kaliumkanaler
Spenningsstyrte kaliumkanaler uttrykkes bredt i en rekke vev. I nevroner er de rettet mot ulike subcellulære rom(Fig. 10), og kanaler med forskjellige underenheter kan være tilstede i forskjellige underpopulasjoner av nevroner . Mutasjoner AV kv-kanalgener kan forårsake nevrologiske sykdommer som episodisk ataksi og epilepsier, hjertesykdommer og døvhet . Evolusjonær bevaring AV kv kanal funksjon er tydelig, for eksempel fra lignende bevegelsesforstyrrelser forårsaket av mutasjon AV KV1 orthologs i menneske, mus, og bananflue .
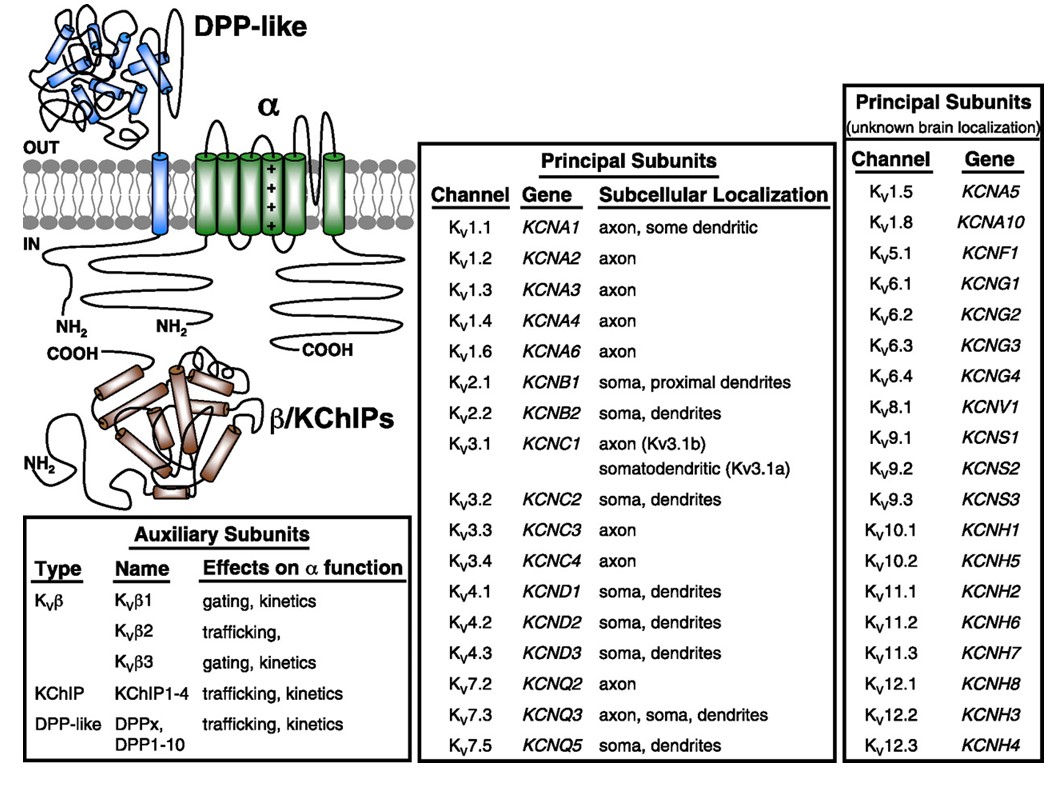
Figur 10. Subcellulær fordeling av spenningsstyrte kaliumkanaler. Skjematisk øverst til venstre viser EN KV4 kanal med to forskjellige hjelpeunderenheter. Subcellulær lokalisering AV ULIKE kv-kanaler i pattedyrs sentrale nevroner er angitt i midtboksen .
Referanser og noter
1.Hille, B., Ioniske Kanaler Av Spennende Membraner, 3rd, Ed. 2001: Sinauer Associates Inc.
2.Jenssen, C., et al., K (+) kanaler: funksjon-strukturell oversikt. Compr Physiol, 2012. 2 (3): s. 2087-149.
3.Vacher, H., D. P. Mohapatra og J. S. Trimmer, Lokalisering og målretting av spenningsavhengige ionekanaler i pattedyrs sentrale nevroner. Physiol Rev, 2008. 88 (4): s. 1407-47.
4.Jegla, T. J., et al., Evolusjon av det menneskelige ionkanalsettet. Comb Chem Høy Gjennomstrømning Skjerm, 2009. 12 (1): s. 2-23.
5.Jørgensen, C., et al., TMEM175 Er En Organell K (+) Kanal Som Regulerer Lysosomal Funksjon. Celle, 2015. 162 (5): s. 1101-12.
6.Hodgkin, Al Og A. F. Huxley, Strømmer båret av natrium – og kaliumioner gjennom membranen Til Den gigantiske axonen Av Loligo. J Physiol, 1952. 116 (4): s. 449-72.
7.Rosenthal, J. J., T. I. Liu, Og W. F. Gilly, en familie av forsinket likeretter KV1 cDNAs viser celletypespesifikt uttrykk i blekksprut stellate ganglion / giant fiber lobe complex. J Neurosci, 1997. 17 (13): s. 5070-9.
8.Young, Jz, Smeltet nevroner og synaptiske kontakter i de gigantiske nervefibrene av blæksprutte. Phil Trans R Soc Lond B, 1939. 229: s. 465-503.
9.Rosenthal, Jj Og F. Bezanilla, Omfattende redigering av mrna for squid forsinket likeretter K+ kanal regulerer underenhet tetramerisering. Neuron, 2002. 34 (5): s. 743-57.
10.Jan, L. Y. Og Y. N. Jan, Spenningsstyrte kaliumkanaler og mangfoldet av elektrisk signalering. J Physiol, 2012. 590 (11): s. 2591-9.
11.Johnston, J., I. D. Forsythe, Og C. Kopp-Scheinpflug, Går innfødt: spenningsstyrte kaliumkanaler som styrer neuronal excitabilitet. J Physiol, 2010. 588 (Pt 17): s. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8 og KV9 underenheter: Ingen enkle stille tilskuere. J Gen Physiol, 2016. 147 (2): s. 105-25.
13.Wulff, H., Na Castle, Og La Pardo, Spenningsstyrte kaliumkanaler som terapeutiske mål. Nat Rev Narkotika Discov, 2009. 8 (12): s. 982-1001.
14.Bates, E. Ionekanaler i utvikling og kreft. Annu Rev Celle Dev Biol, 2015. 31: s. 231-47.
15.Huang, X. Og L. Y. Jan, Rettet mot kaliumkanaler i kreft. J Celle Biol, 2014. 206 (2): s. 151-62.
16.Huang, X., et al., EAG2 kaliumkanal med evolusjonært bevart funksjon som hjernesvulstmål. Nat Neurosci, 2015. 18 (9): s. 1236-46.
17.Kunzelmann, K., Ionekanaler og kreft. J Membr Biol, 2005. 205 (3): s. 159-73.
18.Li, M. Og Zg Xiong, Ionekanaler som mål for kreftbehandling. Int J Physiol Patofysiol Pharmacol, 2011. 3 (2): s. 156-66.
19.Pardo, L. A., Spenningsstyrte kaliumkanaler i celleproliferasjon. Fysiologi (Bethesda), 2004. 19: s. 285-92.
20.Urrego, D., et al. Kaliumkanaler i cellesyklus og celleproliferasjon. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): s. 20130094.
21.Jørgensen, J., et al., Kjemi av ionkoordinasjon og hydrering avslørt Av Et k + kanal-fab-kompleks ved 2,0 a oppløsning. Natur, 2001. 414 (6859): s. 43-8.
22.MacKinnon, R., Kaliumkanaler. FEBS Lett, 2003. 555 (1): s. 62-5.
23.Kuang, Q., P. Purhonen, Og H. Hebert, Struktur av kaliumkanaler. Cell Mol Livet Sci, 2015. 72 (19): s. 3677-93.
24.Isacoff, E. Y., L. Y. Jan, Og D. L. Minor, Jr., Rør av livets gnist: et perspektiv på ionkanalforskning siden fødselen av neuron. Neuron, 2013. 80 (3): s. 658-74.
25.Swartz, Kj, Sensing spenning over lipid membraner. Natur, 2008. 456 (7224): s.891-7.
26.Nusser, Z., Differensial subcellulær fordeling av ionekanaler og mangfoldet av nevronfunksjon. Curr Opin Neurobiol, 2012. 22 (3): s. 366-71.
27.Lujan, R., Organisering av kaliumkanaler på nevronoverflaten. J Chem Neuroanat, 2010. 40 (1): s. 1-20.
28.Abriel, H. Og E. V. Zaklyazminskaya, Hjertekanalpatier: genetiske og molekylære mekanismer. Gene, 2013. 517 (1): s. 1-11.
29.Kullmann, Dm Og Mg Hanna, Nevrologiske lidelser forårsaket av arvelige ionkanalmutasjoner. Lancet Neurol, 2002. 1 (3): s. 157-66.
30.Lehmann-Horn, F. Og K. Jurkat-Rott, Spenningsstyrte ionekanaler og arvelig sykdom. Physiol Rev, 1999. 79 (4): s. 1317-72.
31.Villa, C. og R. Combi, Kaliumkanaler Og Humane Epileptiske Fenotyper: En Oppdatert Oversikt. Frontcelle Neurosci, 2016. 10: s. 81.
32.Long, S. B., E. B. Campbell og R. Mackinnon, Krystallstruktur av en pattedyrspenningsavhengig Shaker familie K + kanal. Vitenskap, 2005. 309 (5736): s.897-903.
33.Chen, X., et al., Struktur av full lengde Shaker kaliumkanal KV1.2 ved normal modus-basert røntgenkrystallografisk forfining. Proc Natl Acad Sci Usa, 2010. 107 (25): s. 11352-7.
34.Clayton, G. M., et al., Struktur av transmembrane regioner av en bakteriell syklisk nukleotid-regulert kanal. Proc Natl Acad Sci Usa, 2008. 105 (5): s. 1511-5.
35.Trueblood, J., et al., Krystallstrukturen til en spenningsstyrt natriumkanal. Natur, 2011. 475 (7356): s. 353-8.
36.Jørgensen, J., et al., Krystallstruktur av en orthologue Av nachbac spenningsstyrt natriumkanal. Natur, 2012. 486 (7401): s. 130-4.
37.Liao, M., et al., Struktur av trpv1 ionekanalen bestemt av elektronkryo-mikroskopi. Natur, 2013. 504 (7478): s. 107-12.
38.Lang, S. B., et al., Atomstruktur av en spenningsavhengig k + kanal i et lipidmembranlignende miljø. Natur, 2007. 450 (7168): s. 376-82.