reactiesnelheid
variatie van snelheid wanneer u het halogeen verandert
reactiesnelheid neemt toe in de volgorde HF-HCl-HBr-HI. Waterstoffluoride reageert veel langzamer dan de andere drie, en wordt normaal gesproken genegeerd bij het praten over deze reacties.
wanneer de waterstofhalogeniden reageren met alkenen, moet de waterstof-halogeenbinding worden verbroken. De bindingssterkte daalt als je van HF naar HI gaat, en de waterstof-fluor binding is bijzonder sterk. Omdat het moeilijk is om de band tussen waterstof en fluor te verbreken, is de toevoeging van HF gebonden traag.
variatie van snelheden wanneer u de alkeen
wijzigt, geldt dit zowel voor asymmetrische alkenen als voor symmetrische alkenen. Voor de eenvoud zijn de onderstaande voorbeelden allemaal symmetrisch, maar dat hoeft niet.
de reactiesnelheid neemt toe naarmate het alkeen ingewikkelder wordt – in de zin van het aantal alkylgroepen (zoals methylgroepen) dat aan beide uiteinden van de dubbele binding aan de koolstofatomen vastzit. Bijvoorbeeld::
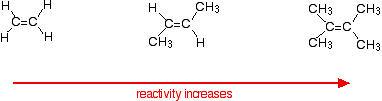
er zijn twee manieren om naar de redenen hiervoor te kijken – beide moeten je weten over het mechanisme voor de reacties.
alkenen reageren omdat de elektronen in de pi-binding dingen aantrekken met enige mate van positieve lading. Alles wat de elektronendichtheid rond de dubbele binding verhoogt, zal dit helpen.
alkylgroepen hebben de neiging om elektronen van zichzelf weg te” duwen ” naar de dubbele binding. Hoe meer alkylgroepen je hebt, hoe negatiever de oppervlakte rond de dubbele bindingen wordt.
hoe negatiever dat gebied wordt, hoe meer het moleculen zoals waterstofchloride aantrekt.
de belangrijkste reden ligt echter in de stabiliteit van het intermediaire ion dat tijdens de reactie wordt gevormd. De drie bovengenoemde voorbeelden produceren deze carboniumionen in het halve stadium van de reactie:
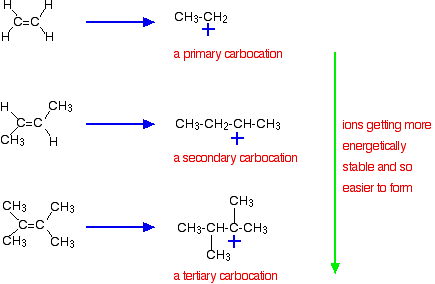
de stabiliteit van de intermediaire ionen bepaalt de activeringsenergie voor de reactie. Als je naar de meer gecompliceerde alkenen gaat, valt de activeringsenergie voor de reactie. Dat betekent dat de reacties sneller worden.