de glucose-alanine cyclus, of Cahill cyclus, voor het eerst voorgesteld door Mallette, Exton and Park, en Felig et al. tussen 1969 en 1970 bestaat uit een reeks stappen waardoor extrahepatische weefsels, bijvoorbeeld de skeletspieren, pyruvaat-en aminogroepen als alanine naar de lever exporteren en via de bloedbaan glucose uit de lever ontvangen.
de belangrijkste stappen van de glucose-alanine cyclus worden hieronder samengevat.
- wanneer in extrahepatische weefsels aminozuren voor energie worden gebruikt, wordt pyruvaat, afgeleid van glycolyse, gebruikt als aminogroepacceptor, waarbij alanine, een niet-essentieel aminozuur, wordt gevormd.
- Alanine verspreidt zich in de bloedbaan en bereikt de lever.
- in de lever wordt de aminogroep van alanine overgebracht naar α-ketoglutaraat om respectievelijk pyruvaat en glutamaat te vormen.
- de aminogroep van glutamaat komt meestal in de ureumcyclus en werkt gedeeltelijk als stikstofdonor in vele biosynthetische routes.
pyruvaat gaat de gluconeogenese in en wordt gebruikt voor glucosesynthese. - de nieuw gevormde glucose diffundeert in de bloedbaan en bereikt de perifere weefsels waar, als gevolg van glycolyse, wordt omgezet in pyruvaat dat aminogroepen uit de vrije aminozuren kan accepteren, waardoor de cyclus wordt afgesloten.
daarom biedt de glucose-alaninecyclus een verband tussen het koolhydraatmetabolisme en het aminozuur, zoals hieronder schematisch beschreven.
Glucose → pyruvaat → Alanine → pyruvaat → Glucose
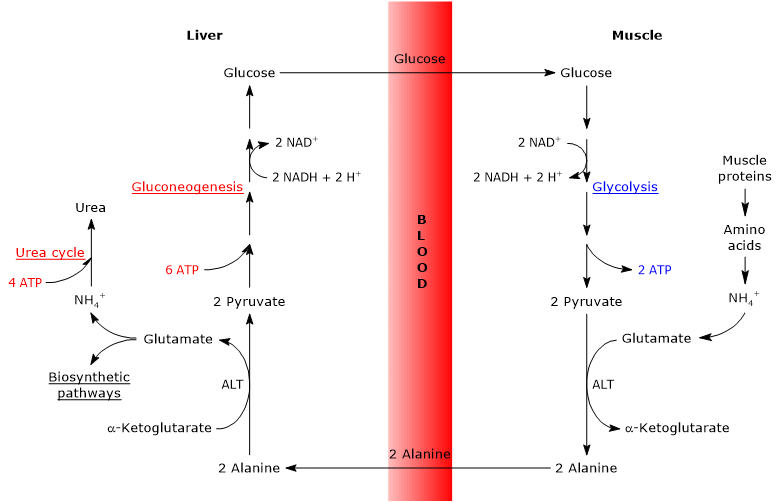
de glucose-alanine-cyclus vindt niet alleen plaats tussen de skeletspier, het eerste weefsel waarin het werd waargenomen, en de lever, maar ook bij andere cellen en extrahepatische weefsels, waaronder cellen van het immuunsysteem, zoals lymfoïde organen.
INHOUD
- De stappen van de glucose-alanine cyclus
- De Cahill cyclus in de skeletspieren
- De Cahill cyclus in de lever
- Transaminasen
- Functies van de glucose-alanine cyclus
- Energie kosten van de glucose-alanine cyclus
- Overeenkomsten en verschillen tussen Cahill cyclus en de Cori-cyclus
De stappen van de glucose-alanine cyclus
De analyse van de stappen van de glucose-alanine cyclus is gemaakt uitgaande van de cyclus tussen de skeletspieren en de lever.
zowel intracellulaire als extracellulaire eiwitten worden continu gehydrolyseerd tot de samenstellende aminozuren en opnieuw gesynthetiseerd, en de snelheid waarmee deze processen plaatsvinden is nauwkeurig in evenwicht, waardoor verlies van vetvrije massa wordt voorkomen.
echter, onder katabole omstandigheden, zoals intensieve en langdurige lichaamsbeweging of vasten, is de snelheid waarmee spiereiwitten worden afgebroken groter dan de synthese. Dit leidt tot de bevrijding van aminozuren, waarvan sommige voor energie en anderen voor gluconeogenese worden gebruikt. En de oxidatie van de koolstofskeletten van aminozuren, in het bijzonder vertakte aminozuren of BCAA (leucine, isoleucine en valine), kan een belangrijke energiebron voor de spier zijn. Bijvoorbeeld, na ongeveer 90 minuten van zware inspanning, aminozuuroxidatie in spier verstrekt 10-15% van de energie die voor contractie nodig is.
het gebruik van de koolstofskeletten van aminozuren voor energie impliceert de verwijdering van de aminogroep en vervolgens de uitscheiding van aminostikstof in een niet-toxische vorm.
de verwijdering van de α-aminogroep vindt plaats door transaminatie, die als volgt kan worden samengevat:
α-ketozuur + aminozuur ⇄ Nieuw aminozuur + nieuw α-ketozuur
dergelijke reacties, gekatalyseerd door enzymen die aminotransferasen of transaminasen (EC 2.6.1) worden genoemd, zijn vrij reversibel.
vertakte aminozuren brengen bijvoorbeeld de aminogroep over in α-ketoglutaraat of 2-oxoglutaarzuur, om glutamaat te vormen en het α-ketozuur afgeleid van het oorspronkelijke aminozuur, in een reactie gekatalyseerd door vertakte aminotransferase of BCAT (EC 2.6 .1.42).
de Cahill-cyclus in skeletspieren
in skeletspieren kan het nieuw gevormde glutamaat reageren met ammoniak om glutamine te vormen, voor veel weefsels en organen, zoals de hersenen, het belangrijkste middel voor interorgan transport van stikstof. De reactie wordt gekatalyseerd door het cytosolic enzym glutamine synthetase (EC 6.3.1.2), en verbruikt een ATP.
glutamaat + NH4 + + ATP → Glutamine + ADP + Pi
in dit geval verlaat glutamaat de Cahill-cyclus.
als alternatief, en in tegenstelling tot wat in de meeste andere weefsels gebeurt, kan het nieuw gevormde glutamaat de aminogroep overdragen naar pyruvaat, afgeleid van glycolyse, om zo alanine en α-ketoglutaraat te vormen. Deze transaminatie wordt gekatalyseerd door alanineaminotransferase of ALT (EC 2.6.1.2), een enzym dat in de meeste dierlijke en plantaardige weefsels wordt gevonden.
glutamaat + pyruvaat Alan Alanine + α-ketoglutaraat
het alanine dat wordt geproduceerd en dat rechtstreeks afkomstig is van eiwitafbraak, en spiereiwitten zijn rijk aan alanine, kunnen de cel verlaten en door de bloedbaan naar de lever worden vervoerd; op deze manier bereikt de aminogroep de lever. En de snelheid waarmee alanine gevormd door transaminatie van pyruvaat wordt overgebracht in de circulatie is proportioneel aan de intracellulaire pyruvaatproductie.
NB: Alanine en glutamine zijn de belangrijkste bronnen van stikstof en koolstof in het aminozuurmetabolisme tussen organen.
de Cahill-cyclus in de lever
eenmaal in de lever katalyseert een hepatische alanineaminotransferase een transaminatie waarbij alanine, het belangrijkste gluconeogene aminozuur, fungeert als aminogroepdonor en α-ketoglutaraat als een α-ketozuuracceptor. De producten van de reactie zijn pyruvaat, d.w.z. het koolstofskelet van alanine, en glutamaat.
Alanine + α-ketoglutaraat Glut glutamaat + pyruvaat
glutamaat, in de reactie gekatalyseerd door glutamaatdehydrogenase (EC 1.4.1.2), een enzym huidig in de mitochondrial matrix, vormt ammoniumion, dat de ureumcyclus ingaat, en α-ketoglutaraat, die de Krebs-cyclus kan ingaan. Deze reactie is een anaplerotic reactie die aminozuurmetabolisme met de cyclus Krebs verbindt.
glutamaat + H2o+ NAD + α α-ketoglutaraat + NH4 + + NADH + h +
glutamaat kan echter ook reageren met oxaloacetaat om aspartaat en α-ketoglutaraat te vormen, in een reactie die gekatalyseerd wordt door aspartaataminotransferase (EC 2.6.1.1). Aspartaat is betrokken bij de vorming van ureum en bij de synthese van purines en pyrimidines.
glutamaat + Oxaloacetaat ⇄ aspartaat + α-ketoglutaraat
ook het geproduceerde pyruvaat kan een ander metabolisch lot hebben: het kan worden geoxideerd voor ATP-productie, waarna het de glucose-alanine-cyclus verlaat of de gluconeogeneseroute ingaat en zo verder gaat in de cyclus.
het geproduceerde glucose komt uit de lever vrij in de bloedbaan en wordt afgegeven aan verschillende weefsels die het nodig hebben, zoals de skeletspieren, waarin het wordt gebruikt voor pyruvaatsynthese. Op zijn beurt, kan nieuw gevormde pyruvate met glutamaat reageren, waarbij de cyclus wordt gesloten.
transaminasen
zoals eerder vermeld, vindt de verwijdering van de aminogroep uit aminozuren plaats door transaminatie (zie hierboven voor de algemene reactie). Deze reacties worden gekatalyseerd door enzymen die aminotransferasen of transaminasen worden genoemd.
het zijn cytosolische enzymen, aanwezig in alle cellen en met name overvloedig aanwezig in de lever, de nieren, de darmen en de spieren; ze hebben pyridoxaalfosfaat of PLP, de actieve vorm van vitamine B6 of pyridoxine, nodig als co-enzym, dat sterk aan de actieve plaats gebonden is.
bij transaminatiereacties wordt de aminogroep van vrije aminozuren, met uitzondering van threonine en lysine, gekanaliseerd naar een klein aantal α-ketozuren, met name pyruvaat, oxaloacetaat en α-ketoglutaraat.
cellen bevatten verschillende typen aminotransferasen: veel cellen zijn specifiek voor α-ketoglutaraat Als α-ketozuuracceptor, maar verschillen in specificiteit voor het aminozuur, waarvan ze zijn genoemd. De voorbeelden zijn bovengenoemde alanine aminotransferase, ook genoemd alanine transaminase en glutamic pyruvic transferase of GPT, en Aspartate aminotransferase of AST, ook genoemd glutamic-oxaloacetic transaminase of GOT.
er moet worden onderstreept dat er geen netto-deaminatie in deze reacties optreedt, geen verlies van aminogroepen, aangezien de α-keto-zuuracceptor is geamineerd en het aminozuur gedeamineerd.
functies van de glucose-alaninecyclus
deze cyclus heeft verschillende functies.
- het transporteert stikstof in een niet-toxische vorm van perifere weefsels naar de lever.
- het transporteert pyruvaat, een gluconeogeen substraat, naar de lever.
- Het verwijdert pyruvaat uit perifere weefsels. Dit leidt tot een hogere productie van ATP van glucose in deze weefsels. In feite, kan NADH tijdens glycolyse geproduceerd mitochondria ingaan en door oxidatieve phosphorylation worden geoxideerd.
- het maakt het mogelijk een relatief hoge concentratie alanine in hepatocyten te handhaven, voldoende om de eiwitafbraak te remmen.
- het kan een rol spelen bij de verdediging van de gastheer tegen infectieziekten.
ten slotte is het belangrijk te benadrukken dat er geen netto synthese van glucose is in de glucose-alaninecyclus.
energiekosten van de glucose-alanine-cyclus
net als de Cori-cyclus heeft ook de glucose-alanine-cyclus een energiekosten, gelijk aan 3-5 ATP.
het deel van de cyclus dat plaatsvindt in perifere weefsels omvat de productie van 5-7 ATP per molecule glucose:
- 2 ATP wordt geproduceerd door glycolyse;
- 3-5 ATP komen voort uit NADH/FADH2 (zie hieronder).
in plaats daarvan kost de gluconeogenese en de ureumcyclus 10 ATP:
- 6 ATP wordt geconsumeerd tijdens de gluconeogenese per gesynthetiseerd glucosemolecuul;
- 4 ATP worden geconsumeerd in de ureumcyclus per gesynthetiseerd ureummolecuul.
de glucose-alaninecyclus verschuift, net als de Cori-cyclus, een deel van de metabole belasting van extrahepatische weefsels naar de lever. De door de lever betaalde energiekosten worden echter gerechtvaardigd door de voordelen die de cyclus het hele lichaam oplevert, omdat het in bepaalde omstandigheden een efficiënte afbraak van eiwitten in extrahepatische weefsels (met name skeletspieren) mogelijk maakt, waardoor op zijn beurt gluconeogene substraten en het gebruik van aminozuren voor energie in extrahepatische weefsels kunnen worden verkregen.
overeenkomsten en verschillen tussen de Cahill-cyclus en de Cori-cyclus
er zijn enkele analogieën tussen de twee cycli, die hieronder worden opgesomd.
- de Cahill-cyclus overlapt gedeeltelijk de Cori-cyclus wanneer pyruvaat wordt omgezet in glucose en het monosaccharide wordt getransporteerd naar extrahepatische weefsels, waarin het opnieuw wordt omgezet in pyruvaat via de glycolytische route.
- de entree in de gluconeogeneseroute is gelijk voor de twee cycli: zowel alanine als lactaat worden omgezet in pyruvaat.
- net als de Cori-cyclus komt de glucose-alanine-cyclus voor tussen verschillende celtypen, in tegenstelling tot metabole routes zoals glycolyse, Krebs-cyclus of gluconeogenese die binnen individuele cellen voorkomen
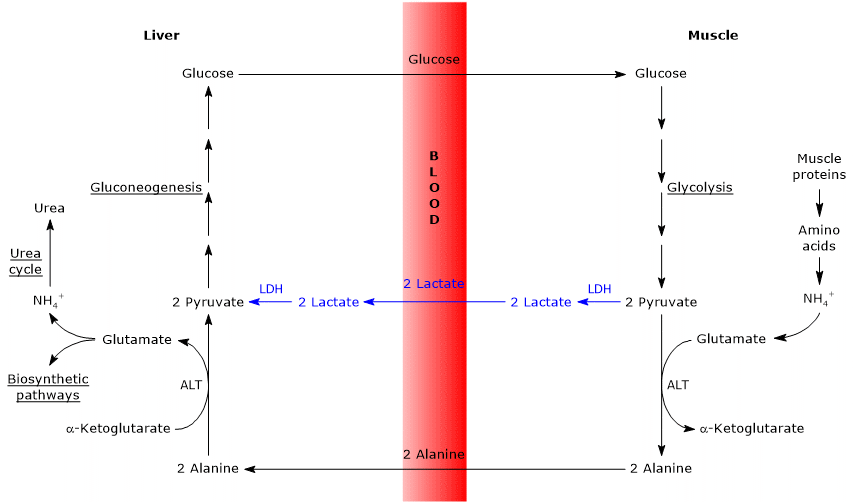
hieronder enkele verschillen tussen de twee cycli.
- het belangrijkste verschil betreft het drie koolstof intermediair dat uit perifere weefsels de lever bereikt: lactaat in de Cori cyclus, en alanine in de glucose-alanine cyclus.
- een ander verschil betreft het lot van de NADH geproduceerd door glycolyse in perifere weefsels.
In de Cori-cyclus werkt het co-enzym als reducerend middel om pyruvaat tot lactaat te reduceren, in de reactie die gekatalyseerd wordt door lactaatdehydrogenase (EC 1.1.1.27).
in de glucose-alaninecyclus treedt deze reductie niet op en kunnen de elektronen van NADH via de malaat-aspartaat-en glycerol-3-fosfaat shuttles naar de mitochondriën worden getransporteerd, waardoor NADH, de eerste shuttle, en FADH2, de andere shuttle worden gegenereerd. En de opbrengst van ATP van NADH en FADH2 is 2,5 en 1,5, respectievelijk. - ten slotte is uit het vorige punt duidelijk dat, in tegenstelling tot de Cori-cyclus, de Cahill-cyclus de aanwezigheid van zuurstof en mitochondriën in de perifere weefsels vereist.
Berg J. M., Tymoczko J. L., and Stryer L. Biochemistry. 5e editie. W. H. Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill G. F. Alanine: key role in gluconeogenesis. Wetenschap 1970; 167(3920): 1003-4. doi: 10.1126 / wetenschap.167.3920.1003
Gropper S. S., Smith J. L., Groff J. L. Geavanceerde voeding en menselijk metabolisme. Cengage Learning, 2009
Lecker S. H., Goldberg A. L. en Mitch W. E. Protein degradation by the ubiquitin-proteasome pathway in normal and disease states. J Am Soc Nephrol 2006; 17 (7): 1807-19. doi: 10.1681 / ASN.2006010083
Mallette L. E., Exton J. H., and Park C. R. Control of gluconeogenesis from amino acids in the perfused rat liver. J Biol Chem 1969; 244 (20):5713-23.
Nelson D. L., Cox M. M. Lehninger. Principes van de biochemie. 6e editie. W. H. Freeman and Company, 2012
Raju S. M., Madala B. Geïllustreerde Medische Biochemie. Jaypee Brothers Publishers, 2005
Wu G. Amino acids: biochemistry and nutrition. CRC Press, 2013