leerdoelen
Door het einde van dit hoofdstuk, zult u in staat zijn om:
- Schrijf Lewis symbolen voor neutrale atomen en ionen
- Teken Lewis structuren die de band in een eenvoudige moleculen
We hebben gesproken over de verschillende soorten van obligaties, die tussen atomen en/of ionen. In alle gevallen, deze bindingen impliceren het delen of overdracht van valentie shell elektronen tussen atomen. In deze sectie zullen we de typische methode verkennen voor het afbeelden van valentieschelpelektronen en chemische bindingen, namelijk Lewis-symbolen en Lewis-structuren.
Lewis-symbolen
we gebruiken Lewis-symbolen om valentie-elektronconfiguraties van atomen en monatomische ionen te beschrijven. Een Lewis-symbool bestaat uit een elementair symbool omgeven door een punt voor elk van zijn valentie-elektronen:
figuur 1 toont de Lewis-symbolen voor de elementen van de derde periode van het periodiek systeem.

figuur 1. Lewis-symbolen die het aantal valentie-elektronen voor elk element in de derde periode van het periodiek systeem illustreren.
Lewis symbolen kunnen ook worden gebruikt om de vorming van kationen uit atomen te illustreren, zoals hier getoond voor natrium en calcium:

evenzo kunnen ze worden gebruikt om de vorming van anionen uit atomen te tonen, zoals hieronder voor chloor en zwavel:

Figuur 2 toont het gebruik van Lewis symbolen om de overdracht van elektronen tijdens de vorming van ionische verbindingen.

Figuur 2. Kationen worden gevormd wanneer atomen elektronen verliezen, vertegenwoordigd door minder Lewis punten, terwijl anionen worden gevormd door atomen die elektronen bereiken. Het totale aantal elektronen verandert niet.
Lewis-structuren
we gebruiken ook Lewis-symbolen om de vorming van covalente bindingen aan te geven, die worden weergegeven in Lewis-structuren, tekeningen die de binding in moleculen en polyatomische ionen beschrijven. Bijvoorbeeld, wanneer twee chlooratomen een chloormolecuul vormen, delen zij één paar elektronen:

De Lewis-structuur geeft aan dat elk CL-atoom drie paren elektronen heeft die niet worden gebruikt in binding (eenzame paren genoemd) en één gedeeld paar elektronen (geschreven tussen de atomen). Een streepje (of lijn) wordt soms gebruikt om een gedeeld paar elektronen aan te geven:

een enkel gedeeld paar elektronen wordt een enkele binding genoemd. Elk CL-atoom interageert met acht valentie-elektronen: de zes in de eenzame paren en de twee in de enkele binding.
de octetregel
de andere halogeenmoleculen (F2, Br2, I2 en At2) vormen bindingen zoals die in het chloormolecuul: één enkele binding tussen atomen en drie eenzame paren elektronen per atoom. Hierdoor kan elk halogeenatoom een edelgaselektronenconfiguratie hebben. De neiging van hoofdgroepatomen om voldoende bindingen te vormen om acht valentie-elektronen te verkrijgen staat bekend als de octetregel.
het aantal bindingen dat een atoom kan vormen kan vaak worden voorspeld uit het aantal elektronen dat nodig is om een octet te bereiken (acht valentie-elektronen); dit geldt vooral voor de niet-metalen uit de tweede periode van het periodiek systeem (C, N, O en F). Elk atoom van een element van groep 14 heeft bijvoorbeeld vier elektronen in zijn buitenste schil en heeft daarom nog vier elektronen nodig om een octet te bereiken. Deze vier elektronen kunnen worden verkregen door vier covalente bindingen te vormen, zoals hier wordt geïllustreerd voor koolstof in CCl4 (tetrachloorkoolstof) en silicium in SiH4 (silaan). Omdat waterstof slechts twee elektronen nodig heeft om zijn valentieschil te vullen, is het een uitzondering op de octetregel. De overgangselementen en innerlijke overgangselementen volgen ook niet de octetregel:

Groep 15 elementen zoals stikstof hebben vijf valentie-elektronen in het atomaire Lewis symbool: één enkel paar en drie ongepaarde elektronen. Om een octet te verkrijgen, vormen deze atomen drie covalente bindingen, zoals in NH3 (ammoniak). Zuurstof en andere atomen in groep 16 verkrijgen een octet door twee covalente bindingen te vormen:
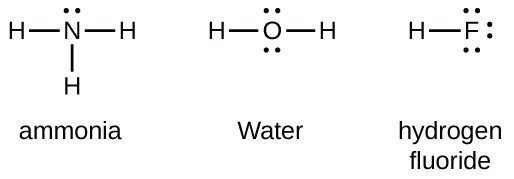
dubbele en drievoudige bindingen
zoals eerder vermeld, wanneer een paar atomen één paar elektronen deelt, noemen we dit een enkele binding. Een paar atomen kan echter meer dan één paar elektronen moeten delen om het vereiste octet te bereiken. Een dubbele binding ontstaat wanneer twee paren elektronen worden gedeeld tussen een paar atomen, zoals tussen de koolstof-en zuurstofatomen in CH2O (formaldehyde) en tussen de twee koolstofatomen in C2H4 (ethyleen):
een drievoudige binding ontstaat wanneer drie elektronenparen worden gedeeld door een paar atomen, zoals in stikstofgas (N2).):
Lewis-structuren schrijven met de octetregel
voor zeer eenvoudige moleculen en moleculaire ionen kunnen we de Lewis-structuren schrijven door alleen de ongepaarde elektronen op de samenstellende atomen te koppelen. Zie deze voorbeelden:

voor meer gecompliceerde moleculen en moleculaire ionen is het nuttig de hier beschreven stapsgewijze procedure te volgen:
- Bepaal het totale aantal valentie-elektronen (buitenschil).
- teken een skelet structuur van het molecuul, het rangschikken van de atomen rond een centraal atoom. (Over het algemeen moet het minst elektronegatieve element in het midden worden geplaatst.) Verbind elk atoom met het centrale atoom met een enkele binding (een elektronenpaar).Verdeel de resterende elektronen als eenzame paren op de eindatomen (behalve waterstof), waarbij een octet rond elk atoom wordt voltooid.
- plaats alle resterende elektronen op het centrale atoom.
- herschik de elektronen van de buitenste atomen om meerdere bindingen met het centrale atoom te maken om waar mogelijk octetten te verkrijgen.
laten we de Lewis-structuur van PBr3 bepalen met behulp van de bovenstaande stappen:
- Stap 1: Bepaal het totale aantal valentie (buitenste schil) elektronen.
\grote\ begin{array}{l} \ \ \ phantom {\rule{0.8 em}{0ex}} {\text{PBr}}_{3}\\ \ \ phantom {\rule{0.8 em}{0ex}} \ text{P: 5 valentie-elektronen / atoom} \ times \ text{1 atoom} = 5 \ \ \ underline {+\text{Br: 7 valentie-elektronen / atoom} \ times \ text{3 atomen} = 21}\\ \ \ \ phantom {\rule{15.95em}{0ex}}= \ text{26 valentie-elektronen} \ end{array}
- Stap 2: Teken een skelet structuur van het molecuul, het rangschikken van de atomen rond een centraal atoom. (Over het algemeen moet het minst elektronegatieve element in het midden worden geplaatst.) Verbind elk atoom met het centrale atoom met een enkele binding (een elektronenpaar).

- Stap 3: verdeel de resterende elektronen als eenzame paren op de terminale atomen (behalve waterstof), en voltooi een octet rond elk atoom.
-
 Stap 4: Plaats alle resterende elektronen op het centrale atoom.
Stap 4: Plaats alle resterende elektronen op het centrale atoom.

opmerking: Stap 5: Is niet nodig omdat alle atomen een octet hebben.
laten we de Lewis-structuur van CH2O bepalen.
- Stap 1: Bepaal het totale aantal valentie (buitenste schil) elektronen.
\grote \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{H}_{2}}\text{CO}\\ \phantom{\rule{0.8 em}{0ex}}\text{H: 1 valentie elektron/atom}\times \text{2 atom}=2\\\text{C: 4 valentie elektronen/atom}\times \text{1 atoom}=4\\ \underline{+\text{O: 6 valentie elektronen/atom}\times \text{1 atomen}=6}\\ \\ \phantom{\rule{15.95 em}{0ex}}=\text{12 valence elektronen}\end{array}
- Stap 2: Teken een skelet structuur van het molecuul, het regelen van de atomen rond een centrale atoom. (Over het algemeen moet het minst elektronegatieve element in het midden worden geplaatst.) Verbind elk atoom met het centrale atoom met een enkele binding (een elektronenpaar).

- Stap 3: verdeel de resterende elektronen als eenzame paren op de terminale atomen (behalve waterstof), en voltooi een octet rond elk atoom.

- Stap 4: niet nodig, omdat alle elektronen zijn geplaatst. Koolstof heeft echter geen octet,
- Stap 5: Herschik de elektronen van de buitenste atomen om meerdere bindingen met het centrale atoom te maken om waar mogelijk octetten te verkrijgen.

Voorbeeld 1: Het schrijven van Lewis Structures
NASA ‘ s Cassini-Huygens missie ontdekte een grote wolk van giftige waterstofcyanide (HCN) op Titan, een van de manen van Saturnus. Wat zijn de Lewis-structuren van deze moleculen?
kooldioxide, CO2, is een product van de verbranding van fossiele brandstoffen. CO2 is betrokken bij de wereldwijde klimaatverandering. Wat is de Lewis-structuur van CO2?
belangrijke concepten en samenvatting
valentie elektronische structuren kunnen worden gevisualiseerd door het tekenen van Lewis symbolen (voor atomen en monatomische ionen) en Lewis structuren (voor moleculen en polyatomische ionen). Eenzame paren, ongepaarde elektronen en enkele, dubbele of drievoudige bindingen worden gebruikt om aan te geven waar de valentie-elektronen zich rond elk atoom in een Lewis-structuur bevinden. De meeste structuren—vooral die met elementen van de tweede rij—gehoorzamen aan de octetregel, waarin elk atoom (behalve H) is omgeven door acht elektronen. Uitzonderingen op de octetregel komen voor bij oneven-elektronenmoleculen (vrije radicalen), elektronendeficiënte moleculen en hypervalente moleculen.
oefeningen
- schrijf de Lewis-symbolen voor elk van de volgende ionen:
- As3 –
- I –
- Be2 +
- O2 –
- Ga3 +
- Li +
- N3–
- veel monatomaire ionen worden gevonden in zeewater, met inbegrip van de ionen gevormd uit de volgende lijst van elementen. Schrijf de Lewis symbolen voor de monatomaire ionen gevormd uit de volgende elementen:
- Cl
- Nvt
- Mg
- Ca
- K
- Br
- Sr
- F
- Schrijf de Lewis symbolen van de ionen in elk van de volgende ionogene verbindingen en de Lewis symbolen van de atomen waaruit ze zijn gevormd:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- In de Lewis-structuren hieronder, M en X vertegenwoordigen verschillende elementen in de derde periode van het periodiek systeem. Schrijf de formule van elke verbinding met behulp van de chemische symbolen van elk element:
- schrijf de Lewis structuur voor het diatomaire molecuul P2, een onstabiele vorm van fosfor gevonden in hoge temperatuur fosfor damp.
- Schrijf Lewis structuren voor het volgende:
- H2
- HBr
- PCl3
- Schrijf Lewis structuren voor het volgende:
- O2
- H2CO
- AsF3
- SiCl4
Woordenlijst
dubbele binding: covalente binding in die twee paren van elektronen worden gedeeld tussen de twee atomen
vrije radicalen: een molecule met een oneven aantal elektronen
hypervalent molecuul: een molecule met ten minste één hoofdgroep element dat meer dan acht elektronen in zijn valence shell
Lewis structuur: diagram van eenzame paren en lijmen van paren van elektronen in een molecuul of ion
Lewis symbool: symbool voor een element of monatomic ion die gebruik maakt van een stip voor elke valentie-elektronen in het element of de ion
lone-pair: twee (een paar van) valentie elektronen die niet zijn gebruikt om een covalente binding
octet regel: richtlijn dat lidstaten de belangrijkste groep atomen vormen structuren in die acht valentie elektronen communiceren met elke kern, het tellen van bonding elektronen als de interactie met zowel de atomen met elkaar verbonden door de band
enkele binding: bond waarin een enkel paar van elektronen wordt gedeeld tussen twee atomen
triple-band: binding waarin drie paren elektronen worden gedeeld tussen twee atomen


 HCN: geen elektronen blijven
HCN: geen elektronen blijven




















