het bewijs achter natuurlijke ingrepen voor niet-alcoholische leverziekte: plantaardige stoffen, voedingsstoffen en probiotica voor de behandeling van deze veel voorkomende aandoening
gezien de toename van niet-alcoholische leverziekte (NAFLD) bij zowel volwassenen als kinderen en het ontbreken van een aangewezen farmaceutische behandeling, staan natuurlijke strategieën voor de behandeling van deze aandoening goed gepositioneerd als de “next best thing”.”Verschillende voedingssupplementen en plantaardige stoffen zijn klinisch bestudeerd en tonen belofte voor de behandeling van NAFLD en zijn inflammatoire tegenhanger, niet-alcoholische steatohepatitis (NASH). Gegeven hoeveel van deze therapieën de factoren aanpakken die bijdragen aan de ontwikkeling van NAFLD, is het niet veel redeneren nodig om te begrijpen hoe ze effectief sommige van de onderliggende oorzaken van ziekte kunnen aanpakken, in plaats van alleen een symptoom aan te pakken.
vijf aanvullende interventies met klinisch of epidemiologisch bewijs voor het gebruik ervan in de setting van NAFLD zijn fosfatidylcholine, dat fosfolipiden en choline, vitamine E levert, zowel als Alfa-tocoferolen als een mengsel van delta-en gamma-tocotriënolen, mariadistelzaadextract, berberine en probiotica.
- leververvetting: gecorreleerd met een Fosfatidylcholinedeficiëntie?
- vitamine E
- mariadistel
- probiotica
- conclusie
- Dr. Carrie Decker, ND studeerde cum laude af aan het National College Of Natural Medicine (nu de National University of Natural Medicine) in Portland, Oregon. Dr. Decker ziet patiënten op afstand, met een focus op gastro-intestinale ziekte, stemmingsstoornissen, eetstoornissen, auto-immuunziekte en chronische vermoeidheid. Voordat hij naturopathisch arts werd, was Dr.Decker ingenieur en behaalde hij een graad in biomedische en werktuigbouwkunde aan de Universiteit van Wisconsin-Madison en de Universiteit van Illinois in Urbana-Champaign respectievelijk. Dr. Decker blijft genieten van academisch onderzoek en schrijven en gebruikt deze vaardigheden om integratieve geneeskunde onderwijs te ondersteunen als schrijver en bijdrager aan verschillende middelen. Dr. Decker ondersteunt Allergy Research Group als lid van hun onderwijs-en productontwikkelingsteam.
- bronnen:
- Spengler EK, Loomba R. Recommendations for diagnosis, referral for liver biopsie, and treatment of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Mayo Clinic Procedure. 2015;90(9):1233–1246.
- Berardis S, Sokal E. pediatrische niet-alcoholische vettige leverziekte: een toenemend probleem voor de volksgezondheid. Eur J Pediatr. 2014 Feb;173 (2): 131-9.
- Jadeja R, et al. Kruidengeneesmiddelen voor de behandeling van niet-alcoholische steatohepatitis: huidige scenario en toekomstperspectieven. Evid Gebaseerde Aanvulling Alternat Med. 2014:648308.
- Pomorski T, et al. Distributie en transport van lipiden over celmembranen. Semin Cell Dev Biol. 2001 Apr; 12 (2):139-48.
- Yamaji-Hasegawa A, et al. Asymmetrische verdeling van fosfolipiden in biomembranen. Biol Pharm Bull. 2006 Aug; 29 (8): 1547-53.
- Hişmioğullari AA, et al. Biliaire lipidensecretie. Turk J Gastro-Enterol. 2007 Jun; 18 (2): 65-70.
- Fischer LM, et al. Geslacht en menopauzale status beà nvloeden menselijke dieetbehoeften voor de voedende choline. Am J Clin Nutr. 2007 mei; 85 (5):1275-85.Wallace TC, et al. De gebruikelijke Cholineinnamen worden geassocieerd met ei en eiwit voedselconsumptie in de Verenigde Staten. Nutriënten. 2017 Aug 5; 9 (8).
- Zeisel SH. De elementen van de genrespons, genetische polymorfismen en epigenetica beà nvloeden de menselijke dieetbehoefte voor choline. IUBMB Life. 2007 Jun; 59 (6): 380-7.
- Zeisel SH. De elementen van de genrespons, genetische polymorfismen en epigenetica beà nvloeden de menselijke dieetbehoefte voor choline. IUBMB Life. 2007 Jun; 59 (6): 380-7.
- Guerrerio AL, et al. Choline-inname in een groot cohort van patiënten met niet-alcoholische leververvetting. Am J Clin Nutr. 2012 Apr; 95 (4): 892-900.
- Ma X, et al. Polyenylfosfatidylcholine verzwakt niet-alcoholische leverfibrose en versnelt de regressie ervan. J Hepatol. 1996 mei; 24 (5): 604-13.
- Lieber CS, et al. Fosfatidylcholine beschermt tegen fibrose en cirrose bij de baviaan. Gastro-enterologie. 1994 Jan;106 (1): 152-9.
- Chanussot F, et al. Preventie door voedsel (n-6) meervoudig onverzadigde fosfatidylcholines van intrahepatische cholestase geïnduceerd door cyclosporine A bij dieren. Life Sci. 2003 Jun 13; 73 (4): 381-92.
- Karaman A, et al. Beschermend effect van meervoudig onverzadigde fosfatidylcholine op leverschade veroorzaakt door galobstructie bij ratten. J Pediatr Sur. 2003 Sep; 38(9): 1341-7.
- Karaman A, et al. Beschermend effect van meervoudig onverzadigde fosfatidylcholine op leverschade veroorzaakt door galobstructie bij ratten. J Pediatr Sur. 2003 Sep; 38(9): 1341-7.
- Stremmel W, et al. Mucosale bescherming door fosfatidylcholine. Dig Dit. 2012; 30 Suppl 3: 85-91.
- Parlesak A, et al. Geconjugeerde primaire galzouten verminderen de permeabiliteit van endotoxine door intestinale epitheliale cellen en synergeteren met fosfatidylcholine in onderdrukking van ontstekingscytokine productie. Crit Care Med. 2007 Oct; 35 (10):2367-74.
- Mitzscherling K, et al. Fosfatidylcholine keert de door ethanol geïnduceerde toename van de transepitheliale endotoxine permeabiliteit om en schaft de transepitheliale leukocytenactivatie af. Alcohol Clin Exp Res. 2009 Mrt; 33(3): 557-62.
- Buzzetti E, et al. De multiple-hit pathogenese van niet-alcoholische vettige leverziekte (NAFLD). Metabolisme. 2016 Aug; 65(8):1038-48.
- El Hadi H, et al. Vitamine E als behandeling voor niet-alcoholische vette leverziekte: realiteit of mythe? Antioxidanten (Bazel). 2018 Jan 16; 7 (1).
- Bugianesi E, et al. Een gerandomiseerde gecontroleerde studie van metformine versus vitamine E of een prescriptief dieet bij niet-alcoholische leververvetting. Am J Gastro-Enterol. 2005 mei; 100 (5): 1082-90.
- Sanyal AJ, et al. Pioglitazon, vitamine E of placebo voor niet-alcoholische steatohepatitis. N Engl J Med. 2010 mei 6; 362 (18):1675-85.
- Lavine JE. Vitamine E behandeling van niet-alcoholische steatohepatitis bij kinderen: modelstudies. J Pediatr. 2000 Jun; 136 (6): 734-8.
- Peh HY, et al. Vitamine E therapie voorbij kanker: tocoferol versus tocotrienol. Farmacotherapeutische Categorie: 2016 Jun; 162: 152-69.
- Qureshi AA, et al. Dosisafhankelijke modulatie van lipideparameters, cytokines en RNA door delta-tocotrienol bij hypercholesterolemische proefpersonen beperkt tot AHA Step-1 dieet. Brit J Of Med & Med res. 2015;6 (4): 351-66.
- Qureshi AA, et al. Impact van delta-tocotrienol op inflammatoire biomarkers en oxidatieve stress bij hypercholesterolemische proefpersonen. Clin Exp Cardiologie. 2015;6(4):1000367.
- Zaiden N, et al. Gamma delta tocotriënolen verminderen de hepatische triglyceridesynthese en VLDL-secretie. J Atheroscler Thromb. 2010 Oct 27; 17 (10):1019-32.
- Magosso E, et al. Tocotriënolen voor normalisatie van de hepatische echogene respons bij niet-alcoholische leververvette lever: een gerandomiseerde placebogecontroleerde klinische studie. Nutr J. 2013 27 Dec; 12 (1):166.
- Pervez MA, et al. Effecten van suppletie van Delta-tocotrienol op leverenzymen, ontsteking, oxidatieve stress en hepatische steatose bij patiënten met niet-alcoholische leververvetting. Turk J Gastro-Enterol. 2018 mrt; 29(2):170-176.
- Abenavoli L, et al. Mariadistel bij leverziekten: verleden, heden, toekomst. Phytother Res.2010 Okt;24(10):1423-32.
- Valenzuela A, et al. Selectiviteit van silymarine op de toename van het GSH-gehalte in verschillende weefsels van de rat. Planta Med. 1989 okt; 55 (5): 420-2.
- Rui YC. Vooruitgang in farmacologische studies van silymarine. Mem Inst Oswaldo Cruz. 1991; 86 Suppl 2:79-85.
- Gu M, et al. Silymarine verbetert metabole dysfunctie geassocieerd met dieet-geïnduceerde obesitas via activering van Farnesyl X Receptor. Front Pharmacol. 2016 Sep 28; 7: 345.
- Ali AH, et al. Recente ontwikkelingen in de ontwikkeling van farnesoid x receptor agonisten. Ann Transl Med. 2015 Jan; 3 (1): 5.
- Traussnigg s, et al. Werkzaamheid en veiligheid van de niet-steroïde farnesoïde x-receptor agonist PX-104 bij patiënten met niet-alcoholische leververvetting (NAFLD). Zeitschrift für Gastroenterologie. 2017 Mei; 55(05):A71.
- Zhong s, et al. Het therapeutische effect van silymarine bij de behandeling van niet-alcoholische vetziekte: een meta-analyse (PRISMA) van gerandomiseerde controleproeven. Geneeskunde (Baltimore). 2017 Dec; 96 (49): e9061.
- Hajiaghamohammadi AA, et al. Effecten van behandeling met metformine, pioglitazon en silymarine op niet-alcoholische leververvetting: een gerandomiseerd gecontroleerd pilotonderzoek. Hepat Mon. 2012 Aug; 12 (8): e6099.
- Birdsall TC, et al. Berberine: therapeutisch potentieel van een alkaloïde gevonden in verschillende geneeskrachtige planten. Altern Med Rev. 1997; 2: 94-103.
- Imanshahidi m, et al. Farmacologische en therapeutische effecten van Berberis vulgaris en het werkzame bestanddeel Berberine. Phytother Res. 2008 Aug; 22 (8): 999-1012.
- Zhu X, et al. De mogelijke mechanismen van Berberine bij de behandeling van niet-alcoholische leververvetting. Molecule. 2016 okt 14; 21 (10).
- Lan J, et al. Meta-analyse van het effect en de veiligheid van berberine bij de behandeling van type 2 diabetes mellitus, hyperlipemie en hypertensie. J Ethnopharmacol. 2015 Feb 23; 161: 69-81.
- Sun R, et al. Oraal toegediend Berberine moduleert het Leverlipidenmetabolisme door het microbiële Galzuurmetabolisme en de intestinale FXR-signaalweg te wijzigen. Mol Pharmacol. 2017 Feb;91 (2): 110-122.
- Guo T, et al. Berberine verbetert hepatische steatose en onderdrukt lever-en vetweefsel ontsteking bij muizen met dieet-geïnduceerde obesitas. Sci Rep. 2016 Maart 3; 6: 22612.
- Schattenberg JM, et al. JNK1 maar niet JNK2 bevordert de ontwikkeling van steatohepatitis bij muizen. Hepatologie. 2006 Jan;43 (1): 163-72.
- Han J, et al. Modulerende darmmicrobiota als een anti-diabetisch mechanisme van berberine. Med Sci Monit. 2011; 17: RA164-7.
- Gu L, et al. Berberine verbetert intestinale epitheliale tight-junction schade en down-reguleert myosine lichte keten kinase paden in een muismodel van endotoxinemie. J Infecteren Dis. 2011 Jun 1; 203(11):1602-12.
- Li N, et al. Berberine verzwakt pro-inflammatoire cytokine-geïnduceerde tight junction disruptie in een in vitro model van intestinale epitheliale cellen. Eur J Pharm Sci. 2010 Apr 16; 40 (1): 1-8.
- Ma X, et al. De pathogenese van Diabetes Mellitus door oxidatieve Stress en ontsteking: de remming ervan door Berberine. Front Pharmacol. 2018 Jul 27; 9: 782.
- Yan HM, et al. Werkzaamheid van Berberine bij patiënten met niet-alcoholische leververvetting. PLoS ÉÉN. 2015 Aug 7; 10 (8): e0134172.
- Ma YY, et al. Effecten van probiotica op niet-alcoholische leververvetting: een meta-analyse. Wereld J Gastro-Enterol. 2013 Oct 28; 19 (40): 6911-8.
- Vajro P, et al. Effecten van Lactobacillus rhamnosus stam GG bij pediatrische obesitas-gerelateerde leverziekte. J Pediatr Gastro-Enterol Nutr. 2011 Jun; 52 (6): 740-3.
- Alisi A, et al. Gerandomiseerde klinische studie: de gunstige effecten van VSL#3 bij zwaarlijvige kinderen met niet-alcoholische steatohepatitis. Geneesmiddelen Voor Diergeneeskundig Gebruik 2014 Jun; 39 (11): 1276-85.
- Pérez-Rubio KG, et al. Effect van toediening van berberine op het metabool syndroom, insulinegevoeligheid en insulinesecretie. Metab Syndr Relat Disord. 2013 okt; 11 (5): 366-9.
- Iacono A, et al. Probiotica als een opkomende therapeutische strategie voor de behandeling van NAFLD: focus op moleculaire en biochemische mechanismen. J Nutr Biochem. 2011 Aug; 22 (8): 699-711.
- Honda Y, et al. Werkzaamheid van glutathione voor de behandeling van niet-alcoholische vette leverziekte: een open-label, éénarmige, multicenter, pilotstudie. BMC gastro-Enterol. 2017 Aug 8; 17 (1): 96.
- Dentico P, et al. . Recente Prog Med. 1995 Jul-Aug; 86 (7-8): 290-3.
- Khoshbaten M, et al. N-acetyl-cysteïne verbetert de leverfunctie bij patiënten met niet-alcoholische leververvetting. Hepatitis Mon. 2010;10(1):12-16.
- Muto C, et al. Gamma-tocotrienol vermindert het triacylglycerolniveau in primaire hepatocyten van ratten door regulatie van vetzuurmetabolisme. J Clin Biochem Nutr. 2013;52(1):32-37.
- Parker HM, et al. Omega-3 suppletie en niet-alcoholische leververvetting: een systematische review en meta-analyse. J Hepatol. 2012;56(4):944-51.
leververvetting: gecorreleerd met een Fosfatidylcholinedeficiëntie?
fosfatidylcholine (PC) is essentieel voor de gezondheid van alle cellen in het lichaam en is een van de belangrijkste fosfolipiden waaruit celmembranen bestaan., PC omvat meer dan 90% van het totale gehalte aan galfosfolipiden en vergemakkelijkt vetemulsificatie, absorptie en vervoer. Studies hebben aangetoond dat de aanbevolen adequate inname (AI) van choline (zie Tabel 1) mogelijk niet voldoende is voor het voorkomen van deficiëntieverschijnselen zoals leververvetting of spierbeschadiging. Bovendien bleek uit een recente studie dat slechts 8% van de Amerikaanse volwassenen voldoen aan de aanbevolen AI van choline, met vegetariërs, postmenopauzale vrouwen en mannen met het grootste risico op ontoereikendheid., Kunnen de genetische polymorfismen ook de behoefte aan choline verhogen, die ook een bron van methylgroepen in het lichaam is.
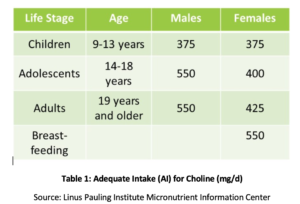
bij postmenopauzale vrouwen met NAFLD is aangetoond dat verminderde choline-inname significant geassocieerd is met een verhoogd risico op fibrose. Bij dieren is aangetoond dat PC beschermt tegen fibrose geassocieerd met leverontsteking., Is de verhoogde inname van PC getoond om gallipidesecretie te verbeteren, waardoor cholestase en de daaropvolgende leverschade via talrijke mechanismen, met inbegrip van afschaffing van nucleaire factor kappa B (NF-kB), een goed begrepen moleculaire trekker van ontsteking wordt verhinderd., In een diermodel van galobstructie, is aanvullende PC getoond om leverschade, ductale proliferatie, en fibrose te verminderen.
PC is ook essentieel voor de gezondheid van de darm en is een primair bestanddeel van de beschermende darmslijmlaag. In celculturen is aangetoond dat behandeling met PC de migratie van endotoxine door intestinale epitheliale cellen vermindert, waardoor de bijbehorende ontstekingscytokinerespons verder wordt onderdrukt. PC vermindert ook de translocatie van endotoxine in de setting van alcohol-geïnduceerde verhogingen van intestinale permeabiliteit. Dit gunstige effect is voorgesteld als een van de mechanismen waardoor PC als therapeutisch kan worden beschouwd bij alcoholische leverziekte.
vitamine E
aangezien een door oxidatieve stress getroffen en verminderde antioxidantafweer wordt voorgesteld als een factor die leidt tot de ontwikkeling van NAFLD, mag het niet verwonderlijk zijn dat antioxidanten zijn onderzocht als een mogelijke behandeling voor de aandoening.
 vitamine E is onderzocht in verschillende klinische studies voor de behandeling van NAFLD, zowel als zelfstandige als als adjuvante therapie. In een overzicht van deze studies varieerde de dosering van vitamine E van 400 tot 1200 IE/dag en de studieduur was van 24 weken tot meer dan twee jaar. De bevindingen waren over het algemeen positief, waaruit bleek dat wanneer vitamine E werd opgenomen, verbeteringen in histologie, steatose en/of transaminasespiegels werden waargenomen. In de pediatrie met NAFLD is vitamine E ook onderzocht als therapie. In een open-label pilot studie onder 11 kinderen met NAFLD bleek een supplementinname van 400 tot 1200 IE vitamine E gedurende vier tot tien maanden de transaminase-en alkalische fosfatasespiegels te normaliseren tijdens de behandeling, maar deze keerden terug naar abnormaal zodra de behandeling werd gestopt. De hepatische echogeniciteit veranderde niet tijdens de behandeling.
vitamine E is onderzocht in verschillende klinische studies voor de behandeling van NAFLD, zowel als zelfstandige als als adjuvante therapie. In een overzicht van deze studies varieerde de dosering van vitamine E van 400 tot 1200 IE/dag en de studieduur was van 24 weken tot meer dan twee jaar. De bevindingen waren over het algemeen positief, waaruit bleek dat wanneer vitamine E werd opgenomen, verbeteringen in histologie, steatose en/of transaminasespiegels werden waargenomen. In de pediatrie met NAFLD is vitamine E ook onderzocht als therapie. In een open-label pilot studie onder 11 kinderen met NAFLD bleek een supplementinname van 400 tot 1200 IE vitamine E gedurende vier tot tien maanden de transaminase-en alkalische fosfatasespiegels te normaliseren tijdens de behandeling, maar deze keerden terug naar abnormaal zodra de behandeling werd gestopt. De hepatische echogeniciteit veranderde niet tijdens de behandeling.
tocotriënolen zijn de minder bestudeerde familie van de in de natuur voorkomende vormen van vitamine E, waarbij de tocoferolen, die vaker in de natuur voorkomen, het wetenschappelijk onderzoek domineren. Nochtans, zijn tocotrienols krachtige antioxidanten, die in sommige onderzoek als het hebben van 40 tot 60 keer het antioxidantpotentieel van tocoferolen worden geciteerd. Het is aangetoond dat tocotriënolen het totale cholesterol en de fracties ervan verbeteren, waardoor het totale en LDL-cholesterol met 15 tot 20% en triglyceriden tot bijna 30% worden verlaagd. Van tocotriënolen is ook aangetoond dat ze in vivo ontstekingsremmende en antioxiderende effecten hebben, waardoor de hooggevoelige c-Reactieve proteïne (hs-CRP)-spiegels worden verlaagd en de LDL-oxidatie wordt verminderd.
tocotriënolen zijn ook onderzocht als behandeling van NAFLD. Bij patiënten met echografie gediagnosticeerde NAFLD bleek 200 mg gemengde tocotriënolen (afkomstig uit palmolie, met een hoge gammafractie en nog eens 61 mg alfa-tocoferolen) tweemaal daags gedurende één jaar de hepatische echogene respons en remissie significant te normaliseren in vergelijking met placebo. In een tweede studie, met patiënten met echografie gediagnosticeerde NAFLD en transaminaseverhoging, verlaagde 300 mg tocotriënolen (een 90:10 delta:gamma blend) tweemaal daags gedurende 12 weken significant de aspartaataminotransferase (AST), alanineaminotransferase (ALT), hs-CRP en malondialdehyde (een marker van oxidatieve stress) spiegels evenals de fatty liver index score in vergelijking met placebo.
mariadistel
mariadistel (Silybum marianum) is mogelijk de bekendste botanische plant ter bescherming van de lever. Silymarine, een mengsel van de actieve bestanddelen van mariadistel, en silibinine, de meest actieve verbinding gevonden binnen het, zijn aangetoond in dierstudies leverschade veroorzaakt door paracetamol, alcohol, ijzeroverbelasting en straling onder andere bekende lever-toxische stoffen te verminderen. Het is aangetoond dat silymarine de niveaus van glutathion, een krachtige antioxidant, in zowel de lever als de darmen verhoogt. Het vermindert ook lipideperoxidatie, die cellulaire membranen beschadigt, hun functie verandert, en mogelijk cellulaire dood veroorzaakt.
silibinine en silymarine hebben aangetoond dat ze een nucleaire galzuurreceptor in de lever activeren die bekend staat als farnesoid x-receptor (FXR), waardoor ontstekingswegen worden onderdrukt en insulineresistentie en dyslipidemie worden gecorrigeerd die worden veroorzaakt door vetrijke voeding (HFD). FXR is een belangrijke regulator van galzuur, glucose, en lipide evenwicht in het lichaam. Geneesmiddelen die op een vergelijkbare manier met FXR interageren als deze van mariadistel afgeleide verbindingen worden ook onderzocht voor de behandeling van NAFLD en de gerelateerde metabole uitdagingen.Klinische studies hebben ook aangetoond dat mariadistel verschillende parameters geassocieerd met NAFLD verbetert. Uit een meta-analyse van 2017 bleek dat behandeling met mariadistel ALAT en AST significant verlaagt met respectievelijk -5,08 IE/l en -5,44 IE/L bij patiënten met NAFLD. De dosering varieerde van 140 mg eenmaal daags tot 200 mg driemaal daags, gedurende 8 tot 24 weken. Bij de laagste dosering van 140 mg per dag werden na 8 weken significante verbeteringen gezien in nuchtere bloedglucose (FBG), lipidenprofiel en seruminsulinespiegels naast AST-en ALAT-verlagingen van 56 tot 37.Respectievelijk 77 IE / L en 78,73 tot 53,05 IE / L.Berberine, de oranjegele alkaloïde die voorkomt in plantenextracten zoals Oregon-druivenwortel en-schors, goldenseal en berberis, is een andere botanisch afgeleide stof die talrijke mechanismen heeft waarmee het kan helpen beschermen tegen NAFLD en zijn resolutie ondersteunt.,De antidiabetica en lipidenbalancerende effecten van berberine zijn aangetoond in verschillende klinische studies, en kunnen middelen zijn waardoor berberine de leverfunctie positief beïnvloedt. Van Berberine is aangetoond dat het metabolisme-gerelateerde genexpressie en galzuurmetabolisme verandert via routes waarbij ook FXR betrokken is. In dierstudies is aangetoond dat berberine het effect heeft van het voorkomen van HFD-geassocieerde obesitas en hepatische triglycerideaccumulatie bij wild-type (normale) muizen, maar niet bij muizen met de genetische eliminatie van intestinale FXR-expressie. Van Berberine is ook aangetoond dat het obesitas-geassocieerde ontsteking en hepatische steatose bij muizen onderdrukt door de fosforylering van het ontstekingscomplex bekend als JNK1, een eiwitkinase dat betrokken is bij de ontwikkeling van steatohepatitis. JNK1 wordt sterk geactiveerd door omgevingsstressoren en pro-inflammatoire cytokines.
kunnen middelen zijn waardoor berberine de leverfunctie positief beïnvloedt. Van Berberine is aangetoond dat het metabolisme-gerelateerde genexpressie en galzuurmetabolisme verandert via routes waarbij ook FXR betrokken is. In dierstudies is aangetoond dat berberine het effect heeft van het voorkomen van HFD-geassocieerde obesitas en hepatische triglycerideaccumulatie bij wild-type (normale) muizen, maar niet bij muizen met de genetische eliminatie van intestinale FXR-expressie. Van Berberine is ook aangetoond dat het obesitas-geassocieerde ontsteking en hepatische steatose bij muizen onderdrukt door de fosforylering van het ontstekingscomplex bekend als JNK1, een eiwitkinase dat betrokken is bij de ontwikkeling van steatohepatitis. JNK1 wordt sterk geactiveerd door omgevingsstressoren en pro-inflammatoire cytokines.
Berberine werkt ook in de darm. Het beïnvloedt niet alleen de darm microbiële balans, maar ook direct invloed intestinale permeabiliteit, het verbeteren van tight junction integriteit in dieren onderworpen aan endotoxemie of celculturen behandeld met pro-inflammatoire cytokines.Er zijn ook directe ontstekingsremmende effecten aangetoond.
de voordelen van berberine in NAFLD zijn ook klinisch aangetoond in een gerandomiseerde, parallel gecontroleerde, open-label klinische studie. Bij patiënten met NAFLD bleek berberine de normale leverarchitectuur, het lipide-en het bloedsuikermetabolisme te herstellen, waarbij significante verbeteringen werden waargenomen bij de populatie die alleen veranderingen in levensstijl toepaste.
probiotica
gezien het verband tussen de vele verstoringen van het spijsverteringsstelsel en verhoging van de leverenzymen, is het niet verwonderlijk dat probiotica ook zijn bestudeerd als behandeling voor NAFLD. Een recente meta-analyse vat de collectieve bevindingen goed samen.
honderd vierendertig patiënten met Nafl/NASH door leverbiopsie werden in deze analyse opgenomen en elke interventie die werd gebruikt in de vier gerandomiseerde, gecontroleerde onderzoeken die in aanmerking kwamen voor deze meta-analyse was uniek (Lactobacillus bulgaricus en Streptococcus thermophilus gedurende drie maanden; Lactobacillus GG gedurende acht weken; Bifidobacterium longum en fructooligosacchariden (FOS) gedurende 24 weken; en een eigen combinatie van Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus, en Bifidobacterium bifidum gedurende zes maanden). De dosering van probiotica varieerde van 500 miljoen tot 12 miljard kolonievormende eenheden (CFU ‘ s) per dag. De probiotische behandelingen bleken de ALAT-en ASAT-spiegels significant te verlagen met respectievelijk -23,71 UI/L en -19,77 UI / L. Significante verbeteringen in totaal cholesterol, tumornecrosefactor (TNF)-α-spiegels en insulineresistentie werden ook opgemerkt.
twee aanvullende klinische studies onderzochten probiotica als behandeling voor pediatrische NAFLD. In een dubbelblinde, placebogecontroleerde, pilot studie, twaalf kinderen, met een gemiddelde leeftijd van 10.7 jaar oud, met door middel van echoscopie gediagnosticeerde leververvetting en aanhoudende transaminaseverhoging, kregen dagelijks 12 miljard CFU ‘ s L. rhamnosus GG of placebo gedurende 8 weken. De behandeling met het probioticum verlaagde significant de ALAT-waarden in vergelijking met placebo, maar de leverechogeniciteit en de ASAT-waarden veranderden niet. Bovendien namen anti-peptidoglycaanpolysaccharideantilichamen, een indicator van bacteriën of bacteriële membraantranslocatie door de intestinale barrière, significant af bij kinderen die de probiotica kregen in vergelijking met placebo. De tweede studie onderzocht de behandeling van kinderen met een door biopsie bewezen NAFLD met VSL #3, een mengsel met hoge potentie van 8 probiotische stammen (waaronder Streptococcus thermophilus, 3 Bifidobacteria spp., en 4 Lactobacillus spp.), vergeleken met placebo. Bij kinderen die de probiotica kregen, waren de vetleverscores significant verbeterd, waarbij de kans op geen, lichte, matige of ernstige leververvetting aan het einde van het onderzoek 21%, 70%, 9% en 0% was vergeleken met 0%, 7%, 76% en 17% in de placebogroep.
conclusie
er is een breed scala aan veilige en effectieve opties beschikbaar die het herstel van de gezondheid bij mensen met NAFLD ondersteunen. Hoewel elk individu verschillende onderliggende mechanismen kan hebben die bijdragen aan leverdysfunctie en inflammatoire veranderingen, kunnen elk van deze ondersteunende natuurlijke middelen—en vele andere (zie Tabel 2)—de normale leverfunctie ondersteunen bij personen met deze uitdagingen.
Tabel 2: nutritionele en Botanische interventies voor NAFLD. Voedingsstoffen zoals deze moeten worden gebruikt onder begeleiding van een gekwalificeerde en erkende arts in de gezondheidszorg.
| nutriënt | dosering | mechanisme |
| fosfatidylcholine (PC), een bron van choline | 1,5 g tweemaal daags bij de maaltijd (PC) of 200 mg tweemaal daags (choline) | Choline is een vaak voorkomende dieettekort. PC is noodzakelijk voor de productie van gal en beschermende gastro-intestinale mucosa barrière. |
| Mariadistelzaad | 140 tot 200 mg eenmaal tot driemaal daags | hepatoprotectief. Ondersteunt hepatische glutathion niveaus, stabiliseert galzout export pomp (BSEP), en activeert FXR routes. |
| Berberine HCl | 500 mg twee-tot driemaal daags | verbetert de serum glucose-en lipidenprofielen, waardoor ook het levervetgehalte afneemt. |
| probiotica, waaronder stammen zoals B. longum, B. bifidum, S. thermophilus, L. rhamnosus, L. acidophilus en L. plantarum | 12 miljard kolonievormende eenheden (CFU ‘ s) dagelijks | verbeterde de functie van de darmepitheliale barrière en verminderde intestinale en systemische ontsteking. |
| Acetylglutathion | 300 mg dagelijks | verbetert het ontgiftende vermogen van hepatocyten. |
| N-acetylcysteïne (NAC) | 500-600 mg tweemaal daags, het best ingenomen op de lege maag | NAC blokkeert de voortplanting van lipideperoxidatie en ondersteunt de hepatische glutathionspiegels. |
| vitamine E (tocoferolen)
of tocotriënolen |
400 tot 1200 IE dagelijks met voedsel
200 tot 300 mg tweemaal daags met voedsel |
beschermende antioxidant.
tocotriënolen verminderen de triglyceridenaccumulatie door het reguleren van vetzuursynthase en carnitinepalmitoyltransferase-enzymen, wat leidt tot een vermindering van leverontsteking en endoplasmatische reticulumstress. |
| omega-3 essentiële vetzuren | 2-4 g per dag, bij maaltijden | Omega-3 meervoudig onverzadigde vetzuren zijn bekend dat ze sterolregulerend elementbindend eiwit-1c downreguleren en peroxisoom proliferator-geactiveerde receptor Alfa upreguleren, waardoor de vetzuuroxidatie wordt bevorderd en steatose wordt verminderd. |