Introduction
spanningsgesloten kaliumkanalen vormen een grote en diverse familie die evolutionair behouden blijft. Er zijn 40 genen die behoren tot 12 subfamilies. Deze KV kanalen vertonen brede distributies in het zenuwstelsel en andere weefsels. Voor prikkelbare cellen zoals neuronen, cardiomyocytes, en spieren, regelen KV kanalen de golfvorm en het afvuren patroon van actiepotentialen. De kanalen van KV kunnen ook het celvolume, de proliferatie, en de migratie van een brede waaier van celtypes regelen.
Spanningsgesloten kaliumkanalen (KV) behoren tot een van de grootste en sterk evolutionair geconserveerde ionenkanaalfamilies . Elk KV-kanaal bevat vier soortgelijke of identieke porievormende α-subeenheden, en het kan ook extra β-subeenheden bevatten die de kanaalfunctie en/of lokalisatie kunnen beïnvloeden . Elke porievormende subeenheid van KV-kanalen bevat zes transmembraansegmenten (S1-S6), waarbij de eerste vier transmembraansegmenten (S1-S4) de spanningssensor vormen en de laatste twee transmembraansegmenten een porielus (S5-P-S6) flankeren als het poriedomein. Naast de chromosoomlocatie van elk KV-kanaalgen in mens, muis en rat, zijn de fysiologische en farmacologische eigenschappen van het kanaal, en zijn weefseldistributie en pathofysiologie verstrekt door de Ionenkanaaldatabase door het Subcomité voor Spanningsgesloten kaliumkanalen van het Nomenclatuurcomité van de International Union of Pharmacology (NC-IUPHAR). Dit artikel geeft een inleiding tot de diversiteit en functies van spanningsgesloten kaliumkanalen.
evolutionair behoud van kaliumkanalen
de k + – selectiviteit die ontstond in prokaryoten wordt bewaard in een groot aantal kaliumkanalen met een opmerkelijke diversiteit . Zoals getoond in Figuur 1, kan een evolutionaire boom van het voltage-gated kation channel superfamily worden voorgesteld op basis van de vergelijking van kanaalgenen in het menselijke genoom met die in de genomen van andere metazoanen zoals muis, Kip, kogelvis, tunicaat, fruitvlieg, mug, nematode en zeeanemoon . Deze evolutionaire boom voorziet een enkele oorsprong van de k+-selectiviteit voor het inwendig rectificeren van kalium (Kir) kanalen, voltage-gated kalium (KV) kanalen, en de twee-pore kalium (K2P) kanalen. Het is belangrijk om op te merken, nochtans, dat een verschillende k+-selectiviteit waarschijnlijk met het evolutionarily behouden organelle K+ kanaal wordt geassocieerd dat in endosomes en lysosomes verblijft .
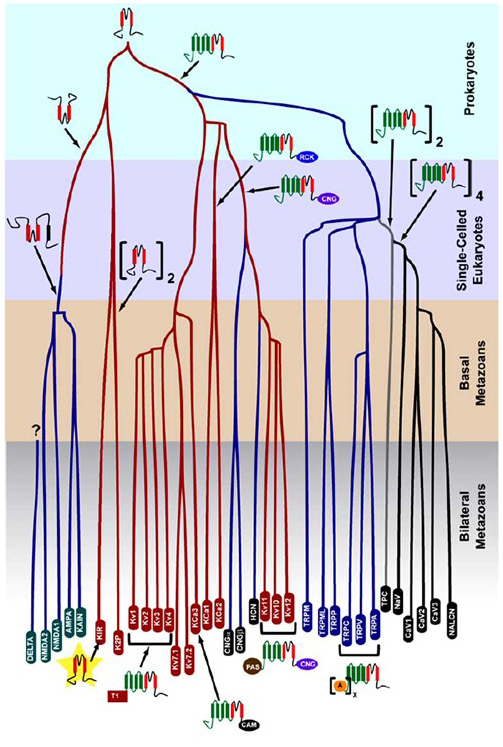
figuur 1. Een evolutionaire boom voor het ontstaan van de spanning-gated kation channel superfamily. Gebaseerd op genoom-brede analyses van ionenkanalen van cnidarianen en bilaterale metazoanen , toont deze evolutionaire boom een gemeenschappelijke oorsprong voor de k+-selectiviteit van kaliumkanalen (met familienamen in rode ovalen), die gerelateerd zijn aan tetramere cyclische nucleotide-gated kation (CNG) kanalen, hyperpolarisatie-gated kation (HCN) kanalen en TRP kanalen, de dimere TPC kanalen, en de monomere Na+, Ca2+ en NALCN kanalen. De lengte van de tak weerspiegelt geen tijd. De Gen familienamen onderaan geven individuele takken aan. De ionotrope glutamaatreceptoren zijn inbegrepen gebaseerd op de hypothese dat zij uit een inversie van het porie-vormend domein van het kaliumkanaal met twee transmembraansegmenten (rood) voortkwamen. Het voltage-sensor domein heeft vier transmembraansegmenten (groen). A: ankryin herhaalt; CAM: calmodulin-bindend domein; CNG: cyclisch nucleotide-bindend domein; PAS: Per-ARNT-Sim domein; RCK: regulator van geleidbaarheid van K+ domein; T1: tetramerisatie domein.
diversiteit van spanningsgesloten kaliumkanalen
het menselijk genoom bevat ~80 kaliumkanaalgenen waarvan 40 genen coderen voor spanningsgesloten kaliumkanaalporiënvormende subeenheden die in 12 subfamilies vallen (Fig. 2). Fysiologisch onderverdeeld in a-type kaliumkanalen die snelle inactivatie vertonen en vertraagde rectifier kaliumkanalen zonder snelle inactivatie, zijn deze KV-kanalen moleculair en functioneel divers. Snelle inactivatie, die de duur van de actiepotentiaal tijdens repetitief vuren kan beïnvloeden, is duidelijk in KV1-kanalen die KV1 bevatten.4 of KVß1, kv3 kanalen, en KV4 kanalen . De vertraagde gelijkrichter kalium stroom oorspronkelijk gekenmerkt door Hodgkin en Huxley voor zijn rol in actiepotentiaal waarschijnlijk correspondeert met de inktvis KV1 kanalen die kunnen vertrouwen op RNA bewerken om de flexibele functionele diversiteit te bereiken als veel kleine axonen van de gigantische vezel kwab neuronen fuseren tot de pijlinktvis Reus axon met een grotere actiepotentiaal geleidingssnelheid .
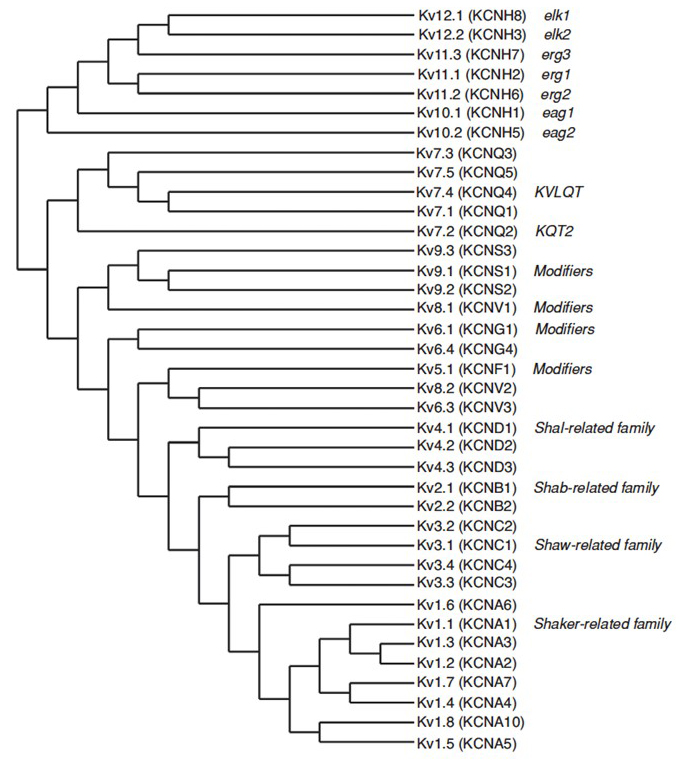
Figuur 2. Fylogenetische boom voor de KV1-12 families. Deze fylogenetische boom wordt gegenereerd gebaseerd op analyses van het hydrofobe domein dat de zes transmembraansegmenten (S1-S6) bevat . Zowel de IUPHAR en de HGNC (tussen haakjes) namen worden getoond, samen met andere veelgebruikte namen voor deze voltage-gated kaliumkanalen.
opmerkelijke diversiteit van KV-kanalen kan worden bereikt door de mix en match van KV-kanaalsubeenheden. Binnen elk van de KV1 -, KV2 -, KV3 -, KV4-en KV7-families kunnen homomere en heteromere kanalen ontstaan met een reeks functionele eigenschappen . KV2-familieleden kunnen ook samenkomen met kv5 -, KV6 -, KV8-of KV9-familieleden met beperktere expressiepatronen in het zenuwstelsel en gladde spieren, zoals schematisch weergegeven in Fig. 3.

Figuur 3. KV-kanaaldiversiteit via mix en match van porievormende kanaalsubeenheden. (A) de tetramere KV-kanalen met verschillende eigenschappen en distributie omvatten homomere KV1 -, KV2 -, KV3 -, KV4-en KV7-kanalen, heteromere kanalen gevormd door verschillende leden binnen elk van deze KV-kanaalfamilies, en heteromere kanalen gevormd door assemblage van KV2-familieleden met kv5 -, KV6 -, KV8-of KV9-familieleden . Kv5 -, KV6 -, KV8-en KV9-families geven aanleiding tot homomere kanalen die elektrisch stil zijn, waarschijnlijk vanwege hun retentie in het endoplasmatisch reticulum, vandaar dat ze KVS worden genoemd. (B) De Assemblage van KV2 – en KVS-familieleden heeft betrekking op hun cytoplasmatische n-en c-terminaldomeinen. (C, D) assemblage van KV2-en KVS-familieleden leidt tot heteromere kanalen met verschillende spanningsafhankelijkheid (C) en gating-mechanismen (D) in vergelijking met homomere kanalen gevormd door KV2-familieleden .
functionele verschillen in spanningsafhankelijkheid en kinetiek van KV-kanalen liggen ten grondslag aan hun differentiële bijdragen aan actiepotentiaal modulatie (Fig. 4). Terwijl de kanalen KV1, KV4 en KV7 lage niveaus van membraandepolarisatie voor hun activering vereisen, worden de kanalen KV2 en KV3 geactiveerd door Grotere depolarisatie. De eerste, laagspanningsgeactiveerde KV-kanalen kunnen de drempel voor het genereren van actiepotentialen en het aantal actiepotentialen dat wordt gegenereerd tijdens depolarisatie of prikkelende synaptische potentialen beïnvloeden. Daarentegen kunnen de hoogspanningsgeactiveerde KV-kanalen de duur en het ontstekingspatroon van de actiepotentiaal moduleren . De kinetiek van KV-kanalen beïnvloedt ook de manier waarop ze bijdragen aan het genereren van actiepotentiaal. Terwijl de laagspanning geactiveerde KV1-kanalen met snelle activering de actiepotentiaal drempel en golfvorm kunnen beïnvloeden, kunnen de hoogspanning geactiveerde KV3-kanalen en KV2-kanalen sequentieel worden geactiveerd tijdens een actiepotentiaal vanwege het verschil in hun activatiekinetiek, en kunnen KV2-kanalen meer langdurige effecten hebben vanwege hun trage inactivatiekinetiek. Bovendien kunnen KV4-kanalen met snelle inactivering bijdragen aan het verschil in de actiepotentiele golfvorm tijdens repetitief vuren, als gevolg van onderdrukking van de KV4-kanaalactiviteit door depolarisatie .
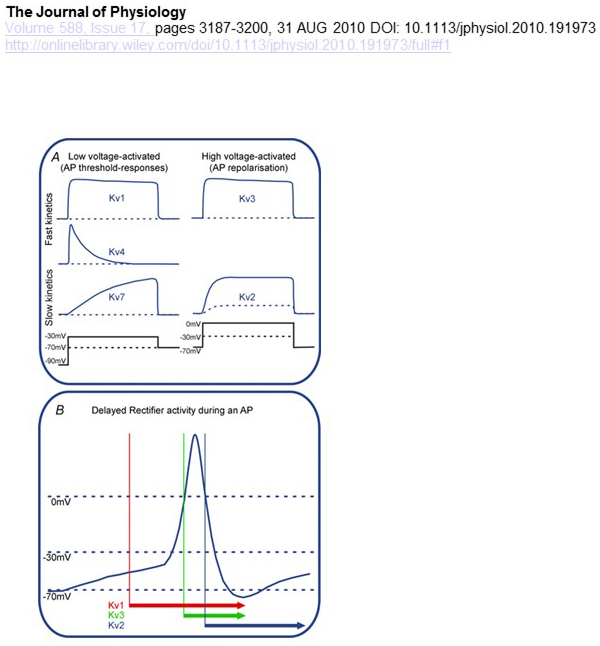
Figuur 4. Functionele verschillen tussen KV-kanalen en hun bijdrage aan het actiepotentieel. (A) verschillende KV-kanalen hebben verschillende spanningsafhankelijkheid voor activering en verschillende kinetiek . (B) de laagspanning geactiveerde KV1 kanalen met snelle kinetiek open als de cel wordt gedepolariseerd naar de drempel voor actiepotentiaal generatie. Terwijl zowel KV2-als KV3-kanalen hoogspanning geactiveerd zijn, openen KV3-kanalen eerder dan KV2-kanalen tijdens een actiepotentiaal. KV2 kanalen kunnen ook langer duren om te sluiten na een actie potentieel .
potentiële therapeutische toepassingen van kaliumkanaalmodulatoren
het vermogen van kaliumkanaalmodulatoren om de actiepotentiele ontstekingspatronen te veranderen heeft de vraag doen rijzen of deze van therapeutische waarde zouden kunnen zijn . Zoals aangegeven in Fig. 5, verschillende neurologische en psychische stoornissen kunnen veranderingen in de actie potentieel afvuren patronen, die kunnen worden gemoduleerd door KV kanaal activatoren en blokkers . Spanningsgesloten kaliumkanalen kunnen ook een rol spelen bij celproliferatie en migratie; KV-kanaalmodulatoren zijn daarom overwogen voor potentiële behandelingen van kankergroei en metastase . In Fig. 6, wordt de KV1. 2-kanaalstructuur schematisch gebruikt om te illustreren dat KV-kanaalmodulatoren kanaalactiviteit kunnen remmen door de kanaalpermeatieweg af te sluiten, zoals in het geval van buitenste-porie-blokkerende toxines en binnenste porie-blokkers, of via hun interactie met de spanningssensor om de gesloten toestand van het kanaal te stabiliseren, zoals in het geval van gating modifier toxines. Alternatief, sommige kleine molecules handelen door aan de gating machinery als gating modifiers te binden, of door met de interface tussen de α – En β-subeenheden in wisselwerking te staan om kanaalactiviteit te veranderen .
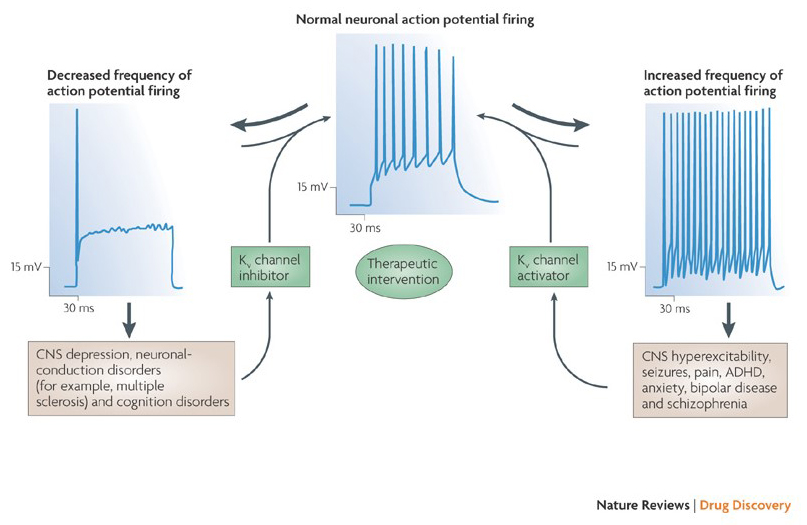
Figuur 5. Mogelijke toepassingen van KV-kanaalmodulatoren. Omdat abnormale actie potentieel afvuren patronen zijn geassocieerd met ziekten zoals epilepsie en multiple sclerose, KV kanaal activatoren en remmers zijn overwogen voor potentiële therapeutische behandelingen van ziekten die verandering van neuronale prikkelbaarheid impliceren .
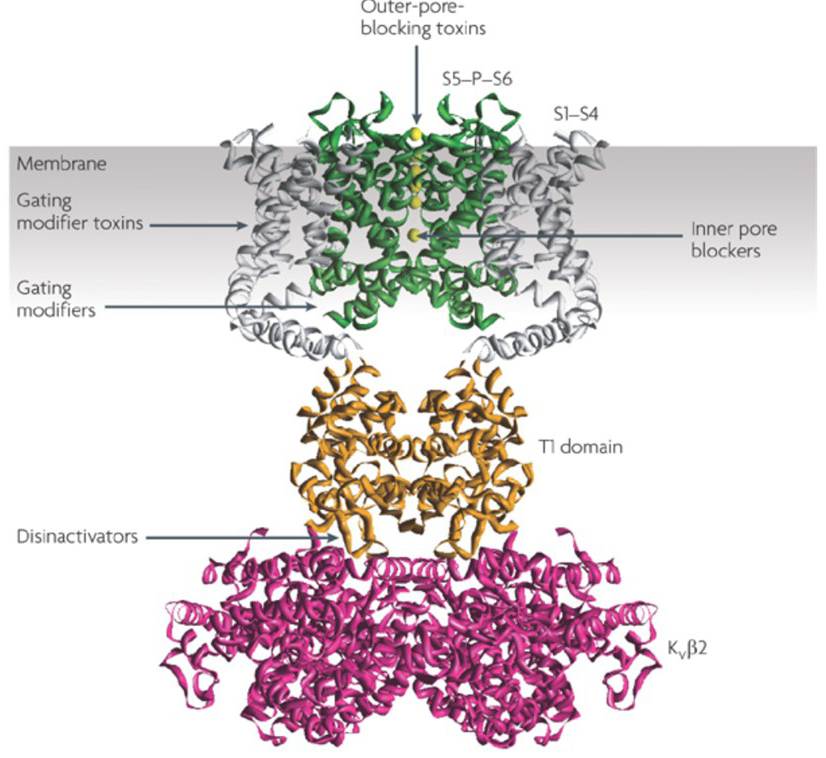
Figuur 6. Voorbeelden van werkingsmodi van KV-kanaalmodulatoren. Er zijn verscheidene verschillende manieren voor peptide toxines en kleine molecules om KV-kanaalactiviteit te moduleren. De KV1. 2 structuur wordt getoond met de porie domeinen (S5-P-S6) in groen, de spanning sensor domeinen (S1-S4) in grijs, de T1 tetramerisatie domeinen in oranje, en de kvß2 hulp subeenheden in magenta . De buitenste-porie-blokkerende gifstoffen van schorpioenen, zeeanemonen, slangen, en kegelslakken kunnen aan de buitenste vestibule binden en ionenpermeatie blokkeren. Gating modifier toxines van spinnen zoals hanatoxine kunnen interageren met de spanningssensor om de stabiliteit van de gesloten toestand te verhogen, waardoor rechtsverschuiving van de spanningsafhankelijkheidscurve voor kanaalactivering wordt veroorzaakt. Er zijn ook kleine molecuulkanaalmodulatoren die binden aan de binnenporie (binnenste porie blokkers), de gating scharnieren (gating modifiers), of de interface tussen de α – En β-subeenheden (disinactivators).
Voltage-gated kalium kanaal structuur
De opmerkelijke selectiviteit van kalium kanalen, waardoor K+ ionen gaan door het kanaal porie met ordes van grootte groter gemak dan de kleinere Na+ – ionen en met de buurt diffusie-gelimiteerd beoordelen , is te verklaren door het vermogen van de ruggengraat carbonylen van de selectiviteit filter te coördineren K+ ionen, die zijn grotendeels ontdaan van hun hydratatie schelpen , dus dat er meer dan één K+ – ion wordt door deze smalste deel van de poriën in tandem (Afb. 7) – een lange porie voor één dossier K + ion permeatie zoals predicated.
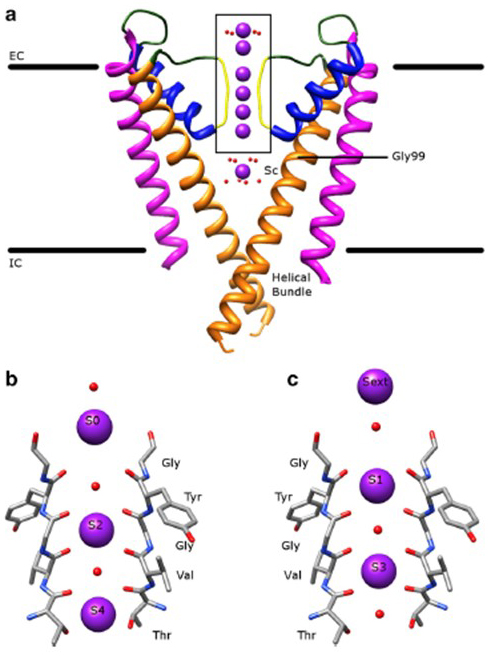
Figuur 7. Het poriedomein van kaliumkanalen. (a) structuur van KcsA in de geleidende staat (PDB: 1K4C), met de buitenste helices in magenta, binnenste helices in oranje, poriën helices in blauw, en de selectiviteitsfilter in geel. K + ionen zijn in paars terwijl de omringende watermoleculen in rood zijn. EC: extracellulair; IC: intracellulair. (b, c) het selectiviteitsfilter in het boxed-gebied van de KCSA-structuur wordt weergegeven met K+ – ionen die ofwel de S2-en S4-posities (b) innemen, ofwel de S1-en S3-posities (c), om de k+ – ionpermeatie in één bestand te illustreren .
de spanningsafhankelijkheid van KV-kanaalactivering is afgeleid van hun spanningssensordomeinen . Zoals in Fig. 8, kV kanalen en verwante kanalen zoals voltage-gated natrium kanalen en TRPV1 kanalen in dezelfde superfamilie hebben soortgelijke regelingen van hun porie domeinen en voltage sensor domeinen. Het spanningssensordomein van een subeenheid interageert met het poriedomein van een naburige subeenheid in een domeinwisselconfiguratie, en binnen een spanningssensor kunnen de positief geladen arginineresiduen op S4 met negatief geladen zure residuen in naburige helices interageren (Fig. 9).
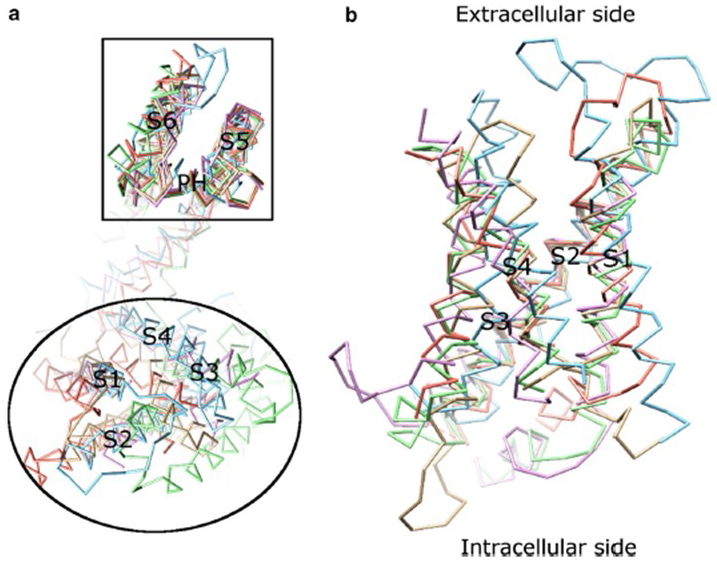
Figuur 8. Het spanningssensordomein van spanningsgesloten kaliumkanalen. (a) het uitlijnen van het poriedomein (S5-P-S6) van verschillende ionenkanalen onthult dat hun spanningssensordomeinen (S1-S4) een verscheidenheid van oriëntaties kunnen aannemen (van de extracellulaire kant bekeken). (b) superpositie van het spanningssensordomein van KV1.2 (PDB: 3LUT, Lichtmagenta) met de spanningssensordomeinen van MlotiK1 (PDB: 3BEH, lichtbruin) , NaVAb (PDB: 3RVY, lichtgroen) , NaVRh (PDB: 4DXW, lichtoranje) en TRPV1 (PDB: 3J5P, Lichtblauw) (gezien vanaf het membraan) .
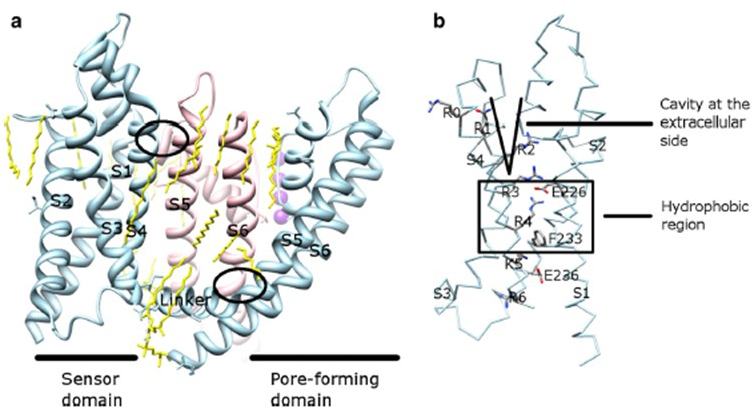
figuur 9. Contacten tussen het poriedomein en het spanningssensordomein van KV-kanalen. (A) de KV1.2-KV2.1 chimera (PDB: 2R9R) met het spanningssensordomein van een subeenheid (Lichtblauw) die contact maakt met het poriedomein van een naburige subeenheid (roze). De contacten aan de intracellular kant impliceren de interactie van S4-S5 linker met S6, en de contacten aan de extracellular kant impliceren de interactie tussen S1 en de porie helix . Lipiden (geel) rond het kanaal en tussen het poriedomein en het spanningssensordomein zijn detecteerbaar in de kristalstructuur. b) Basisresiduen van S4 en zure residuen in hun nabijheid in het spanningssensordomein .
Kanaalaandoeningen gekoppeld aan Spanningsgesloten kaliumkanalen
Spanningsgesloten kaliumkanalen worden grofweg uitgedrukt in een verscheidenheid aan weefsels. In neuronen zijn ze gericht op verschillende subcellulaire compartimenten (Fig. 10), en kanalen van verschillende subeenheid samenstellingen kunnen aanwezig zijn in verschillende subpopulaties van neuronen . De veranderingen van KV-kanaalgenen kunnen neurologische ziekten zoals episodische ataxie en epilepsies, hartkwalen, en doofheid veroorzaken . Het evolutionaire behoud van de functie van het kV-kanaal is duidelijk, bijvoorbeeld, van de gelijkaardige bewegingswanorde die door mutatie van KV1 orthologs in mens, muis, en de fruitvlieg wordt veroorzaakt .
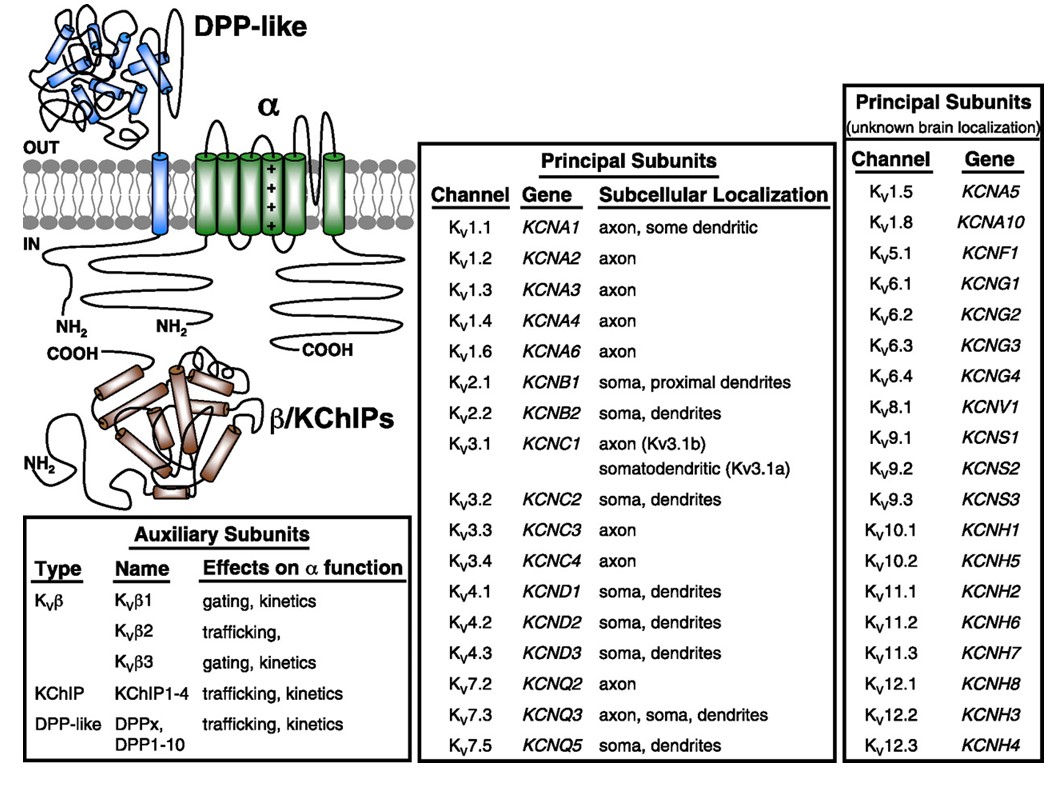
Figuur 10. Subcellulaire verdeling van voltage-gated kaliumkanalen. Het schema linksboven toont een KV4-kanaal met twee verschillende ondersteunende subeenheden. De subcellulaire lokalisatie van diverse KV kanalen in zoogdier centrale neuronen wordt vermeld in de middelste doos .
referenties en noten
1.Hille, B., Ionic Channels of Excitable Membranes, 3rd, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K(+) kanalen: functie-structureel overzicht. Compr Physiol, 2012. 2 (3): p. 2087-149.
3.Vacher, H., D. P. Mohapatra, and J. S. Trimmer, lokalisatie en targeting van spanningsafhankelijke ionenkanalen in centrale neuronen van zoogdieren. Physiol Rev, 2008. 88 (4): p. 1407-47.
4.Jegla, T. J., et al., Evolutie van de menselijke ionenkanaalset. Kam Chem High Throughput Screen, 2009. 12 (1): blz. 2-23.
5.Cang, C., et al., TMEM175 is een Organelle K(+) kanaal dat lysosomale functie regelt. Cel, 2015. 162 (5): blz. 1101-12.
6.Hodgkin, A. L. en A. F. Huxley, stromen gedragen door natrium – en kaliumionen door het membraan van het reuzenaxon van Loligo. J Physiol, 1952. 116 (4): blz. 449-72.
7.Rosenthal, J. J., T. I. Liu, and W. F. Gilly, een familie van vertraagde gelijkrichter KV1 cDNA ‘ s die celtype-specifieke expressie in de squid stellate ganglion/giant fiber kwab complex. J Neurosci, 1997. 17 (13): p. 5070-9.
8.Young, J. Z., fuseerde neuronen en synaptische contacten in de gigantische zenuwvezels van koppotigen. Phil Trans R Soc Lond B, 1939. 229: blz. 465-503.
9.Rosenthal, J. J. en F. Bezanilla, uitgebreide bewerking van mRNAs voor de squid vertraagde gelijkrichter K+ kanaal reguleert subeenheid tetramerisatie. Neuron, 2002. 34 (5): blz. 743-57.
10.Jan, L. Y. en Y. N. Jan, Voltage-gated kalium kanalen en de diversiteit van elektrische signalering. J Physiol, 2012. 590 (11): p. 2591-9.
11.Johnston, J., I. D. Forsythe, en C. Kopp-Scheinpflug, Going native: voltage-gated potassium channels controlling neuronal excitability. J Physiol, 2010. 588 (Pt 17): blz.3187-200.
12.Bocksteins, E., kv5, KV6, KV8 en KV9 subeenheden: geen eenvoudige stille omstanders. J Gen Physiol, 2016. 147(2): blz. 105-25.
13.Wulff, H., N. A. Castle, en L. A. Pardo, Voltage-gated kalium kanalen als therapeutische doelwitten. Nat Rev Drug Discov, 2009. 8 (12): blz. 982-1001.
14.Bates, E., Ionenkanalen in ontwikkeling en kanker. Annu Rev Cell Dev Biol, 2015. 31: p. 231-47.
15.Huang, X. En L. Y. Jan, gericht op kaliumkanalen bij kanker. J Cell Biol, 2014. 206 (2): blz. 151-62.
16.Huang, X., et al., EAG2 kaliumkanaal met evolutionarily behouden functie als doel van de hersentumor. Nat Neurosci, 2015. 18 (9): p. 1236-46.
17.Kunzelmann, K., Ion kanalen en kanker. J Membr Biol, 2005. 205 (3): blz. 159-73.
18.Li, M. en Z. G. Xiong, ionenkanalen als doelwit voor kankertherapie. Int J Physiol Pathophysiol Pharmacol, 2011. 3 (2): blz. 156-66.
19.Pardo, L. A., Voltage-gated kaliumkanalen in celproliferatie. Fysiologie (Bethesda), 2004. 19: blz. 285-92.
20.Urrego, D., et al., Kaliumkanalen in celcyclus en celproliferatie. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): p. 20130094.
21.Zhou, Y., et al., Chemie van ioncoördinatie en hydratatie onthuld door een K + kanaal-Fab complex op 2,0 a resolutie. Natuur, 2001. 414 (6859): p. 43-8.
22.MacKinnon, R., kaliumkanalen. FEBS Lett, 2003. 555 (1): blz. 62-5.
23.Kuang, Q., P. Purhonen, and H. Hebert, Structure of potassium channels. Cell Mol Life Sci, 2015. 72 (19): blz. 3677-93.
24.Isacoff, E. Y., L. Y. Jan, and D. L. Minor, Jr., Conduits of life ‘ s spark: a perspective on ion channel research since the birth of neuron. Neuron, 2013. 80 (3): blz. 658-74.
25.Swartz, K. J., Ik voel spanning over lipide membranen. Natuur, 2008. 456 (7224): p. 891-7.
26.Nusser, Z., differentiële subcellulaire verdeling van ionenkanalen en de diversiteit van neuronale functie. Curr Opin Neurobiol, 2012. 22 (3): blz. 366-71.
27.Lujan, R., organisatie van kaliumkanalen op het neuronale oppervlak. J Chem Neuroanat, 2010. 40 (1): blz. 1-20.
28.Abriel, H. en E. V. Zaklyazminskaya, cardiale kanaalopathieën: genetische en moleculaire mechanismen. Gene, 2013. 517 (1): blz. 1-11.
29.Kullmann, D. M. en M. G. Hanna, neurologische aandoeningen veroorzaakt door erfelijke Ion-channel mutaties. Lancet Neurol, 2002. 1 (3): blz. 157-66.
30.Lehmann-Horn, F. en K. Jurkat-Rott, Voltage-gated ion kanalen en erfelijke ziekte. Physiol Rev, 1999. 79 (4): p. 1317-72.
31.Villa, C. En R. Combi, kaliumkanalen en humane epileptische fenotypen: een bijgewerkt overzicht. Front Cell Neurosci, 2016. 10: blz. 81.
32.Long, S. B., E. B. Campbell en R. Mackinnon, kristalstructuur van een zoogdiervoltageafhankelijke Shaker familie K + kanaal. Wetenschap, 2005. 309 (5736): p. 897-903.
33.Chen, X., et al., Structuur van de volledige Shaker kaliumkanaal KV1. 2 door normal-mode-gebaseerde X-ray kristallografische verfijning. Proc Natl Acad Sci U S A, 2010. 107 (25): blz. 11352-7.
34.Clayton, G. M., et al., Structuur van de transmembrane gebieden van een bacterieel cyclisch nucleotide-geregeld kanaal. Proc Natl Acad Sci U S A, 2008. 105 (5): blz. 1511-5.
35.Payandeh, J., et al., De kristalstructuur van een voltage-gated natriumkanaal. Natuur, 2011. 475 (7356): p. 353-8.
36.Zhang, X., et al., Kristalstructuur van een ortholoog van het nachbac voltage-gated natriumkanaal. Natuur, 2012. 486 (7401): p. 130-4.
37.Liao, M., et al., Structuur van het TRPV1 ionenkanaal bepaald door elektronencryo-microscopie. Natuur, 2013. 504 (7478): p. 107-12.
38.Long, S. B., et al., Atomaire structuur van een voltage-afhankelijk K+ kanaal in een lipide membraan-achtige omgeving. Natuur, 2007. 450 (7168): p. 376-82.