powrót do pisania struktur Lewisa dla cząsteczek
struktura szkieletu kowalencyjnej cząsteczki może być często określona przez rozważenie wartościowości atomów składowych. Zazwyczaj atom, który tworzy największą liczbę wiązań znajduje się w centrum szkieletu, gdzie może połączyć się z maksymalną liczbą innych atomów.
przykład 1: kwas Podchlorowy ma wzór cząsteczkowy HOCl. Narysuj
wzór strukturalny.
rozwiązanie istnieje kilka możliwych sposobów łączenia atomów ze sobą
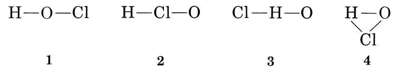
zwykle wartość H wynosi 1, więc struktury 3 i 4, które mają dwa wiązania do H, mogą zostać wyeliminowane. Zwykle Walencja Cl jest również 1, a więc struktura 2 może być również wykluczona. Struktura 1 pokazuje H tworzące jedno wiązanie, CL tworzące jedno, a O tworzące dwa, w zgodzie ze zwykłymi wartościami, i tak jest wybierana.
całkowita liczba elektronów walencyjnych dostępnych jest 1 z H plus 6 Z O plus 7 z Cl, lub 14. Wypełniając je w szkielecie, który mamy
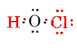
zauważ, że O, który miał największą Walencję, znajduje się w centrum szkieletu.
przykład 2:
narysuj wzór strukturalny dla hydroksyloaminy, Nh3o.
roztwór w tym przypadku N ma największą wartość (3), a następnie O (2) I H (1). Zarówno N, jak I O mogą tworzyć „mosty” między innymi atomami, ale H nie może. Dlatego umieszczamy N I O W Środku szkieletu, aby dać
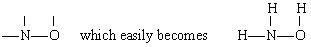
przez dodanie trzech atomów H.
5 + 3 + 6 = 14 elektronów walencyjnych z N, 3H I O. można je umieścić w następujący sposób:
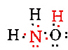
po określeniu diagramu Lewisa Wzór cząsteczkowy jest często przepisywany, aby przypomnieć nam, czym jest wzór strukturalny. Na przykład wzór cząsteczkowy dla hydroksyloaminy jest zwykle zapisywany NH2OH zamiast NH3O, aby przypomnieć nam, że dwa H są związane z N, A jedno z O. Zakłada się, że osoba czytająca wzór zda sobie sprawę, że N I O mają jeden elektron walencyjny, który dzieli się ze sobą, łącząc —NH2 z —OH. W niektórych przypadkach więcej niż jedna struktura szkieletowa spełnia wartościowość każdego atomu i regułę oktetu. Na przykład, można sprawdzić, że wzór cząsteczkowy C2H6O odpowiada obu z następujących:
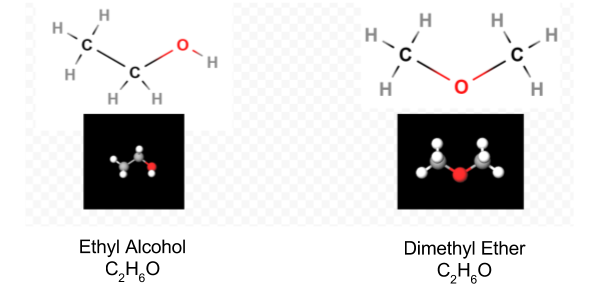
w takim przypadku możemy tylko zdecydować, jaką strukturę molekularną posiadamy przez eksperyment. Właściwości alkoholu etylowego po rozcieńczeniu wodą i spożyciu są dobrze znane. Eter dimetylowy jest gazem. Podobnie jak eter dietylowy stosowany w salach operacyjnych, jest wysoce wybuchowy i może uśpić. Dwie cząsteczki, takie jak eter dimetylowy i alkohol etylowy, które mają ten sam wzór cząsteczkowy, ale różne wzory strukturalne są uważane za izomery.
powrót do pisania struktur Lewisa dla cząsteczek
podziękowania:
cząsteczki C2H6O i ich struktury szkieletowe zostały stworzone przy użyciu MolView.