szybkość reakcji
Zmiana szybkości reakcji przy zmianie halogenu
szybkość reakcji wzrasta w kolejności HF – HCl – HBr – HI. Fluorowodór reaguje znacznie wolniej niż pozostałe trzy i jest zwykle ignorowany w mówieniu o tych reakcjach.
gdy halogenki wodoru reagują z alkenami, Wiązanie wodorowo-halogenowe musi zostać zerwane. Siła wiązania spada w miarę przechodzenia z HF do HI, a wiązanie wodorowo-fluorowe jest szczególnie silne. Ponieważ trudno jest przerwać wiązanie między Wodorem a fluorem, dodanie HF musi być powolne.
zmiana stawek przy zmianie alkenów
dotyczy to zarówno alkenów niesymetrycznych, jak i symetrycznych. Dla uproszczenia podane poniżej przykłady są symetryczne – ale nie muszą być.
szybkość reakcji wzrasta w miarę komplikowania się alkenów – w sensie liczby grup alkilowych (takich jak grupy metylowe) przyłączonych do atomów węgla na obu końcach wiązania podwójnego. Na przykład:
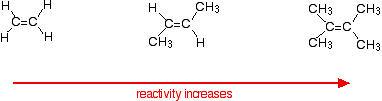
istnieją dwa sposoby patrzenia na przyczyny tego zjawiska-oba muszą wiedzieć o mechanizmie reakcji.
alkeny reagują, ponieważ elektrony w wiązaniu pi przyciągają rzeczy z dowolnym stopniem ładunku dodatniego. Pomoże w tym wszystko, co zwiększy gęstość elektronów wokół wiązania podwójnego.
grupy alkilowe mają tendencję do „odpychania” elektronów od siebie w kierunku wiązania podwójnego. Im więcej masz grup alkilowych, tym bardziej ujemny staje się obszar wokół podwójnych wiązań.
im bardziej Ujemnie naładowany staje się ten region, tym bardziej przyciąga cząsteczki takie jak chlorek wodoru.
ważniejsza przyczyna leży jednak w stabilności jonu pośredniego powstałego podczas reakcji. Trzy przykłady podane powyżej wytwarzają te karbokacje (jony karbonium) w połowie fazy reakcji:
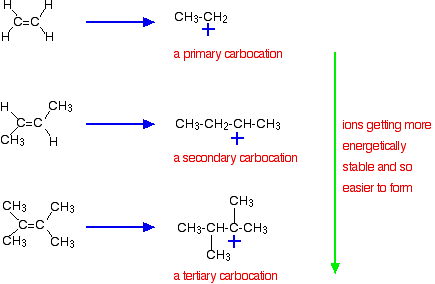
stabilność jonów pośrednich reguluje energię aktywacji reakcji. W kierunku bardziej skomplikowanych alkenów spada energia aktywacji reakcji. Oznacza to, że reakcje stają się szybsze.