cele nauczania
pod koniec tej sekcji będziesz mógł:
- napisz symbole Lewisa dla neutralnych atomów i jonów
- narysuj struktury Lewisa przedstawiające Wiązanie w prostych cząsteczkach
omówiliśmy różne rodzaje wiązań, które tworzą się między atomami i / lub jonami. We wszystkich przypadkach wiązania te obejmują udostępnianie lub przenoszenie elektronów walencyjnych powłoki między atomami. W tej sekcji zbadamy typową metodę przedstawiania elektronów walencyjnych i wiązań chemicznych, a mianowicie symbole Lewisa i struktury Lewisa.
Symbole Lewisa
używamy symboli Lewisa do opisu konfiguracji elektronów walencyjnych atomów i jonów monatomowych. Symbol Lewisa składa się z symbolu elementarnego otoczonego jedną kropką dla każdego z jego elektronów walencyjnych:
Rysunek 1 przedstawia symbole Lewisa dla pierwiastków trzeciego okresu układu okresowego.

Rysunek 1. Symbole Lewisa ilustrujące liczbę elektronów walencyjnych dla każdego pierwiastka w trzecim okresie układu okresowego.
Symbole Lewisa mogą być również użyte do zilustrowania powstawania kationów z atomów, jak pokazano tutaj dla sodu i wapnia:

podobnie, mogą być one użyte do pokazania tworzenia anionów z atomów, jak pokazano poniżej dla chloru i siarki:

Figura 2 pokazuje użycie symboli Lewisa do pokazania transferu elektronów podczas tworzenia związków jonowych.

Rysunek 2. Kationy powstają, gdy atomy tracą elektrony, reprezentowane przez mniej kropek Lewisa, natomiast aniony powstają, gdy atomy zyskują elektrony. Całkowita liczba elektronów nie zmienia się.
struktury Lewisa
używamy również symboli Lewisa, aby wskazać tworzenie wiązań kowalencyjnych, które są pokazane w strukturach Lewisa, rysunkach opisujących wiązania w cząsteczkach i jonach poliatomowych. Na przykład, gdy dwa atomy chloru tworzą cząsteczkę chloru, dzielą one jedną parę elektronów:

struktura Lewisa wskazuje, że każdy atom Cl ma trzy pary elektronów, które nie są używane w wiązaniu (zwane samotnymi parami) i jedną wspólną parę elektronów (zapisaną między atomami). Kreska (lub linia) jest czasami używany do wskazania wspólnej pary elektronów:

pojedyncza wspólna para elektronów nazywa się pojedynczym wiązaniem. Każdy atom Cl oddziałuje z ośmioma elektronami walencyjnymi: sześcioma w samotnych parach i dwoma w pojedynczym wiązaniu.
zasada oktetu
pozostałe cząsteczki halogenowe (F2, Br2, I2 i At2) tworzą wiązania podobne do tych w cząsteczce chloru: jedno pojedyncze wiązanie między atomami i trzy pojedyncze pary elektronów na atom. Dzięki temu każdy atom halogenu ma konfigurację elektronową gazu szlachetnego. Tendencja głównych atomów grupy do tworzenia wystarczającej liczby wiązań do uzyskania ośmiu elektronów walencyjnych jest znana jako zasada oktetu.
liczba wiązań, które atom może tworzyć, może być często przewidywana na podstawie liczby elektronów potrzebnych do osiągnięcia oktetu (ośmiu elektronów walencyjnych); jest to szczególnie prawdziwe w przypadku niemetali drugiego okresu układu okresowego (C, N, O I F). Na przykład, każdy atom pierwiastka z grupy 14 ma cztery elektrony w swojej zewnętrznej powłoce i dlatego potrzebuje czterech kolejnych elektronów, aby dotrzeć do oktetu. Te cztery elektrony można uzyskać, tworząc cztery wiązania kowalencyjne, jak pokazano tutaj dla węgla w CCl4 (tetrachlorek węgla) i krzemu w SiH4 (Silan). Ponieważ Wodór potrzebuje tylko dwóch elektronów, aby wypełnić swoją powłokę walencyjną, jest to wyjątek od reguły oktetowej. Elementy przejściowe i wewnętrzne elementy przejściowe również nie są zgodne z zasadą oktetu:

pierwiastki grupy 15, takie jak azot, mają pięć elektronów walencyjnych w atomicznym symbolu Lewisa: jedną samotną parę i trzy niesparowane elektrony. Aby otrzymać oktet, Atomy te tworzą trzy wiązania kowalencyjne, jak w NH3 (amoniaku). Tlen i inne atomy z grupy 16 otrzymują oktet tworząc dwa wiązania kowalencyjne:
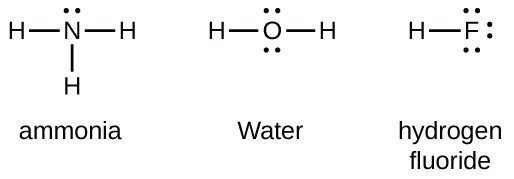
wiązania podwójne i potrójne
jak wcześniej wspomniano, gdy para atomów dzieli jedną parę elektronów, nazywamy to wiązaniem pojedynczym. Jednak para atomów może potrzebować więcej niż jednej pary elektronów, aby osiągnąć wymagany oktet. Wiązanie podwójne powstaje, gdy dwie pary elektronów są dzielone między parę atomów, jak między atomami węgla i tlenu w CH2O (formaldehyd) i między dwoma atomami węgla w C2H4 (etylen):
powstaje Wiązanie potrójne, gdy trzy pary elektronów są dzielone przez parę atomów, jak w gazie azotowym (N2):
pisząc struktury Lewisa z zasadą oktetu
dla bardzo prostych cząsteczek i jonów cząsteczkowych, możemy zapisać struktury Lewisa poprzez jedynie parowanie niesparowanych elektronów na atomach składowych. Zobacz te przykłady:

w przypadku bardziej skomplikowanych cząsteczek i jonów molekularnych warto postępować zgodnie z opisaną tutaj procedurą krok po kroku:
- Określ całkowitą liczbę elektronów walencyjnych (powłoki zewnętrznej).
- narysuj strukturę szkieletu cząsteczki, układając Atomy wokół atomu centralnego. (Ogólnie rzecz biorąc, najmniejszy element elektroujemny powinien być umieszczony w środku.) Połącz każdy atom z atomem centralnym za pomocą jednego wiązania (jednej pary elektronowej).
- rozłóż pozostałe elektrony jako samotne pary na końcowych atomach (z wyjątkiem wodoru), wypełniając oktet wokół każdego atomu.
- Umieść wszystkie pozostałe elektrony na atomie centralnym.
- przestawiaj elektrony zewnętrznych atomów, aby utworzyć wiele wiązań z atomem Centralnym w celu uzyskania oktetów, gdzie to możliwe.
ustalmy strukturę Pbr3 używając powyższych kroków:
- Krok 1: określić całkowitą liczbę elektronów walencyjnych (powłoki zewnętrznej).
\large \ begin{array} {l} \ \ \ phantom {\rule{0.8 em} {0ex}} {\text {PBr}}_{3} \ \ \ phantom {\rule{0.8 em} {0ex}} \ text {P: 5 elektronów walencyjnych/atom} \ times \text{1 atom}=5 \ \ \ underline{+\text{Br: 7 elektronów walencyjnych / atom} \ times \text{3 atomy}=21}\\ \ phantom {\rule{15.95em}{0ex}}= \ text{26 elektrony walencyjne} \ end{array}
- Krok 2: narysuj strukturę szkieletu cząsteczki, układając Atomy wokół atomu centralnego. (Ogólnie rzecz biorąc, najmniejszy element elektroujemny powinien być umieszczony w środku.) Połącz każdy atom z atomem centralnym za pomocą jednego wiązania (jednej pary elektronowej).

- Krok 3: rozłóż pozostałe elektrony jako samotne pary na końcowych atomach (z wyjątkiem wodoru), uzupełniając oktet wokół każdego atomu.
-
 Krok 4: Umieść wszystkie pozostałe elektrony na atomie centralnym.
Krok 4: Umieść wszystkie pozostałe elektrony na atomie centralnym.

Uwaga: Krok 5: nie jest potrzebny, ponieważ wszystkie atomy mają oktet.
wyznaczmy strukturę CH2O.
- Krok 1: Określ całkowitą liczbę elektronów walencyjnych (powłoki zewnętrznej).
\large \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{H}_{2}}\text{CO}\\ \phantom{\rule{0.8 em}{0ex}}\text{H: 1 elektron walencyjny/atom}\times \text{2 atom}=2\\\text{C: 4 elektrony walencyjne/atom}\times \text{1 atom}=4\\ \underline{+\text{O: 6 elektrony walencyjne/atom}\times \text{1 Atomy}=6}\\ \\ \Phantom{\rule{15,95 em}{0EX}}=\text{12 elektronów walencyjnych}\end{array}
- Krok 2: narysuj strukturę szkieletu cząsteczki, układając Atomy wokół atomu centralnego. (Ogólnie rzecz biorąc, najmniejszy element elektroujemny powinien być umieszczony w środku.) Połącz każdy atom z atomem centralnym za pomocą jednego wiązania (jednej pary elektronowej).

- Krok 3: rozłóż pozostałe elektrony jako samotne pary na końcowych atomach (z wyjątkiem wodoru), uzupełniając oktet wokół każdego atomu.

- Krok 4: nie potrzebne, ponieważ wszystkie elektrony zostały umieszczone. Jednak węgiel nie ma oktetu,
- Krok 5: Przestawiaj elektrony zewnętrznych atomów, aby utworzyć wiele wiązań z atomem centralnym, aby uzyskać oktety, gdzie to możliwe.

przykład 1: pisanie struktur Lewisa
misja NASA Cassini-Huygens wykryła duży obłok toksycznego cyjanowodoru (HCN) na Tytanie, jednym z księżyców Saturna. Jakie są struktury Lewisa tych cząsteczek?
Sprawdź swoją wiedzę
dwutlenek węgla, CO2, jest produktem spalania paliw kopalnych. CO2 ma wpływ na globalne zmiany klimatu. Jaka jest struktura Lewisa CO2?
kluczowe pojęcia i podsumowanie
walencyjne struktury elektroniczne mogą być wizualizowane przez rysowanie symboli Lewisa (dla atomów i jonów monatomowych) i struktur Lewisa (dla cząsteczek i jonów poliatomowych). Pojedyncze pary, niesparowane elektrony i pojedyncze, podwójne lub potrójne wiązania są używane do wskazania, gdzie elektrony walencyjne znajdują się wokół każdego atomu w strukturze Lewisa. Większość struktur-zwłaszcza tych zawierających elementy drugiego rzędu-przestrzega zasady oktetu, w której każdy atom (z wyjątkiem H) jest otoczony przez osiem elektronów. Wyjątki od zasady oktetu występują dla cząsteczek nieparzystych elektronów (wolnych rodników), cząsteczek z niedoborem elektronów i cząsteczek hiperwartościowych.
ćwiczenia
- napisz symbole Lewisa dla każdego z następujących jonów:
- As3–
- I–
- Be2+
- O2–
- Ga3+
- Li+
- N3–
- wiele jonów monatomowych znajduje się w wodzie morskiej, w tym jony utworzone z poniższej listy pierwiastków. Napisz symbole Lewisa dla jonów monatomowych utworzonych z następujących elementów:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- napisz symbole Lewisa jonów w każdym z następujących związków jonowych i symbole Lewisa atomu, z którego są utworzone:
- MgS
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- w wymienionych poniżej strukturach Lewisa M I X reprezentują różne pierwiastki w trzecim okresie układu okresowego. Napisz wzór każdego związku za pomocą symboli chemicznych każdego pierwiastka:
- napisz strukturę Lewisa dla dwuatomowej cząsteczki P2, niestabilnej formy fosforu występującej w wysokotemperaturowych oparach fosforu.
- napisz:
- H2
- Hbr
- PCl3
- napisz:
- O2
- H2CO
- AsF3
- SiCl4
Słowniczek
wiązanie podwójne: wiązanie kowalencyjne, w którym dwie pary elektronów są dzielone między dwa atomy
wolne rodniki: cząsteczka zawierająca nieparzystą liczbę elektronów
cząsteczka hiperwartościowa: cząsteczka zawierająca co najmniej jeden główny element grupy, który ma więcej niż osiem elektronów w powłoce walencyjnej
struktura Lewisa: diagram przedstawiający samotne pary i pary wiązań elektronów w cząsteczce lub Jonie
>
symbol Lewisa:
pojedyncza para: dwa (para) elektronów walencyjnych, które nie są używane do tworzenia wiązania kowalencyjnego
reguła oktetu: wytyczne, które stwierdza główne Atomy grupy będą tworzyć struktury, w których osiem elektronów walencyjnych oddziałują z każdym jądrem, licząc wiązania elektronów Jako oddziałujących z obu atomów połączonych wiązaniem
pojedyncze wiązanie: wiązanie, w którym elektrony walencyjne oddziałują z każdym jądrem
pojedyncza para elektronów jest dzielona między dwa atomy
Wiązanie potrójne: Wiązanie, w którym trzy pary elektronów są dzielone między dwa atomy


 HCN: nie ma elektronów
HCN: nie ma elektronów




















