cykl glukozo-alanina lub cykl Cahilla, zaproponowany po raz pierwszy przez Mallette, Exton and Park oraz Felig et al. w latach 1969-1970, składa się z szeregu etapów, przez które tkanki pozawątrobowe, na przykład mięśnie szkieletowe, eksportują pirogronian i grupy aminowe jako alaninę do wątroby i otrzymują glukozę z wątroby za pośrednictwem krwiobiegu.
główne etapy cyklu glukoza-alanina są podsumowane poniżej.
- gdy w tkankach pozawątrobowych aminokwasy są wykorzystywane do energii, pirogronian, pochodzący z glikolizy, jest używany jako akceptor grupy aminowej, tworząc alaninę, nieistotny aminokwas.
- alanina dyfunduje do krwiobiegu i dociera do wątroby.
- w wątrobie grupa aminowa alaniny jest przenoszona do α-ketoglutaranu, tworząc odpowiednio pirogronian i glutaminian.
- grupa aminowa glutaminianu głównie wchodzi w cykl mocznikowy i częściowo działa jako donor azotu w wielu szlakach biosyntetycznych.
pirogronian wchodzi w glukoneogenezę i jest wykorzystywany do syntezy glukozy. - nowo utworzona glukoza dyfunduje do krwiobiegu i dociera do tkanek obwodowych, gdzie z powodu glikolizy przekształca się w pirogronian, który może przyjmować grupy aminowe z wolnych aminokwasów, zamykając w ten sposób cykl.
zatem cykl glukozo-alaninowy zapewnia związek między metabolizmem węglowodanów i aminokwasów, jak schematycznie opisano poniżej.
glukoza → pirogronian → alanina → pirogronian → glukoza
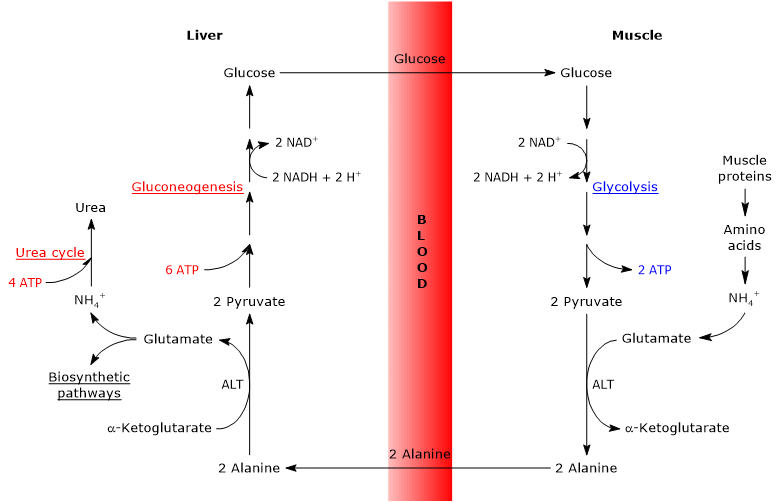
cykl glukozowo-alaninowy zachodzi nie tylko między mięśniem szkieletowym, pierwszą tkanką, w której został zaobserwowany, a wątrobą, ale obejmuje inne komórki i tkanki pozawątrobowe, w tym komórki układu odpornościowego, takie jak narządy limfatyczne.
spis treści
- etapy cyklu glukozo-alaninowego
- cykl Cahilla w mięśniach szkieletowych
- cykl Cahilla w wątrobie
- transaminazy
- funkcje cyklu glukozowo-alaninowego
- koszt energii cyklu glukozowo-alaninowego
- podobieństwa i różnice między cyklem Cahilla a cyklem Coriego
etapy cyklu glukozowo-alaninowego
analiza etapów cyklu glukozowo-alaninowego jest dokonywana z uwzględnieniem cyklu między mięśniami szkieletowymi a wątrobą.
zarówno wewnątrzkomórkowe, jak i zewnątrzkomórkowe białka są stale hydrolizowane do składowych aminokwasów i resyntetyzowane, a tempo, w jakim zachodzą te procesy, jest dokładnie zrównoważone, zapobiegając w ten sposób utracie masy beztłuszczowej.
jednak w Warunkach katabolicznych, takich jak intensywne i długotrwałe ćwiczenia lub post, szybkość rozpadu białek mięśniowych przekracza syntezę. Prowadzi to do wyzwolenia aminokwasów, z których niektóre są wykorzystywane do energii, a inne do glukoneogenezy. A utlenianie szkieletów węglowych aminokwasów, w szczególności aminokwasów rozgałęzionych BCAA (leucyna, izoleucyna i walina), może być istotnym źródłem energii dla mięśni. Na przykład, po około 90 minutach intensywnego wysiłku, utlenianie aminokwasów w mięśniach dostarcza 10-15% energii potrzebnej do skurczu.
wykorzystanie szkieletów węglowych aminokwasów do energii obejmuje usunięcie grupy aminowej, a następnie wydalanie azotu aminowego w nietoksycznej formie.
usunięcie grupy α-aminowej następuje przez transaminację, którą można podsumować w następujący sposób:
kwas α-Keto + aminokwas New nowy aminokwas + Nowy kwas α-keto
takie reakcje, katalizowane przez enzymy zwane aminotransferazami lub transaminazami (EC 2.6.1) są swobodnie odwracalne.
aminokwasy rozgałęzione, na przykład, przenoszą grupę aminową do α-ketoglutaranu lub kwasu 2-oksoglutarowego, tworząc glutaminian i kwas α-keto pochodzący z pierwotnego aminokwasu, w reakcji katalizowanej przez aminotransferazę rozgałęzionych łańcuchów lub BCAT (EC 2.6.1.42).
cykl Cahilla w mięśniach szkieletowych
w mięśniach szkieletowych nowo powstały glutaminian może reagować z amoniakiem tworząc glutaminę, dla wielu tkanek i narządów, takich jak mózg, główny nośnik międzyorganowego transportu azotu. Reakcja jest katalizowana przez cytozolowy enzym syntetazę glutaminy (EC 6.3.1.2) i zużywa ATP.
glutaminian + NH4 + + ATP → glutamina + ADP + Pi
w tym przypadku glutaminian opuszcza cykl Cahilla.
alternatywnie, w przeciwieństwie do tego, co dzieje się w większości innych tkanek, nowo utworzony glutaminian może przenosić grupę aminową do pirogronianu, pochodzącego z glikolizy, tworząc alaninę i α-ketoglutaran. Transaminacja ta jest katalizowana przez aminotransferazę alaninową lub alat (EC 2.6.1.2), enzym występujący w większości tkanek zwierzęcych i roślinnych.
glutaminian + pirogronian ⇄ alanina + α-ketoglutaran
alanina produkowana i pochodząca bezpośrednio z rozkładu białek, a białka mięśniowe są bogate w alaninę, mogą opuścić komórkę i być przenoszone przez krwioobieg do wątroby; w ten sposób grupa aminowa dociera do wątroby. Szybkość, z jaką alanina utworzona przez transaminację pirogronianu jest przenoszona do krążenia, jest proporcjonalna do wewnątrzkomórkowej produkcji pirogronianu.
Uwaga: alanina i glutamina są głównymi źródłami azotu i węgla w metabolizmie aminokwasów międzyrządowych.
cykl Cahilla w wątrobie
raz w wątrobie, wątrobowa aminotransferaza alaninowa katalizuje transaminację, w której alanina, główny aminokwas glukoneogenny, działa jako dawca grupy aminowej, a α-ketoglutaran jako akceptor kwasu α-keto. Produktami reakcji są pirogronian, czyli szkielet węglowy alaniny i glutaminian.
alanina + α-ketoglutaran ⇄ glutaminian + pirogronian
glutaminian, w reakcji katalizowanej przez dehydrogenazę glutaminianową (EC 1.4.1.2), enzym obecny w matrycy mitochondrialnej, tworzy jon amonowy, który wchodzi w cykl mocznikowy, oraz α-ketoglutaran, który może wejść w cykl Krebsa. Reakcja ta jest reakcją anaplerotyczną, która łączy metabolizm aminokwasów z cyklem Krebsa.
glutaminian + H2O + NAD+ ⇄ α-ketoglutaran + NH4+ + NADH + H+
jednak glutaminian może również reagować ze szczawiooctanem, tworząc asparaginian i α-ketoglutaran, w reakcji katalizowanej przez aminotransferazę asparaginianową (EC 2.6.1.1). Asparaginian bierze udział w tworzeniu mocznika, a także w syntezie puryn i pirymidyn.
glutaminian + Szczawiooctan ⇄ asparaginian + α-ketoglutaran
również produkowany pirogronian może mieć różne losy metaboliczne: może być utleniony do produkcji ATP, a następnie opuścić cykl glukozo-alaniny lub wejść w Szlak glukoneogenezy, a tym samym kontynuować cykl.
wytworzona glukoza jest uwalniana z wątroby do krwiobiegu i dostarczana do różnych tkanek, które tego wymagają, jako mięsień szkieletowy, w którym jest wykorzystywana do syntezy pirogronianów. Z kolei nowo powstały pirogronian może reagować z glutaminianem, zamykając w ten sposób cykl.
transaminazy
jak wcześniej wspomniano, usunięcie grupy aminowej z aminokwasów następuje poprzez transaminację (patrz ogólna reakcja powyżej). Reakcje te są katalizowane przez enzymy zwane aminotransferaz lub transaminaz.
są to enzymy cytozolowe, obecne we wszystkich komórkach i szczególnie obfite w wątrobie, nerkach, jelitach i mięśniach; wymagają fosforanu pirydoksalu lub PLP, aktywnej postaci witaminy B6 lub pirydoksyny, jako koenzymu, który jest ściśle związany z miejscem aktywnym.
w reakcjach transaminacji grupa aminowa wolnych aminokwasów, z wyjątkiem treoniny i lizyny, jest kierowana w kierunku niewielkiej liczby α-keto kwasów, zwłaszcza pirogronianu, szczawiooctanu i α-ketoglutaranu.
komórki zawierają różne rodzaje aminotransferaz: wiele z nich jest specyficznych dla α-ketoglutaranu jako akceptora kwasu α-ketonowego, ale różnią się swoistością dla aminokwasu, od którego są nazwane. Przykładami są wyżej wymieniona aminotransferaza alaninowa, zwana również transaminazą alaninową i transferazą glutaminowo-pirogronową lub GPT, oraz aminotransferaza asparaginianowa lub AspAT, zwana również transaminazą glutaminowo-szczawiooctową lub GOT.
należy podkreślić, że nie ma deaminacji netto w tych reakcjach, nie ma utraty grup aminowych, ponieważ akceptor kwasu α-keto jest aminowany, a aminokwas deaminowany.
funkcje cyklu glukozowo-alaninowego
ten cykl ma różne funkcje.
- transportuje azot w nietoksycznej postaci z tkanek obwodowych do wątroby.
- transportuje pirogronian, substrat glukoneogenny, do wątroby.
- usuwa pirogronian z tkanek obwodowych. Prowadzi to do większej produkcji ATP z glukozy w tych tkankach. W rzeczywistości NADH wytwarzany podczas glikolizy może przedostawać się do mitochondriów i być utleniany poprzez fosforylację oksydacyjną.
- pozwala utrzymać stosunkowo wysokie stężenie alaniny w hepatocytach, wystarczające do zahamowania degradacji białek.
- może odgrywać rolę w obronie gospodarza przed chorobami zakaźnymi.
wreszcie, ważne jest, aby podkreślić, że nie ma syntezy netto glukozy w cyklu glukoza-alanina.
koszt energii cyklu glukozowo-alaninowego
podobnie jak cykl Cori, również cykl glukozowo-alaninowy ma koszt energii, równy 3-5 ATP.
część cyklu, która zachodzi w tkankach obwodowych, polega na wytwarzaniu 5-7 ATP na cząsteczkę glukozy:
- 2 ATP są wytwarzane przez glikolizę;
- 3-5 ATP pochodzi z NADH/FADH2 (patrz poniżej).
zamiast w wątrobie, glukoneogeneza i cykl mocznikowy kosztują 10 ATP:
- 6 ATP są spożywane w trakcie glukoneogenezy na cząsteczkę zsyntetyzowanego glukozy;
- 4 ATP są spożywane w cyklu mocznikowym na cząsteczkę zsyntetyzowanego mocznika.
cykl glukozowo-alaninowy, podobnie jak cykl Cori, przenosi część obciążenia metabolicznego z tkanek pozawątrobowych do wątroby. Koszt energii płacony przez wątrobę jest jednak uzasadniony zaletami, jakie cykl przynosi całemu organizmowi, ponieważ pozwala w szczególnych warunkach na efektywny rozkład białek w tkankach pozawątrobowych (zwłaszcza mięśni szkieletowych), co z kolei pozwala na uzyskanie substratów glukoneogennych oraz wykorzystanie aminokwasów do energii w tkankach pozawątrobowych.
podobieństwa i różnice między cyklem Cahilla i cyklem Coriego
istnieją pewne analogie między tymi dwoma cyklami, które są wymienione poniżej.
- cykl Cahilla częściowo pokrywa się z cyklem Kori, gdy pirogronian przekształca się w glukozę, a monosacharyd transportuje się do tkanek pozawątrobowych, w których ponownie przekształca się w pirogronian drogą glikolityczną.
- wejście do szlaku glukoneogenezy jest podobne dla dwóch cykli: zarówno alanina, jak i mleczan są przekształcane w pirogronian.
- podobnie jak cykl Cori, cykl glukozowo-alaninowy występuje między różnymi typami komórek, w przeciwieństwie do szlaków metabolicznych, takich jak glikoliza, cykl Krebsa lub glukoneogeneza, które występują w poszczególnych komórkach
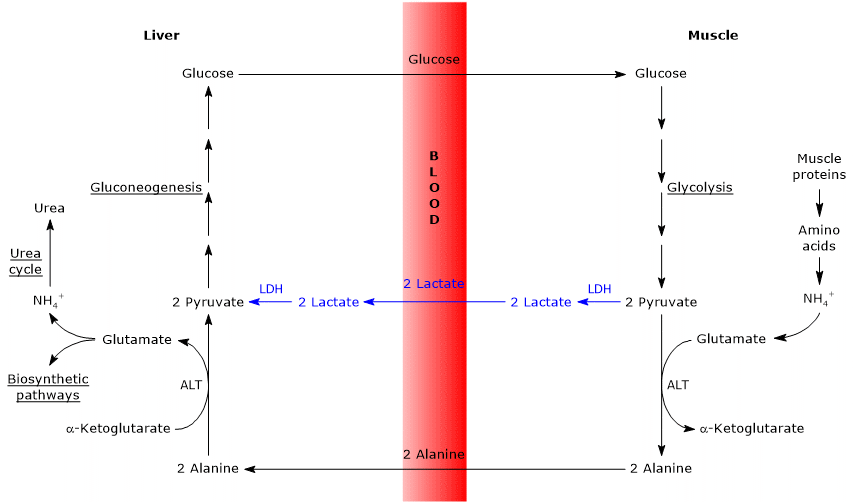
poniżej kilka różnic między tymi dwoma cyklami.
- główna różnica dotyczy trzech półproduktów węglowych, które z tkanek obwodowych docierają do wątroby: mleczan w cyklu Cori, a alanina w cyklu glukoza-alanina.
- kolejna różnica dotyczy losów NADH wytwarzanego przez glikolizę w tkankach obwodowych.
w cyklu Cori koenzym działa jako środek redukujący w celu zmniejszenia pirogronianu do mleczanu, w reakcji katalizowanej przez dehydrogenazę mleczanową (EC 1.1.1.27).
w cyklu glukozowo-alaninowym redukcja ta nie zachodzi, a elektrony NADH mogą być transportowane do mitochondriów za pośrednictwem transferów jabłczan-asparaginian i 3-fosforan glicerolu, generując NADH, pierwszy wahadłowiec i fadh2, drugi wahadłowiec. A wydajność ATP z NADH i FADH2 wynosi odpowiednio 2,5 i 1,5. - wreszcie z poprzedniego punktu wynika, że w przeciwieństwie do cyklu Coriego, cykl Cahilla wymaga obecności tlenu i mitochondriów w tkankach obwodowych.
Berg J. M., Tymoczko J. L., and Stryer L. V edycja. W. H. Freeman and Company, 2002
Felig P., Pozefsk T., Marlis E., Cahill G. F. alanina: kluczowa rola w glukoneogenezie. Nauka 1970;167(3920):1003-4. 10.1126 / nauka167, 3920, 1003
Gropper S. S., Smith J. L., Groff J. L. Zaawansowane odżywianie i metabolizm człowieka. Cengage Learning, 2009
lecker S. H., Goldberg A. L. and Mitch W. E. protein degradation by the ubiquitin–proteasome pathway in normal and disease states. J Am Soc 2006;17(7):1807-19. doi: 10.1681 / ASN.2006010083
Mallette L. E., Exton J. H. i Park C. R. Kontrola glukoneogenezy z aminokwasów w perfusowanej wątrobie szczura. J Biol Chem 1969;244(20): 5713-23.
Nelson D. L., Cox M. M. Lehninger. Zasady biochemii. VI edycja. W. H. Freeman i Spółka, 2012
Raju S. M., Madala B. Ilustrowana biochemia medyczna. Jaypee Brothers Publishers, 2005
Wu G. Amino acids: biochemistry and nutrition. CRC Press, 2013