to nie jest oczywiste. Elektrony walencyjne są te, które są ważne w wiązaniu chemicznym. W przypadku metali przejściowych słowo „ważne” będzie się różnić w zależności od kontekstu.
łatwiej i praktyczniej jest opisać, które orbitale są orbitalami walencyjnymi, jeśli chodzi o metale przejściowe (chociaż jest to trudne w przypadku lantanowców i aktynowców).
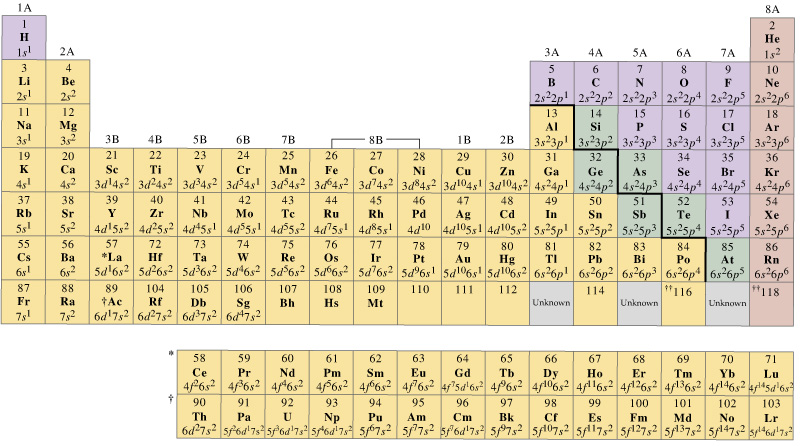
ogólnie rzecz biorąc, metale przejściowe pierwszego rzędu mają zestaw orbitali walencyjnych, które zawierają ich # 4s# i # 3d # 's, ale liczba elektronów walencyjnych będzie się różnić.
na przykład…

- Scandium ma sens mieć do trzech elektronów walencyjnych, ponieważ istnieje stan utleniania#”Sc „^(+3) #(np.#”ScCl” _3#), ale nie # ” Sc ” ^(+4) # lub wyższy. Stan utleniania# +3 # wymagałby przeniesienia trzech elektronów walencyjnych, gdyby tworzył czysty kation.
- chrom może mieć do sześciu elektronów walencyjnych, które obejmowałyby jego # 3D # elektrony, ponieważ może osiągnąć stan utleniania # + 6# (tj. w#”Cr”_2″O”_7^(2 -) #lub w # „Cro”_4^(2-)#).
- miedź ma tendencję do stanu utleniania # +1# (np. # „CuCl”#), więc ma sens, że wykorzystuje swój jeden # 4S # elektron najczęściej jako elektron walencyjny (s). Ale znany jest również stan utleniania #+2# (np. # „CuCl” _2#), a więc jest w stanie pobierać od swoich #BB(3d)# elektrony, jak również dla swoich elektronów walencyjnych.
z drugiej strony, możemy łatwo powiedzieć, że orbitale walencyjne metali przejściowych pierwszego rzędu to orbitale #4s# i #3d#.
więc ogólnie rzecz biorąc, powiedziałbym, że liczba elektronów walencyjnych dla metali przejściowych (i lantanowców i aktynowców) różni się w nieprzewidywalny sposób, ale orbitale walencyjne mogą być czasami przewidywane z wystarczającą intuicją chemiczną.
zastrzeżenie: generalnie jednak lantanowcom i aktynowcom trudno jest przewidzieć, które orbitale są walencyjne.
na przykład, aktynidy mają orbitale #5f# i #6d# bardzo blisko energii do ich orbitali #7s#, więc możemy zgadywać i włączać #7s#, #6d# i #5F# w przestrzeni walencyjnej (nawet jeśli orbitale #6D# są puste) podczas wykonywania obliczeń energii atomowej.