wprowadzenie
kanały potasowe bramkowane napięciem tworzą dużą i zróżnicowaną rodzinę, która jest ewolucyjnie konserwowana. Istnieje 40 ludzkich genów kanału potasowego należących do 12 podrodzin. Te kanały kV wykazują szerokie dystrybucje w układzie nerwowym i innych tkankach. W przypadku komórek pobudliwych, takich jak neurony, kardiomiocyty i mięśnie, kanały KV regulują kształt fali i wzór wypalania potencjałów działania. Kanały KV mogą również regulować objętość komórek, proliferację i migrację szerokiego zakresu typów komórek.
napięciowe kanały potasowe (KV) należą do jednej z największych i wysoce ewolucyjnie zachowanych rodzin kanałów jonowych . Każdy kanał KV zawiera cztery podobne lub identyczne podjednostki α tworzące pory, a także może zawierać pomocnicze podjednostki β, które mogą wpływać na funkcję kanału i/lub lokalizację . Każda podjednostka tworząca pory kanałów kV zawiera sześć segmentów transmembrany (S1-S6), przy czym pierwsze cztery segmenty transmembrany (S1-S4) stanowią czujnik napięcia, a dwa ostatnie segmenty transmembrany flankują pętlę porów (S5-P-S6) jako domenę porów. Oprócz lokalizacji chromosomów każdego genu kanału KV u ludzi, myszy i szczurów, fizjologiczne i farmakologiczne właściwości kanału, jego rozkład tkankowy i patofizjologia zostały dostarczone przez bazę danych kanałów jonowych przez Podkomitet ds. kanałów potasowych bramkowanych napięciem Komitetu Nomenklatury Międzynarodowej Unii farmakologii (NC-IUPHAR). W artykule przedstawiono wprowadzenie do różnorodności i funkcji napięciowych kanałów potasowych.
ewolucyjna Ochrona kanałów potasowych
selektywność K+, która powstała u prokariotów, jest zachowana w dużej liczbie kanałów potasowych z niezwykłą różnorodnością . Jak pokazano na fig. 1, ewolucyjne drzewo nadrodziny kanału kationowego bramkowanego napięciem może być zaproponowane na podstawie porównania genów kanałów w ludzkim genomie z genomami innych metazoanów, w tym myszy, kurczaka, rozdymki, tunikatu, muszki owocowej, komara, nicienia i ukwiału morskiego . To ewolucyjne drzewo wyobraża sobie pojedyncze pochodzenie K+-selektywności dla wewnętrznie prostujących kanałów potasowych (Kir), kanałów potasowych bramkowanych napięciem (KV) i kanałów potasowych dwuporowych (K2P). Ważne jest jednak, aby zauważyć, że wyraźna selektywność K+jest prawdopodobnie związana z ewolucyjnie zachowywanym kanałem K + organelle, który znajduje się w endosomach i lizosomach .
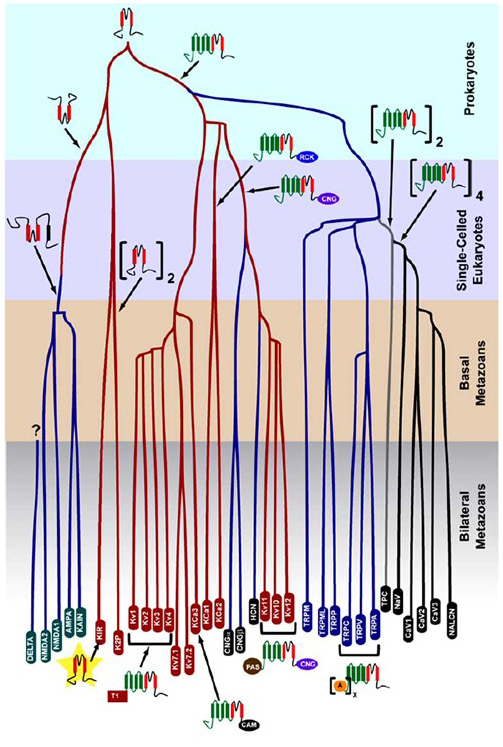
Rysunek 1. Ewolucyjne drzewo genezy nadrodziny kanału kationowego bramkowanego napięciem. Opierając się na analizach genomu kanałów jonowych od cnidarian i obustronnych metazoanów , to ewolucyjne drzewo przedstawia wspólne pochodzenie selektywności K+kanałów potasowych (z nazwami rodzin w czerwonych owalach), które są związane z kanałami tetramerycznego cyklicznego kationu bramkowanego nukleotydem (CNG), kanałów kationu bramkowanego hiperpolaryzacją (HCN) i kanałów TRP, dimerycznymi kanałami TPC i monomerycznymi kanałami na+, Ca2+ i NALCN. Długość gałęzi nie odzwierciedla czasu. Nazwy rodzin genów na dole oznaczają poszczególne gałęzie. Jonotropowe receptory glutaminianowe są uwzględniane w oparciu o hipotezę, że powstały w wyniku inwersji domeny tworzącej pory kanału potasowego z dwoma segmentami transmembrany (czerwonym). Domena czujnika napięcia ma cztery segmenty transmembrany (zielone). A: powtarza ankryin; CAM: domena wiążąca kalmodulinę; CNG: domena wiążąca cykliczne nukleotydy; PAS: domena Per-ARNT-sim; RCK: regulator przewodności domeny K+; T1: domena tetrameryzacji.
różnorodność kanałów potasowych bramkowanych napięciem
ludzki genom zawiera ~80 genów kanałów potasowych, z których 40 genów koduje podjednostki tworzące kanały potasowe bramkowane napięciem, które dzielą się na 12 podrodzin (rys. 2). Fizjologicznie podzielone na kanały potasowe typu A, które wykazują szybką inaktywację i opóźnione prostownicze kanały potasowe bez szybkiej inaktywacji, te kanały KV są zróżnicowane molekularnie i funkcjonalnie. Szybka inaktywacja, która może mieć wpływ na czas trwania potencjału czynnościowego podczas powtarzalnego wypalania, jest widoczna w kanałach KV1 zawierających KV1.4 lub kanały KVß1, KV3 i KV4 . Opóźniony prostowniczy prąd potasowy pierwotnie charakteryzowany przez Hodgkina i Huxleya ze względu na jego rolę w potencjale czynnościowym prawdopodobnie odpowiada kanałom KV1 squid, które mogą polegać na edycji RNA w celu osiągnięcia elastycznej różnorodności funkcjonalnej, ponieważ wiele małych aksonów neuronów płata włókien olbrzymich łączy się, tworząc Akson olbrzymiego kałamarza z większym współczynnikiem przewodzenia potencjału czynnościowego .
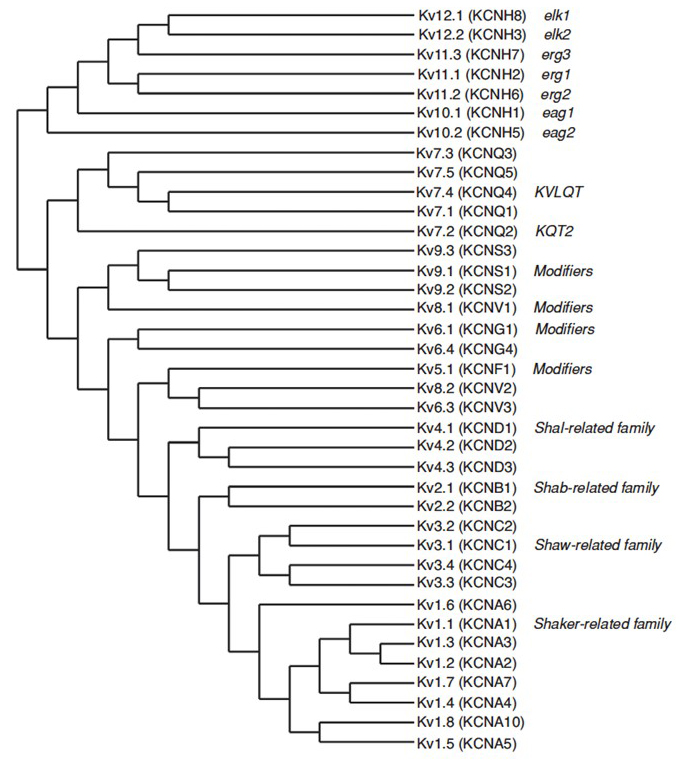
Rysunek 2. Drzewo filogenetyczne dla rodzin KV1-12. To drzewo filogenetyczne jest generowane na podstawie analiz hydrofobowej domeny zawierającej sześć segmentów transmembrany (S1-S6). Zarówno nazwy IUPHAR, jak i hgnc (w nawiasie) są pokazane, wraz z innymi powszechnie używanymi nazwami dla tych napięciowych kanałów potasowych.
niezwykła różnorodność kanałów KV może być osiągnięta dzięki mieszaniu i dopasowaniu podjednostek kanałów kV. W obrębie każdej z rodzin KV1, KV2, KV3, KV4 i KV7 mogą tworzyć się kanały homomeryczne i heteromeryczne o różnych właściwościach funkcjonalnych . Członkowie rodziny KV2 mogą również łączyć się z członkami rodziny kv5, KV6, KV8 lub kv9 o bardziej ograniczonych wzorcach ekspresji w układzie nerwowym i mięśniach gładkich, jak pokazano schematycznie na Fig. 3.

Rysunek 3. Różnorodność kanałów KV poprzez mieszanie i dopasowywanie podjednostek kanałów tworzących pory. A) tetrameryczne kanały KV o różnych właściwościach i dystrybucji obejmują homomeryczne kanały KV1, KV2, KV3, KV4 i KV7, kanały heteromeryczne utworzone przez różnych członków w ramach każdej z tych rodzin kanałów kV oraz kanały heteromeryczne utworzone przez połączenie członków rodziny KV2 z członkami rodziny KV5, KV6, KV8 lub kv9 . Rodziny KV5, KV6, KV8 i kv9 powodują powstawanie kanałów homomerycznych , które są ciche elektrycznie prawdopodobnie ze względu na ich zatrzymanie w retikulum endoplazmatycznym, stąd są określane jako KVS. B) zespół członków rodziny KV2 i KVS obejmuje ich cytoplazmatyczne domeny N-I C-końcowe. (C, D) połączenie członków rodziny KV2 i KVS powoduje powstanie kanałów heteromerycznych o różnej zależności napięciowej (C) i mechanizmach bramkowania (D) w porównaniu z kanałami homomerycznymi utworzonymi przez członków rodziny KV2 .
różnice funkcjonalne w zależności napięcia i kinetyce kanałów KV leżą u podstaw ich różnicowego wkładu w modulację potencjału czynnościowego (rys. 4). Podczas gdy kanały KV1, KV4 i KV7 wymagają niskiego poziomu depolaryzacji membranowej do ich aktywacji, kanały KV2 i KV3 są aktywowane przez większą depolaryzację. Pierwsze, aktywowane niskonapięciowe kanały KV mogą wpływać na próg generowania potencjału czynnościowego i liczbę potencjałów czynnościowych generowanych podczas depolaryzacji lub pobudzających potencjałów synaptycznych. W przeciwieństwie do tego, kanały kV aktywowane wysokim napięciem mogą modulować czas trwania potencjału czynnościowego i wzór wypalania . Kinetyka kanałów KV wpływa również na sposób, w jaki przyczyniają się one do generowania potencjału czynnościowego. Podczas gdy kanały KV1 aktywowane niskim napięciem z szybką aktywacją mogą wpływać na próg potencjału czynnościowego i przebieg, kanały KV3 aktywowane wysokim napięciem i kanały KV2 mogą być aktywowane sekwencyjnie podczas potencjału czynnościowego ze względu na różnicę w ich kinetyce aktywacji, a kanały KV2 mogą mieć bardziej długotrwałe efekty ze względu na ich powolną kinetykę inaktywacji. Co więcej, kanały KV4 z szybką inaktywacją mogą przyczynić się do różnicy w przebiegu potencjału czynnościowego podczas powtarzalnego wypalania, z powodu tłumienia aktywności kanału KV4 przez depolaryzację .
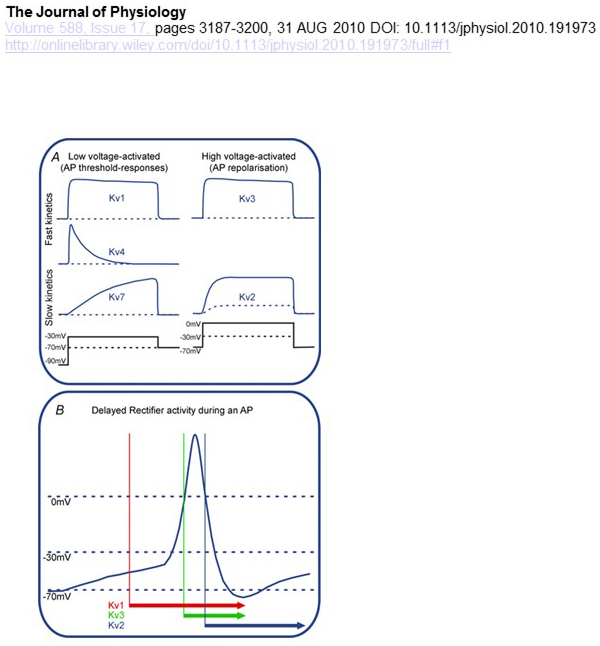
Rysunek 4. Różnice funkcjonalne kanałów KV i ich wkład w potencjał działania. (A) różne kanały KV mają różną zależność napięcia dla aktywacji i różną kinetykę . B) aktywowane niskonapięciowe kanały KV1 o szybkiej kinetyce otwarte, gdy ogniwo jest depolaryzowane w kierunku progu generowania potencjału czynnościowego. Podczas gdy oba kanały KV2 i KV3 są aktywowane wysokim napięciem, kanały KV3 otwierają się wcześniej niż kanały KV2 podczas potencjału czynnościowego. Kanały KV2 mogą również potrwać dłużej, aby zamknąć po potencjale działania .
potencjalne zastosowania terapeutyczne modulatorów kanałów potasowych
zdolność modulatorów kanałów potasowych do zmiany wzorców wypalania potencjału czynnościowego wzbudziła pytanie, czy mogą one mieć wartość terapeutyczną . Jak wskazano na Fig. 5, różne zaburzenia neurologiczne i psychologiczne mogą obejmować zmiany w wzorcach wypalania potencjału czynnościowego, które mogą być modulowane przez aktywatory kanału KV i blokery . Kanały potasowe bramkowane napięciem mogą również odgrywać rolę w proliferacji i migracji komórek; Modulatory kanału KV zostały zatem rozważone w przypadku potencjalnych metod leczenia wzrostu raka i przerzutów . Na Rys. 6, struktura kanału KV1.2 jest stosowana schematycznie w celu zilustrowania, że modulatory kanału kV mogą hamować aktywność kanału albo przez zamknięcie szlaku przenikania kanału, jak w przypadku toksyn blokujących pory zewnętrzne i blokujących pory wewnętrzne, albo poprzez ich interakcję z czujnikiem napięcia w celu ustabilizowania stanu zamkniętego kanału, jak w przypadku toksyn modyfikujących bramki. Alternatywnie, niektóre małe cząsteczki działają przez wiązanie z maszyną bramkowania jako modyfikatory bramkowania lub przez interakcję z interfejsem między podjednostkami α i β, aby zmienić aktywność kanału.
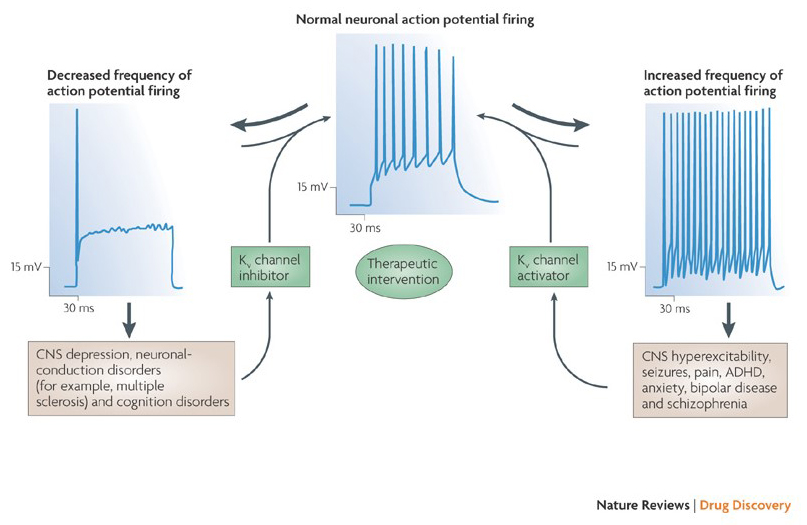
Rysunek 5. Potencjalne zastosowania modulatorów kanałów KV. Ponieważ nieprawidłowe wzorce wypalania potencjału czynnościowego były związane z chorobami takimi jak epilepsja i stwardnienie rozsiane, aktywatory i inhibitory kanału KV zostały rozważone w przypadku potencjalnych terapii terapeutycznych chorób, które wymagają zmiany pobudliwości neuronalnej .
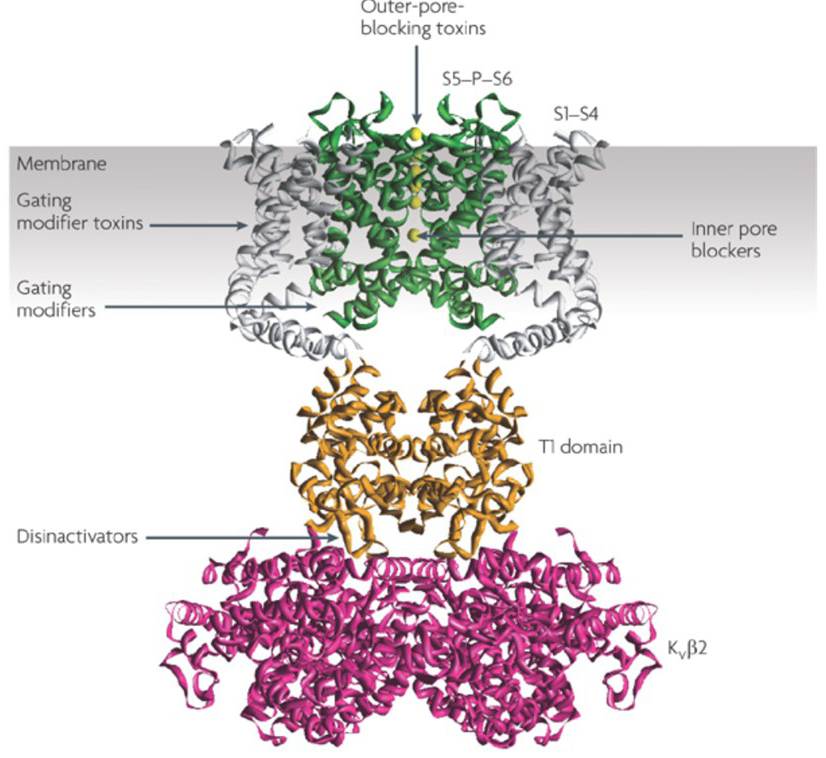
Rysunek 6. Przykłady trybów działania modulatorów kanałów KV. Istnieje kilka różnych sposobów na toksyny peptydowe i małe cząsteczki do modulowania aktywności kanału KV. Struktura KV1 .2 jest pokazana z domenami porów (S5-P-S6) na Zielono, domenami czujników napięcia (S1-S4) na szaro, domenami tetrameryzacji T1 na pomarańczowo i podjednostkami pomocniczymi KVß2 na Czerwono. Toksyny blokujące pory zewnętrzne od skorpionów, ukwiałów morskich, węży i ślimaków stożkowych mogą wiązać się z zewnętrznym przedsionkiem i blokować przenikanie jonów. Modyfikatory bramkowania, takie jak hanatoksyna, mogą oddziaływać z czujnikiem napięcia w celu zwiększenia stabilności stanu zamkniętego, powodując przesunięcie krzywej zależności napięcia w kierunku aktywacji kanału. Istnieją również modulatory kanału małocząsteczkowego, które wiążą się z porami wewnętrznymi (blokerami porów wewnętrznych), zawiasami bramkowymi (modyfikatorami bramkowania) lub interfejsem między podjednostkami α i β (dezynfekatorami) .
napięciowa struktura kanału potasowego
niezwykła selektywność kanałów potasowych, która pozwala jonom K+ przejść przez pory kanału z większą łatwością o rząd wielkości niż mniejsze jony Na+ i z niemal ograniczoną szybkością dyfuzji , jest uwzględniana przez zdolność karbonylów szkieletowych filtra selektywności do koordynowania jonów K+, które są w dużej mierze pozbawione powłok hydratacyjnych, tak że więcej niż jeden jon k+ przejdzie przez ten najwęższy segment filtra.pore w tandemie (rys. 7) – długi por dla pojedynczego pliku k + przenikania jonów jako z góry .
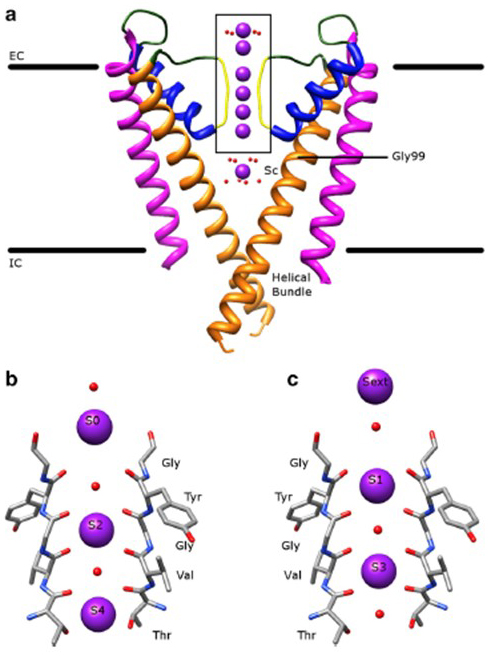
Rysunek 7. Domena porów kanałów potasowych. (a) struktura KcsA w stanie przewodzącym (PDB: 1K4C), z zewnętrznymi helisami w kolorze karmazynowym, wewnętrznymi helisami w kolorze pomarańczowym, helisami porów w Kolorze Niebieskim i filtrem selektywności w Kolorze Żółtym. Jony K+ są fioletowe, podczas gdy otaczające je cząsteczki wody są czerwone. EC: zewnątrzkomórkowy; IC: wewnątrzkomórkowy. (b, c) filtr selektywności w obszarze pudełkowym struktury KCSA jest pokazany z jonami K+ zajmującymi pozycje S2 i S4 (b) lub pozycje S1 i S3 (c), aby zilustrować przenikanie jonów K+ w jednym pliku .
zależność napięciowa aktywacji kanału KV wynika z ich domen czujników napięcia . Jak pokazano na Fig. 8, kanały KV i powiązane kanały, takie jak kanały sodowe bramkowane napięciem i kanały TRPV1 w tej samej nadrodzinie, mają podobne rozmieszczenie domen porów i domen czujników napięcia. Domena czujnika napięcia jednej podjednostki oddziałuje z domeną porów sąsiedniej podjednostki w konfiguracji wymiany domeny, a w czujniku napięcia dodatnio naładowane reszty argininy Na S4 mogą oddziaływać z ujemnie naładowanymi resztami kwaśnymi w sąsiednich helisach (Fig. 9).
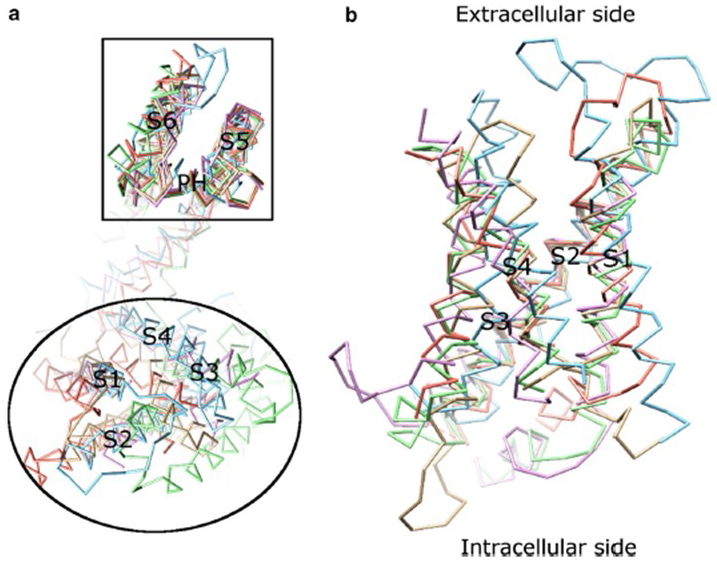
Rysunek 8. Domena czujnika napięcia kanałów potasowych bramkowanych napięciem. (a) wyrównanie domeny porów (S5-P-S6) różnych kanałów jonowych ujawnia, że ich domeny czujników napięcia (S1-S4) mogą przyjmować różne orientacje (oglądane od strony pozakomórkowej). B) nałożenie domeny czujnika napięcia KV1.2 (PDB: 3LUT, light magenta) z domenami czujnika napięcia MlotiK1 (PDB: 3BEH, light brown) , NaVAb (PDB: 3RVY, light green) , NaVRh (PDB: 4DXW, light orange) i TRPV1 (PDB: 3J5P, light blue) (oglądane z membrany) .
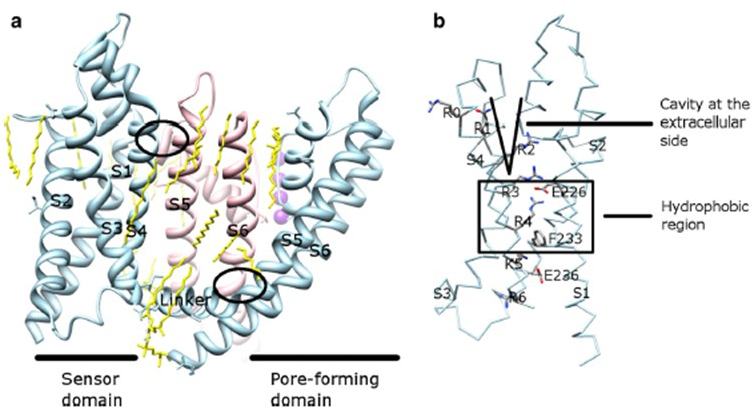
Rysunek 9. Styki między domeną porów a domeną czujników napięcia kanałów KV. a) Chimera KV1.2-KV2.1 (PDB: 2R9R) z domeną czujnika napięcia jednej podjednostki (jasnoniebieska) kontaktująca się z domeną porów sąsiedniej podjednostki (różowa). Kontakty po stronie wewnątrzkomórkowej obejmują interakcję łącznika S4-S5 z S6, a kontakty po stronie zewnątrzkomórkowej obejmują interakcję między S1 a spiralą porów . Lipidy (żółte) otaczające kanał i pomiędzy domeną porów a domeną czujnika napięcia są wykrywalne w strukturze krystalicznej. b) zasadowe pozostałości S4 i kwaśne pozostałości w ich pobliżu w obszarze czujnika napięcia .
kanały kanałowe związane z napięciowymi kanałami potasowymi
napięciowymi kanałami potasowymi są szeroko wyrażone w różnych tkankach. W neuronach są one skierowane do różnych przedziałów subkomórkowych (Fig. 10), a kanały o różnych składach podjednostek mogą być obecne w różnych subpopulacjach neuronów . Mutacje genów kanału KV mogą powodować choroby neurologiczne, takie jak epizodyczna ataksja i epilepsja, choroby serca i głuchota . Ewolucyjna ochrona funkcji kanału KV jest widoczna, na przykład, z podobnych zaburzeń ruchowych spowodowanych mutacją ortologów KV1 u ludzi, myszy i muszek owocowych .
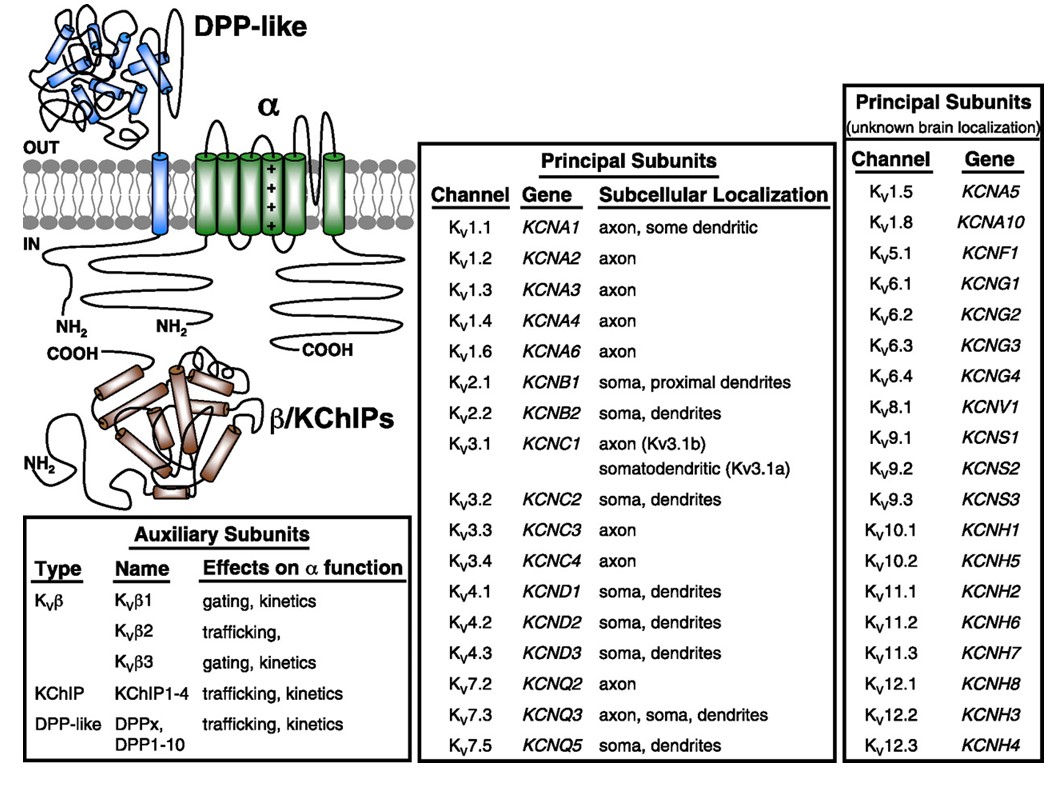
Rysunek 10. Subkomórkowy rozkład kanałów potasowych bramkowanych napięciem. Schemat w lewym górnym rogu przedstawia kanał KV4 z dwoma różnymi podjednostkami pomocniczymi. Subkomórkowa lokalizacja różnych kanałów KV w ośrodkowych neuronach ssaków jest wskazana w środkowym polu .
Referencje i uwagi
1.Hille, B., Ionic Channels of Excitable Membranes, 3rd, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K ( + ) channels: function-structural overview. Compr Physiol, 2012. 2(3): s. 2087-149.
3.Vacher, H., D. P. Mohapatra, and J. S. Trimmer, Localization and targeting of voltage-dependent jon channels in ssak central neurons. Physiol Rev, 2008. 88(4): s. 1407-47.
4.Jegla, T. J., et al., Ewolucja zestawu kanałów jonowych człowieka. Comb Chem High Throughput Screen, 2009. 12(1): s. 2-23.
5.Cang, C., et al., TMEM175 jest kanałem Organelle K (+) regulującym funkcję Lizosomalną. Cela, 2015. 162(5): p. 1101-12.
6.Hodgkin, A. L. i A. F. Huxley, prądy przenoszone przez jony sodu i potasu przez błonę aksonu olbrzymiego Loligo. J Physiol, 1952. 116(4): s. 449-72.
7.Rosenthal, J. J., T. I. Liu, and W. F. Gilly, rodzina opóźnionych prostowników KV1 cDNA wykazujących ekspresję specyficzną dla typu komórki w kompleksie zwoju gwiaździstego/olbrzymiego płata włóknistego. J Neurosci, 1997. 17(13): p. 5070-9.
8.Young, J. Z., Fused neurons and synaptic contacts in the giant nerve fibres of cephalopods. Phil Trans R Soc Lond B, 1939. 229: S. 465-503.
9.Rosenthal, J. J. and F. Bezanilla, Extensive editing of mRNA for the squid delayed rectifier K + channel regulates subunit tetramerization. Neuron, 2002. 34(5): s. 743-57.
10.Jan, L. Y. and Y. N. Jan, Voltage-gated potas channels and the diversity of electrical signalning. J Physiol, 2012. 590(11): s. 2591-9.
11.Johnston, J., I. D. Forsythe, and C. Kopp-Scheinpflug, going native: voltage-gated potas channels controlling neuronal excitability. J Physiol, 2010. 588 (Pt 17): s. 3187-200.
12.Podjednostki Bocksteins, E., kv5, KV6, KV8 i kv9: nie ma prostych, cichych przechodniów. J Gen Physiol, 2016. 147(2): s. 105-25.
13.Wulff, H., N. A. Castle, and L. A. Pardo, Voltage-gated potas channels as therapeutic targets. Nat Rev Drug Discov, 2009. 8(12): p. 982-1001.
14.Bates, E., Kanały jonowe w rozwoju i raka. Annu Rev Cell Dev Biol, 2015. 31: s. 231-47.
15.Huang, X. I L. Y. Jan, ukierunkowanie kanałów potasowych w raku. J Cell Biol, 2014. 206(2): s. 151-62.
16.Huang, X., et al., Kanał potasowy EAG2 z ewolucyjnie zachowaną funkcją jako cel guza mózgu. Nat Neurosci, 2015. 18(9): s. 1236-46.
17.Kunzelmann, K., Ion channels and cancer. J Membr Biol, 2005. 205(3): s. 159-73.
18.Li, M. i Z. G. Xiong, kanały jonowe jako cele terapii nowotworowej. Int J Physiol Pathophysiol Pharmacol, 2011. 3(2): s. 156-66.
19.Pardo, L. A., Napięciowe kanały potasowe w proliferacji komórek. Fizjologia (Bethesda), 2004. 19: s. 285-92.
20.Urrego, D., et al., Kanały potasowe w cyklu komórkowym i proliferacji komórek. Philos Trans R Soc Lond B Biol Sci, 2014. 20130094
21.Zhou, Y., et al., Chemia koordynacji jonowej i uwodnienia ujawniona przez kompleks kanału K+-Fab w rozdzielczości 2.0 A. Nature, 2001. 414( 6859)
22.MacKinnon, R., potas channels. FEBS Lett, 2003. 555(1): s. 62-5.
23.Kuang, Q., P. Purhonen, and H. Hebert, Structure of potassium channels. Cell Mol Life Sci, 2015. 72(19): s. 3677-93.
24.Isacoff, E. Y., L. Y. Jan, and D. L. Minor, Jr., Conduits of life ’ s spark: a perspective on ion channel research since the birth of neuron. Neuron, 2013. 80(3): s. 658-74.
25.Swartz, K. J., wykrywanie napięcia przez błony lipidowe. Przyroda, 2008. 456 (7224)
26.Nusser, Z., Differential subcellular distribution of ion channels and the diversity of neuronal function. Curr Opin Neurobiol, 2012. 22(3): s. 366-71.
27.Lujan, R., Organization of potas channels on the neuronal surface. J Chem Neuroanat, 2010. 40(1): s. 1-20.
28.Abriel, H. and E. V. Zaklyazminskaya, cardiac channelopaties: genetyczne i molekularne mechanizmy. Gene, 2013. 517(1): p. 1-11.
29.Kullmann, D. M. and M. G. Hanna, zaburzenia neurologiczne spowodowane dziedzicznymi mutacjami jonowymi. Lancet Neurol, 2002. 1(3): s. 157-66.
30.Lehmann-Horn, F. I K. Jurkat-Rott, kanały jonowe bramkowane napięciem i choroba dziedziczna. Physiol Rev, 1999. 79(4): s. 1317-72.
31.Villa, C. and R. Combi, potas Channels and Human Epileptic Phenotypes: an Updated Overview. Front Cell Neurosci, 2016. 10: s. 81.
32.Long, S. B., E. B. Campbell i R. Mackinnon – struktura krystaliczna ssaków z rodziny prądotwórczych kanałów K+. Nauka, 2005. 309 (5736): P. 897-903.
33.Chen, X., et al., Struktura pełnowymiarowego kanału potasowego wytrząsarki KV1. 2 metodą krystalograficzną opartą na trybie normalnym. Proc Natl Acad Sci U S A, 2010. 107(25): p. 11352-7.
34.Clayton, G. M., et al., Struktura regionów transbłonowych bakteryjnego kanału cyklicznego regulowanego nukleotydem. Proc Natl Acad Sci U S A, 2008. 105(5): s. 1511-5.
35.Payandeh, J., et al., Struktura krystaliczna kanału sodowego ogrodzonego napięciem. Przyroda, 2011. 475 (7356)
36.Zhang, X., et al., Struktura krystaliczna ortologu kanału sodowego nachbac. Przyroda, 2012. 486 (7401)
37.Liao, M., et al., Struktura kanału jonowego TRPV1 określona za pomocą krio-mikroskopii elektronowej. Nature, 2013. 504 (7478)
38.Long, S. B., et al., Struktura atomowa zależnego od napięcia kanału K+ w środowisku przypominającym błonę lipidową. Nature, 2007. 450 (7168)