wprowadzenie
choroba Peyroniego (PD) jest zlokalizowanym, gojącym się ran zaburzeniem tkanki łącznej prącia charakteryzującym się bliznowaceniem tuniki albuginea. Ta włóknista blizna nieelastyczna prowadzi do bólu prącia, deformacji prącia i zaburzeń erekcji (ED) z trudnościami w wykonywaniu stosunku. Francois de la Peyronie po raz pierwszy opisał ten stan w 1743 roku, kiedy był chirurgiem Ludwika XIV we Francji. Chociaż wcześniejsze badania wykazały częstość występowania 0,3-0,7%, ostatnie publikacje wykazały ogólną częstość występowania 3,2-8,9%, przy czym ponad 75% przypadków występuje u mężczyzn w wieku od 45 do 65 lat (1,2). Należy zauważyć, że 10% pacjentów doświadcza wystąpienia objawów przed 40 rokiem życia (2). Ponadto częstość występowania PD po radykalnej prostatektomii wynosi aż 15,9%, a ostatnie badania wykazały, że skrzywienie prącia jest częstym stwierdzeniem (38,6%) w czasie operacji wszczepienia nadmuchiwanej protezy prącia w przypadku zaburzeń erekcji po leczeniu raka prostaty (3,4).
leczenie PD rozpoczyna się od skoncentrowanej historii i badania fizykalnego. Szczegółowa historia powinna oceniać informacje o początku i czasie trwania choroby, związanej z nią traumatycznej etiologii, stopniu skrzywienia prącia, utracie długości podczas erekcji i subiektywnym poziomie funkcji seksualnych. W odniesieniu do subiektywnej oceny seksualnej, standaryzowane kwestionariusze, takie jak Międzynarodowy Indeks funkcji erekcji (IIEF), pozwalają na obiektywną i subiektywną wstępną ocenę oraz narzędzie do pomiaru skuteczności podczas leczenia. Badanie fizykalne układu moczowo-płciowego powinny obejmować długość prącia podczas rozciągania, położenie płytki nazębnej i rozmiar. Stopień krzywizny może być oceniany przez pacjenta wykonującego zdjęcia wyprostowanego fallusa lub przez iniekcje wazoaktywne w połączeniu z USG Duplex dopplerowskim prącia.
zrozumienie historii naturalnej i patogenezy PD jest ważne dla wyboru odpowiednich schematów leczenia. Chociaż patofizjologia nie jest do końca zrozumiana, istnieje hipoteza, że podżeganie jest subklinicznym traumatycznym rozdarciem na tunice albuginea. Łza prowadzi do proliferacyjnej reakcji włóknistej, w wyniku czego powstaje blizna nieelastyczna. Leczenie PD dzieli się na te w fazie ostrej i te w fazie przewlekłej stabilizacji. Czas ostrej fazy jest luźno zdefiniowany jako mniej niż 12 miesięcy od wystąpienia objawów. W tym czasie, blizna pacjenta jest nadal modyfikować i zmieniać. Faza przewlekła jest określana, gdy krzywizna pacjenta utrzymuje się na stabilnym poziomie przez co najmniej 6 miesięcy. Podczas gdy leczenie chirurgiczne pozostaje złotym standardem dla PD, jest głównie oferowane mężczyznom w przewlekłej fazie choroby. U tych pacjentów w ostrej fazie farmakoterapia zapewnia możliwość poprawy funkcji, zmniejszenia deformacji i stabilizacji progresji blizn (5). W niniejszym dokumencie przeglądamy aktualną dostępną wiedzę na temat możliwości leczenia doustnego PD. Ważne jest, aby zauważyć, że podczas gdy niektóre wymienione zalecenia opierają się na ustaleniach opartych na dowodach, inne odzwierciedlają opinie ekspertów (Tabela 1).

pełna tabela
para-aminobenksoat potasu (POTABA)
POTABA jest związkiem znanym ze swoich właściwości przeciwfibrotycznych i przeciwzapalnych, które pomagają w leczeniu zaburzeń zwłóknienia, takich jak zapalenie skórno-mięśniowe i twardzina. Uważa się, że jego skuteczność wynika ze zmniejszenia tworzenia kolagenu poprzez obniżenie poziomu serotoniny, zwiększenie aktywności monoaminooksydazy i hamowanie wydzielania glikozoaminoglikanów fibroblastów (6). Pierwsze zaproponowane zastosowanie POTABA w leczeniu PD było w 1959 roku przez Zarafonetis i Horrax (7). W 2005 roku Weidner et al. przeprowadzono wieloośrodkowe, randomizowane, podwójnie ślepe, kontrolowane placebo badanie z udziałem preparatu POTABA (51 pacjentów) w porównaniu z placebo (52 pacjentów) u wcześniej nieleczonych pacjentów z PD, u których nie stwierdzono zwapnienia płytki nazębnej. Ramię próbne otrzymywało 3 g POTABA doustnie, 4 razy dziennie przez 12 miesięcy. Po 12 miesiącach u pacjentów przyjmujących preparat POTABA stwierdzono znaczną poprawę wielkości płytki prącia w porównaniu z pacjentami przyjmującymi placebo. Ponadto u pacjentów otrzymujących placebo obserwowano pogorszenie krzywizny. Autorzy doszli do wniosku, że POTABA może pomóc w stabilizacji tkanki bliznowatej, co zapobiegałoby postępowi krzywizny (6). Nie przeprowadzono dalszych randomizowanych badań kontrolnych w celu oceny skuteczności preparatu POTABA. Jest to prawdopodobnie spowodowane profilem skutków ubocznych, który obejmuje zaburzenia żołądkowo-jelitowe, biegunkę, ostre zapalenie wątroby i hipoglikemię (8).
witamina E
witamina E, rozpuszczalny w tłuszczach przeciwutleniacz, inaktywuje wolne rodniki, które nasycają tlenek azotu (NO), utrzymując w ten sposób aktywny poziom NO podwyższony, aby umożliwić prawidłowe gojenie się ran. Ograniczając stres oksydacyjny, potencjalnie oferuje również działanie przeciwzapalne. Został po raz pierwszy opisany w leczeniu PD w 1948 r. (9) i, ze względu na niski koszt i dostępność, pozostaje najczęściej przepisywanym środkiem doustnym dla PD (10). Pomimo stosowania w ciągu ostatnich siedmiu dekad, wiele projektów kontrolowanych placebo nie wykazało znaczącej poprawy bólu, stopnia krzywizny, rozmiaru płytki nazębnej lub zdolności do współżycia. W 1983 r. Pryor i Farrell zakończyli podwójnie ślepą, kontrolowaną placebo próbę witaminy E u 40 pacjentów z PD i nie stwierdzili znaczącej poprawy wielkości płytki nazębnej lub skrzywienia prącia (11). Ponadto, nowsze badanie przeprowadzone w 2007 r. przez Safarinejad et al. dostarczył największą do tej pory próbę oceniającą witaminę E na PD. Autorzy porównali witaminę E samą w skojarzeniu z L-karnityną do placebo u 236 mężczyzn z wczesną przewlekłą PD; klasyfikowany jako pacjent z bólem podczas erekcji, skrzywieniem prącia nie zakłócającym penetracji pochwy, niewybaczalną blizną bolesną, uszkodzeniem hiperechonicznym na USG prącia, brakiem zwapnienia i całkowitym obszarem płytki nazębnej <2 cm2. Grupa 1 (58 mężczyzn) otrzymywała witaminę E 300 mg doustnie dwa razy dziennie. Grupa 2 (59 mężczyzn) otrzymywała propionylo-L-karnitynę, 1 g doustnie dwa razy dziennie. Grupa 3 (60 mężczyzn) otrzymywała witaminę E 300 mg doustnie dwa razy na dobę oraz propionylo-L-karnitynę 1 g doustnie dwa razy na dobę. Wreszcie Grupa 4 otrzymywała podobny schemat placebo podczas 6-miesięcznego okresu próbnego. Po leczeniu nie stwierdzono istotnych zmian w zmniejszaniu krzywizny prącia pomiędzy czterema grupami (P=0,9), ani zmniejszenia wielkości płytki nazębnej (P=0,1) (12).
pomimo braku dowodów potwierdzających skuteczność witaminy E, nadal jest ona często przepisywana i często podawana jednocześnie z innymi sposobami leczenia z nadzieją na synergiczną rolę. Częste działania niepożądane związane ze stosowaniem witaminy E obejmują nudności, wymioty, biegunkę i zwiększone ryzyko raka prostaty i zdarzeń naczyniowo-mózgowych (13).
kolchicyna
chociaż kolchicyna jest głównie znana z leczenia dny moczanowej, wykazuje również właściwości, które pomagają w leczeniu PD. Kolchicyna depolimeryzuje tubulinę, hamując w ten sposób mitozę komórek, adhezję leukocytów i transport kolagenu. Stosując tę właściwość, kolchicyna powinna teoretycznie zmniejszać skurcz rany poprzez hamowanie odkładania kolagenu (14). Większość badań oceniających kolchicynę opisała pewną poprawę krzywizny, ale badania te nie były randomizowane, ani nie zapewniały obiektywnego pomiaru dla definicji poprawy. Safarinejad et al. okazało się, że jest to jedno z niewielu badań, w których oceniano działanie terapeutyczne kolchicyny poprzez ukończenie pojedynczego, randomizowanego, podwójnie ślepego, kontrolowanego placebo badania z udziałem 84 pacjentów z PD bez zwapnionych blaszek (15). Pacjenci w ramieniu kolchicyny byli leczeni 0,5-2,5 mg kolchicyny na dobę przez 4 miesiące. Pod koniec badania grupa kolchicyny nie wykazała obiektywnej poprawy skrzywienia prącia ani rozmiaru płytki nazębnej. Inne badania oceniały synergiczne działanie kolchicyny z witaminą E. Prieto Castro i wsp. odnotowano znaczną poprawę wielkości płytki nazębnej i skrzywienia prącia u pacjentów stosujących codziennie witaminę E i kolchicynę w porównaniu z samym ibuprofenem (16). Należy zauważyć, że w tym badaniu uczestniczyło tylko 45 pacjentów i nie było ramienia placebo. Jednak późniejsze retrospektywne badanie 100 mężczyzn nie wykazało statystycznie istotnych różnic w skuteczności łagodzenia bólu, skrzywienia prącia lub wielkości płytki nazębnej między kolchicyną a kolchicyną w połączeniu z witaminą E (17).
tamoksyfen
tamoksyfen jest niesteroidowym antagonistą receptora estrogenowego. W leczeniu PD wykazano, że zmniejsza fibrogenezę w tunice albuginea poprzez modulowanie uwalniania TGF-β uwalnianego z fibroblastu (18). Ralph et al. po raz pierwszy zaproponowano jego leczenie w 1992 roku w wyniku niekontrolowanego badania, które wykazało poprawę deformacji prącia u 11 na 31 mężczyzn. Jednak wyniki te nie były powtarzalne, gdy oceniano tamoksyfen w prospektywnym, kontrolowanym placebo badaniu z udziałem 25 pacjentów z PD bez zwapnionych płytek. Pomimo stosowania 20 mg tamoksyfenu dwa razy na dobę, nie zaobserwowano znaczącej poprawy w zakresie bólu, krzywizny lub wielkości płytki nazębnej w porównaniu z placebo (19).
karnityna
karnityna jest inhibitorem Acetylo-koenzymu-A, który pozwala na zmniejszenie powstawania wolnych rodników w czasach stresu komórkowego. W 2001 r. Biagiotti et al. przeprowadzono randomizowane badanie z udziałem 96 pacjentów z PD na L-karnitynę w porównaniu z tamoksyfenem. Wyniki wykazały znaczną poprawę krzywizny prącia w grupie L karnityny(20). Jak wspomniano powyżej, 4-ramienne badanie Safarinejad 2007 (witamina E, karnityna, witamina E i karnityna oraz placebo) nie wykazało znaczącej poprawy skrzywienia prącia, rozmiaru płytki nazębnej lub bólu (12).
kwas tłuszczowy Omega 3
podobnie jak inne środki doustne, kwasy tłuszczowe omega-3 zostały ocenione w leczeniu PD ze względu na znane właściwości przeciwzapalne. W 2009 r. Safarinejad et al. opublikowali swoje wyniki w prospektywnym, randomizowanym badaniu z podwójnie ślepą próbą omega-3 w porównaniu z placebo. Łącznie 224 pacjentów z wczesną przewlekłą PD przydzielono losowo do 1.84 g dziennej suplementacji omega-3 w porównaniu z placebo przez 6 miesięcy. Pacjenci byli oceniani za pomocą IIEF-5 i PDDU przed i po 6 miesiącach leczenia. Niestety nie odnotowano znaczącej poprawy w odniesieniu do objętości płytki nazębnej, skrzywienia prącia, bólu podczas erekcji i funkcji erekcji (21). Obecnie brak jest danych na poparcie korzystnego wpływu suplementacji omega-3 we wczesnej przewlekłej fazie PD.
Prokarbazyna
Prokarbazyna jest alkilującym lekiem chemioterapeutycznym często stosowanym w leczeniu chłoniaka OUN, chłoniaka Hodgkina i glejaków wysokiego stopnia. W 1968, Aron et al. odnotował regresję choroby Dupuytrena u pacjentów poddawanych leczeniu choroby Hodgkina prokarbazyną, co sugeruje jego zastosowanie w chorobie z proliferacją tkanki łącznej (22). Z tą przesłanką, w latach 70., Byström zaproponował prokarbazynę do leczenia PD, ale późniejsze badania nie wykazały żadnych obiektywnych korzyści. Ponadto w badaniach ujawniono znaczące skutki uboczne leku cytotoksycznego i zalecono, aby nie stosować go w łagodnej chorobie PD. Działania niepożądane obejmują mielosupresję, hepatotoksyczność, zmęczenie, zaburzenia żołądkowo-jelitowe i zaburzenia OUN (23,24).
inhibitory fosfodiesterazy typu 5 (inhibitory PDE-5)
chociaż powszechnie uważa się inhibitory PDE-5 za leczenie zaburzeń erekcji, ostatnie badania wykazały jego potencjalne zastosowanie w leczeniu zaburzeń erekcji u pacjentów z zaburzeniami erekcji lub bez nich. Inhibitory PDE-5 zwiększają cykliczny monofosforan guanozyny (cGMP) poprzez hamowanie degradacji cGMP do GMP. Wraz ze wzrostem cGMP i NO, synteza i odkładanie kolagenu są hamowane i występuje apoptoza fibroblastu i miofibroblastu (25). Ze względu na tę właściwość inhibitory PDE-5 mogą okazać się korzystne dla przebudowy blizn. W szczurzym modelu PD wykazano, że syldenafil powoduje znaczne zmniejszenie stosunku kolagenu do fibroblastów w Tunica albuginea, a także rozmiar płytki nazębnej (25). Chung i współpracownicy badają stosowanie tadalafilu w leczeniu PD u ludzi. Zgłosili, że 2.5 mg tadalafilu na dobę przez 6 miesięcy powodowało ustąpienie blizn przegrody przegrodowej u 69% (24/35) pacjentów bez wyczuwalnej płytki prącia. Tylko 10% ramienia nieleczonego zauważyło rozdzielczość blizny. Ważne jest, aby wspomnieć, że blizna przegrody międzyprzedsionkowej nie była klinicznie wyczuwalna, a większość pacjentów w tym badaniu nie miała skrzywienia (26). Niedawno w badaniu z 2014 r.odnotowano wyniki leczenia pacjentów z PD stosujących 50 mg syldenafilu na dobę lub 400 j. m. witaminy E przez 3 miesiące. Po 12 tygodniach w obu grupach zaobserwowano podobne zmniejszenie objętości płytki nazębnej i krzywizny prącia, co było istotne statystycznie. Różnice między tymi dwiema grupami nie były jednak istotne statystycznie. Kohorta syldenafilu wykazała statystycznie istotną poprawę w skali IIEF i zmniejszenie bólu w porównaniu z samą witaminą E (27). Konieczne byłoby przeprowadzenie na dużą skalę podwójnie ślepego badania placebo i potwierdzenie korzyści klinicznych inhibitora PDE-5, ale obecne badania są obiecujące (Tabela 2).
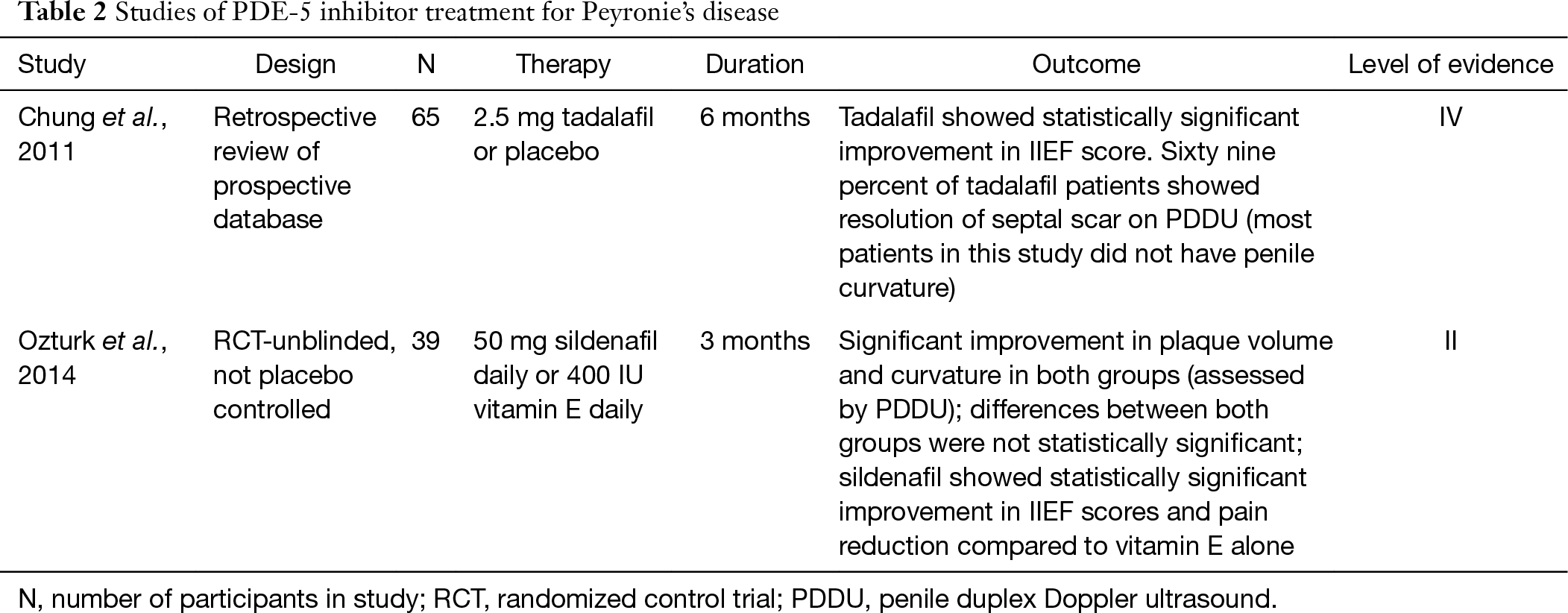
pełna tabela
L-arginina
L-arginina jest prekursorem NO, który stymuluje syntazę NO. Powoduje to wzrost NO, a także zmniejszenie fibroblastów z powodu apoptozy. Uważa się, że te dwie właściwości są mechanizmami stojącymi za L-argininą jako środkiem przeciwfibrotycznym (25). Jak już wspomniano, Valente et al. oceniano płytki prącia w modelach szczura leczonych inhibitorami PDE-5, ale także l-argininą. Podobnie jak inhibitory PDE-5, L-arginina wykazywała znaczne zmniejszenie wielkości płytki nazębnej, a także stosunek kolagenu do fibroblastów (25). Późniejsze badanie przeprowadzone przez Medeiros et al. wykazano, że arginina ma również działanie ochronne przeciwko tworzeniu się blizn podczas poddawania prącia szczurów promieniowaniu miednicy (28). W 2012 roku Abern et al. zauważono tendencję do poprawy krzywizny u pacjentów z PD leczonych terapią trakcji prącia w połączeniu z werapamilem dooponowym, doustną L-argininą i doustną pentoksyfiliną (PTX) (29). Chociaż badanie to ma wiele zmiennych, które mogą przyczynić się do poprawy krzywizny, okazuje się być jednym z niewielu badań na ludziach, w których L-arginina była stosowana w leczeniu PD. Biorąc pod uwagę te ustalenia, L-arginina może okazać się cenną opcją leczenia PD, ale potrzebne są dalsze badania na ludziach.
Pentoksyfilina(PTX)
chociaż większość leków doustnych badanych w leczeniu PD wykazała słabe lub nieokreślone wyniki w kontrolowanych badaniach, PTX wypadł znacznie lepiej. PTX jest pochodną ksantyny, która działa jako niespecyficzny inhibitor fosfodiesterazy o znanych właściwościach przeciwzapalnych i przeciw fibrogennych (30). Zaproponowano go do leczenia PD ze względu na badanie in vitro pokazujące, że zapobiega proliferacji fibroblastów Tunica albuginea, łagodzi odkładanie kolagenu za pośrednictwem TGF-B, zmniejsza odkładanie elastyny i zwiększa aktywność fibrynolityczną (31-33). Biorąc pod uwagę te właściwości, badanie z podwójnie ślepą próbą, kontrolowane placebo w 2010 r.miało na celu określenie wpływu PTX u pacjentów z wczesną przewlekłą PD (30). Dwieście dwudziestu ośmiu pacjentów losowo przydzielono do grupy otrzymującej 400 mg ptx o przedłużonym uwalnianiu w porównaniu z placebo przez 6 miesięcy. U większości uczestników nie powiodło się co najmniej jedno wcześniejsze leczenie PD. W grupie placebo prawdopodobieństwo progresji choroby było 4 razy większe (42%) niż w grupie leczonej (11%). Ponadto Grupa PTX wykazała znaczną poprawę zarówno w pomiarach obiektywnych, jak i subiektywnych; (I) poprawę skrzywienia prącia mierzonego za pomocą ultradźwięków duplex przed i po wstrzyknięciu prostaglandyny E1 do ciała; (II) objętość płytki nazębnej i (III) punktacja IIEF (30). Nowsze badania oceniały doustny PTX w połączeniu z doustnymi przeciwutleniaczami, wewnątrzsesionalnym PTX i wewnątrzsesionalnym werapamilem z różnymi wynikami (34,35). Podczas gdy PTX pozostaje silnym konkurentem w leczeniu PD, dalsze Duże wieloośrodkowe badania będą musiały zostać zakończone, aby zapewnić powtarzalność wyników(Tabela 3).

pełna tabela
wnioski
pomimo dziesięcioleci badań nad PD, ostateczna etiologia i patofizjologia nie zostały w pełni wyjaśnione. Podczas gdy leczenie chirurgiczne pozostaje złotym standardem dla przewlekłej ciężkiej PD, istnieje mnóstwo innych mniej inwazyjnych opcji leczenia, a mianowicie doustne i intralesional leki. W niniejszym dokumencie sprawdziliśmy najczęściej przepisywane lub omawiane środki doustne do leczenia PD. Chociaż wiele dobrze zaprojektowanych badań odkryło pozytywne odpowiedzi z doustnymi lekami, ich niewielka wielkość próby ogranicza moc i odtwarzalność badania. Obecnie wytyczne Amerykańskiego Stowarzyszenia Urologicznego stwierdzają, że lekarze nie powinni oferować terapii doustnej z witaminą E, tamoksyfenem, kwasem tłuszczowym omega – 3 lub połączeniem witaminy E Z L-karnityną. Podobnie międzynarodowe konsultacje w sprawie Medycyny Seksualnej z 2010 r.nie wspierały rutynowego klinicznego stosowania doustnych środków na PD (5). Dwa leki doustne, które nie są ograniczone przez wytyczne, to inhibitory PDE-5 i PTX. Dalsze badania nad PDE-5 i PTX, w tym Duże wieloośrodkowe podwójnie ślepe, randomizowane badania kontrolne, są potrzebne do określenia ich skuteczności. Obie klasy leków dają nadzieję na brak dozwolonych leków doustnych do leczenia PD.
Brak
przypis
konflikty interesów: autorzy nie mają konfliktu interesów do zadeklarowania.
- Mulhall JP, Creech SD, Boorjian SA, et al. Subiektywna i obiektywna analiza częstości występowania choroby Peyroniego w populacji mężczyzn poddanych badaniu przesiewowemu w kierunku raka prostaty. J Urol 2004;171: 2350-3.
- Mulhall JP, Schiff J, Guhring P. an analysis of the natural history of Peyronie ’ s disease. J Urol 2006;175:2115-8; dyskusja 2118.
- Tal R, Heck M, Teloken P, et al. Choroba Peyroniego po radykalnej prostatektomii: częstość występowania i czynniki predykcyjne. J Sex Med 2010; 7:1254-61.
- Lin H, Alba F, Romero C, et al. 1815 skrzywienie prącia jest częstym stwierdzeniem podczas implantacji protezy prącia u pacjentów z zaburzeniami erekcji po radykalnej prostatektomii. J Urol 2011;185: e728-e729.
- Ralph D, Gonzalez-Cadavid N, Mirone V, et al. Zarządzanie chorobą Peyroniego: wytyczne 2010 oparte na dowodach. J Sex Med 2010;7: 2359-74.
- Weidner W, Hauck EW, Schnitker J, et al. Paraaminobenzoesan potasu (POTABA) w leczeniu choroby Peyroniego: prospektywne, kontrolowane placebo, randomizowane badanie. Eur Urol 2005;47:530-5; dyskusja 535-6.
- Zarafonetis CJ, Horrax TM. Leczenie choroby Peyroniego za pomocą para-aminobenzoesanu potasu (potaba). J Urol 1959; 81: 770-2.
- Roy J, Carrier S. ostre zapalenie wątroby związane z leczeniem choroby Peyroniego para-aminobenzoesanem potasu (Potaba). J Sex Med 2008;5: 2967-9.
- Scott WW, Scardino pl. Nowa koncepcja w leczeniu choroby Peyroniego. South Med J 1948; 41:173-7.
- Standardowe procedury operacyjne w chorobie Peyroniego. J Sex Med 2013;10: 230-44.
- Pryor JP, Farrell CF. Kontrolowane badanie kliniczne witaminy E w chorobie Peyroniego. Prog Reprod Biol 1983; 9: 41-5.
- Safarinejad MR, Hosseini SY, Kolahi AA. Porównanie witaminy E i propionylo-L-karnityny, oddzielnie lub w skojarzeniu, u pacjentów z wczesną przewlekłą chorobą Peyroniego: podwójnie ślepe, kontrolowane placebo, randomizowane badanie. J Urol 2007;178: 1398-403; dyskusja 1403.
- Klein EA, Thompson IM Jr, Tangen CM, et al. Witamina E a ryzyko raka prostaty: próba profilaktyki raka selenu i witaminy E (SELECT). JAMA 2011;306:1549-56.
- El-Sakka AI, Bakircioglu ME, Bhatnagar RS, et al. Wpływ kolchicyny na stan podobny do Peyroniego w modelu zwierzęcym. J Urol 1999;161:1980-3.
- Safarinejad Mr.efekty terapeutyczne kolchicyny w leczeniu choroby Peyroniego: randomizowane, podwójnie ślepe, kontrolowane placebo badanie. Int J Impot Res 2004;16: 238-43.
- Prieto Castro RM, Leva Vallejo ME, Regueiro Lopez JC, et al. Leczenie skojarzone z witaminą E i kolchicyną we wczesnych stadiach choroby Peyroniego. BJU Int 2003; 91: 522-4.
- Cortés-González JR, Glina S. leczenie zachowawcze choroby Peyroniego: kolchicyna vs. kolchicyna plus Witamina E. Actas Urol Esp 2010;34: 444-9.
- Ralph DJ, Brooks MD, Bottazzo GF, et al. Leczenie choroby Peyroniego tamoksyfenem. Br J Urol 1992; 70: 648-51.
- Teloken C, Rhoden EL, Grazziotin TM, et al. Tamoksyfen a placebo w leczeniu choroby Peyroniego. J Urol 1999;162:2003-5.
- Biagiotti G, Cavallini G. Acetylo-L-karnityna vs tamoksyfen w terapii doustnej choroby Peyroniego: wstępny raport. BJU Int 2001; 88: 63-7.
- Safarinejad Mr.skuteczność i bezpieczeństwo omega-3 w leczeniu wczesnej fazy choroby Peyroniego: prospektywne, randomizowane, podwójnie ślepe badanie kontrolowane placebo. J Sex Med 2009;6:1743-54.
- Aron E. leczenie choroby Dupuytrena środkiem cytostatycznym (metylohydrazyna). Presse Med 1968; 76: 1956.
- Byström J, Johansson B, Edsmyr F, et al. Induratio penis plastica (choroba Peyroniego). Wyniki różnych form leczenia. Scand J Urol Nephrol 1972;6: 1-5.
- Oosterlinck W, Renders G. leczenie choroby Peyroniego prokarbazyną. Br J Urol 1975; 47: 219-20.
- Valente EG, Vernet D, Ferrini MG, et al. Inhibitory L-argininy i fosfodiesterazy (PDE) przeciwdziałają zwłóknieniu w płytce włóknistej Peyroniego i powiązanych kulturach fibroblastów. Nitric Oxide 2003; 9: 229-44.
- Chung E, Deyoung L, Brock GB. Rola inhibitorów PDE5 w przebudowie blizn przegrody prącia: ocena wyników klinicznych i radiologicznych. J Sex Med 2011; 8: 1472-7.
- Ozturk U, Yesil S, Goktug HN, et al. Wpływ leczenia syldenafilem na pacjentów z chorobą Peyroniego i zaburzeniami erekcji. Ir J Med Sci 2014;183: 449-53.
- Medeiros JL Jr, Costa ws, Felix-Patricio B, et al. Ochronne działanie suplementacji odżywczej argininą i glutaminą na penisa szczurów poddanych promieniowaniu miednicy. Andrology 2014;2: 943-50.
- Abern MR, Larsen S, Levine LA. Połączenie trakcji prącia, werapamilu wewnątrzsesionalnego i doustnych terapii choroby Peyroniego. J Sex Med 2012;9: 288-95.
- Safarinejad MR, Asgari MA, Hosseini Sy, et al. Podwójnie zaślepione, kontrolowane placebo badanie skuteczności i bezpieczeństwa stosowania pentoksyfiliny we wczesnej przewlekłej chorobie Peyroniego. BJU Int 2010;106: 240-8.
- Raetsch C, Jia JD, Boigk G, et al. Pentoksyfilina obniża poziom cytokin profibrogennych i ekspresji prokolagenu I u szczurów z wtórnym zwłóknieniem dróg żółciowych. Gut 2002; 50: 241-7.
- Schandené L, Vandenbussche P, Crusiaux A, et al. Różnicowy wpływ pentoksyfiliny na wytwarzanie czynnika martwicy nowotworu-alfa (TNF-alfa)i interleukiny-6 (IL-6) przez monocyty i komórki T. Immunologia 1992; 76: 30-4.
- Shindel AW, Lin G, Ning h, et al. Pentoksyfilina tłumi transformujący czynnik wzrostu-stymulowane β1 odkładanie kolagenu i elastogenezę w ludzkich fibroblastach pochodzących z tuniki albuginea Część 1: wpływ na macierz zewnątrzkomórkową. J Sex Med 2010;7: 2077-85.
- Paulis G, Barletta D, Turchi P, et al. Ocena skuteczności i bezpieczeństwa pentoksyfiliny związanej z innymi przeciwutleniaczami w leczeniu choroby Peyroniego: badanie kontrolne przypadku. Res Rep Urol 2015; 8: 1-10.
- Alizadeh m, Karimi F, Fallah Mr.ocena skuteczności werapamilu w chorobie Peyroniego w porównaniu z pentoksyfiliną. Glob J Health Sci 2014; 6: 23-30.
- Smith JF, Shindel AW, Huang YC, et al. Leczenie pentoksyfiliną i zwapnienia prącia u mężczyzn z chorobą Peyroniego. Asian J Androl 2011;13: 322-5.