padrões comuns de ligação em estruturas orgânicas
os métodos analisados acima para desenhar estruturas de Lewis e determinar cargas formais sobre átomos são um ponto de partida essencial para um químico orgânico noviço, e trabalhar muito quando se trata de pequenas estruturas simples. Mas como você pode imaginar, esses métodos tornam-se injustificadamente entediantes e demorados quando você começa a lidar com estruturas maiores. Seria irrealista, por exemplo, pedir-lhe para desenhar a estrutura de Lewis abaixo (de um dos quatro blocos de construção de nucleósidos que compõem o DNA) e determinar todas as cargas formais adicionando, numa base átomo-a-átomo, os elétrons de Valência.
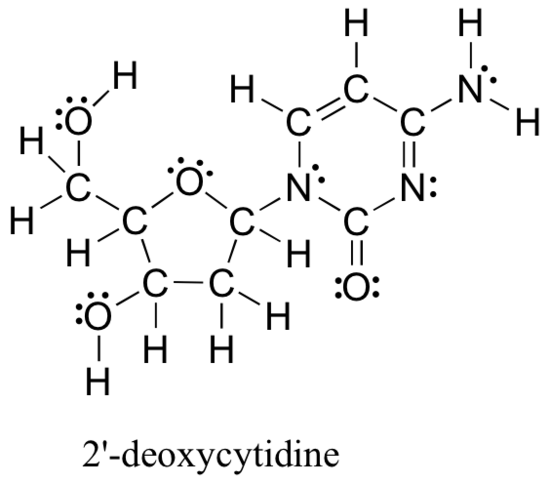
e ainda assim, como químicos orgânicos, e especialmente como químicos orgânicos que lidam com moléculas biológicas, você será esperado em breve para desenhar a estrutura de grandes moléculas como esta em uma base regular. Claramente, você precisa desenvolver a capacidade de desenhar rápida e eficientemente grandes estruturas e determinar taxas formais. Felizmente, esta capacidade não é terrivelmente difícil de obter-tudo o que é preciso são alguns atalhos e alguma prática em reconhecer padrões comuns de ligação.
vamos começar com o carbono, o elemento mais importante para químicos orgânicos. O carbono é dito ser tetravalente, o que significa que tende a formar quatro ligações. Se você olhar para as estruturas simples de metano, metanol, etano, eteno e etino nas figuras da seção anterior, você deve reconhecer rapidamente que em cada molécula, o átomo de carbono tem quatro ligações, e uma carga formal de zero.
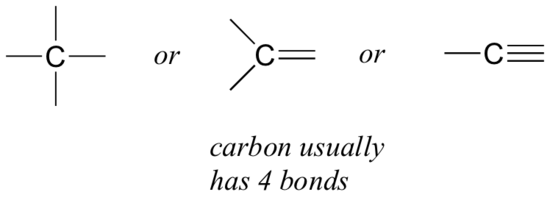
este é um padrão que se mantém em toda a maioria das moléculas orgânicas que veremos, mas também há exceções.
em dióxido de carbono, o átomo de carbono tem ligações duplas ao oxigênio em ambos os lados (o=c=o). Mais tarde, neste capítulo e ao longo deste livro, veremos exemplos de iões orgânicos chamados “carbocations” e carbanions, nos quais um átomo de carbono tem uma carga formal positiva ou negativa, respectivamente. Se um carbono tem apenas três ligações e uma concha de Valência não preenchida (em outras palavras, se não cumprir a Regra do octeto), terá uma carga formal positiva.
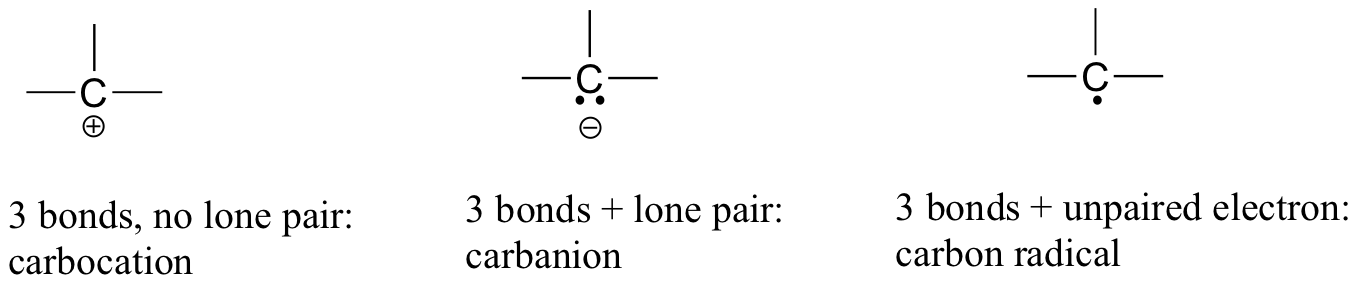
se, por outro lado, tiver três ligações mais um par de electrões, terá uma carga formal de -1. Outra possibilidade é um carbono com três ligações e um único elétron, não emparelhado (radical livre): neste caso, o carbono tem uma carga formal de zero. (One last possibility is a highly reactive species called a ‘carbene’, in which a carbon has two bonds and one lone pair of electrons, giving it a formal charge of zero. Você pode encontrar carbenos em cursos de química mais avançados, mas eles não serão discutidos mais neste livro).
deve certamente utilizar os métodos que aprendeu para verificar se estas taxas formais estão correctas para os exemplos acima apresentados. Mais importante, você precisará, antes de progredir muito mais em seu estudo da química orgânica, para simplesmente reconhecer esses padrões (e os padrões descritos abaixo para outros átomos) e ser capaz de identificar carbonos que carregam cargas formais positivas e negativas por uma rápida inspeção.
o padrão para os hidrogénios é fácil: os átomos de hidrogénio têm apenas uma ligação, e nenhuma carga formal. As exceções a esta regra são o próton, H+, E o íon hidreto, H-, que é um próton mais dois elétrons. Porque estamos nos concentrando neste livro na química orgânica aplicada aos seres vivos, no entanto, não estaremos vendo protões e hidretos ” nus ” como tal, porque eles são muito reativos para estar presentes nessa forma em solução aquosa. No entanto, a ideia de um próton será muito importante quando discutirmos a química ácido-base, e a ideia de um íon hidreto tornar-se-á muito importante muito mais tarde no livro quando discutirmos a oxidação orgânica e reações de redução. Como regra, porém, todos os átomos de hidrogênio em moléculas orgânicas têm uma ligação, e nenhuma carga formal.Vamos voltar para os átomos de oxigénio. Tipicamente, você verá uma ligação de oxigênio de três maneiras, todas as quais cumprem a Regra do octeto.
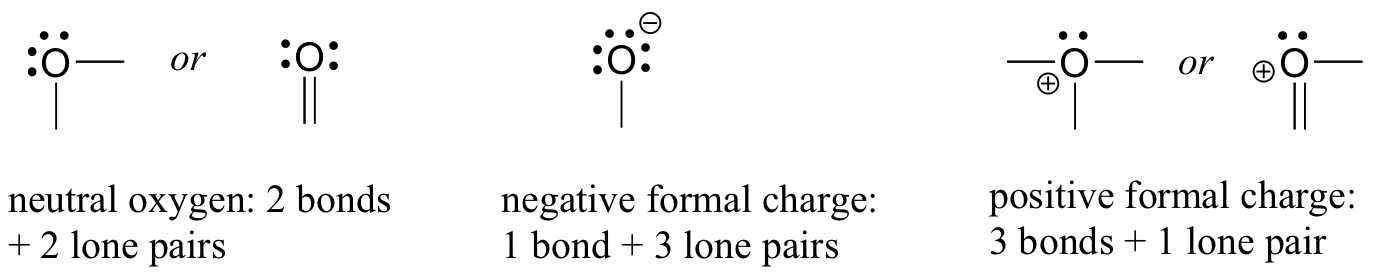
se tiver duas ligações e dois pares solitários, como na água, terá uma carga formal de zero. Se tiver uma ligação e três pares solitários, como no íon hidróxido, terá uma carga formal de-1. Se ele tem três ligações e um par solitário, como no íon hidrônio, ele terá uma carga formal de +1.Quando chegarmos à nossa discussão sobre a química radical livre no capítulo 17, veremos outras possibilidades, como onde um átomo de oxigênio tem uma ligação, um par solitário e um elétron não emparelhado (radical livre), dando-lhe uma carga formal de zero. Por agora, porém, concentrem-se nos três principais exemplos não Radicais, pois estes representarão praticamente tudo o que vemos até ao Capítulo 17.O nitrogênio tem dois padrões de ligação principais, ambos os quais cumprem a regra dos octetos.:
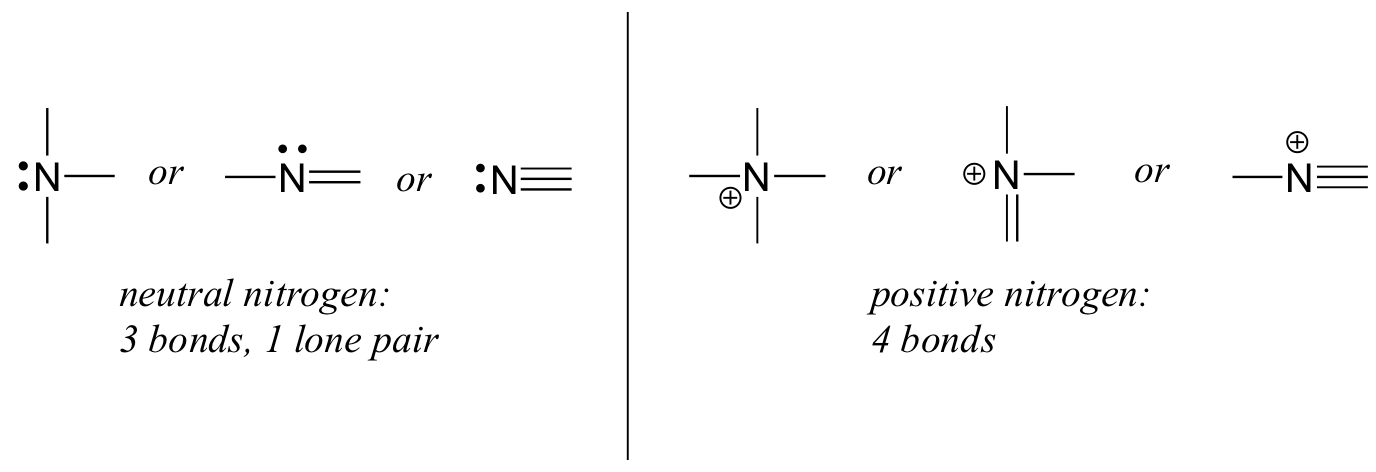
se um nitrogênio tem três ligações e um par solitário, ele tem uma carga formal de zero. Se tem quatro ligações (e nenhum par solitário), tem uma carga formal de +1. Em um padrão de ligação bastante incomum, nitrogênio carregado negativamente tem duas ligações e dois pares solitários.
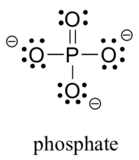
dois elementos da terceira linha são comumente encontrados em moléculas biológicas orgânicas: enxofre e fósforo. Embora ambos os elementos têm outro adesivo, padrões que são relevantes no laboratório de química, biológica contexto de enxofre, quase sempre segue a mesma ligação/carga formal padrão como o oxigênio, enquanto o fósforo está presente na forma de íon fosfato (PO43-), onde tem cinco títulos (quase sempre de oxigênio), não solitário pares, e um formal de carga igual a zero. Lembre-se que os elementos na terceira linha da tabela periódica têm orbitais d em sua concha de Valência, bem como orbitais s e p, e, portanto, não estão vinculados pela Regra do octeto.
finalmente, os halogéneos (flúor, cloro, bromo e iodo) são muito importantes em Química Orgânica laboratorial e medicinal, mas menos comuns em moléculas orgânicas de ocorrência natural. Os halogéneos em compostos orgânicos são geralmente vistos com uma ligação, três pares solitários e uma carga formal de zero. Às vezes, especialmente no caso do bromo, vamos encontrar espécies reativas em que o halogêneo tem duas ligações (geralmente em um anel de três membros), dois pares solitários, e uma carga formal de +1.

estas regras, se aprendidas e internalizadas de modo que você nem precisa pensar sobre elas, lhe permitirão desenhar grandes estruturas orgânicas, completas com cargas formais, muito rapidamente.
uma vez que você tem o jeito de desenhar estruturas de Lewis, nem sempre é necessário desenhar pares solitários em heteroátomos, como você pode assumir que o número adequado de elétrons estão presentes em torno de cada átomo para corresponder à carga formal indicada (ou falta dela). Ocasionalmente, porém, os pares solitários são desenhados se fazê-lo ajudar a tornar uma explicação mais clara.