de Volta para Escrever Estruturas de Lewis para as Moléculas
O esqueleto da estrutura de uma molécula covalente muitas vezes pode ser determinado considerando-se as valências dos átomos constituintes. Geralmente o átomo que forma o maior número de ligações é encontrado no centro do esqueleto, onde pode se conectar ao número máximo de outros átomos.
exemplo 1: o ácido hipocloroso tem a fórmula molecular HOCl. Desenhar uma fórmula estrutural
.
solução existem várias formas possíveis de ligar os átomos
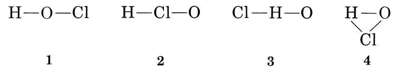
a valência habitual de H é 1, e assim as estruturas 3 e 4, que têm duas ligações a H, podem ser eliminadas. A valentia usual de Cl é também 1, e assim a estrutura 2 também pode ser descartada. A estrutura 1 mostra h formando uma ligação, Cl formando uma, e o formando duas, de acordo com as valências usuais, e assim é escolhido.
o número total de elétrons de Valência disponíveis é 1 de H Mais 6 de o mais 7 de Cl, ou 14. Preenchendo isto no esqueleto que temos
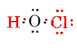
Note que O, que tinha a maior Valência, está no centro do esqueleto.
Exemplo 2:
Desenhar uma fórmula estrutural para hidroxilamina, NH3O.
Solução, neste caso, N tem a maior valência (3), seguido por S (2) e H (1). Ambos N e o podem formar “pontes” entre outros átomos, mas H não pode. Portanto, colocamos n e O no centro do esqueleto para dar
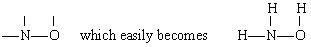
by addition of the three H atoms.
Há um total de 5 + 3 + 6 = 14 elétrons de valência N, 3H e O. Estes podem ser colocados da seguinte forma:
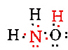
uma Vez que o diagrama de Lewis foi determinado, a fórmula molecular é muitas vezes reescrita para nos lembrar do que a fórmula estrutural é. Por exemplo, a fórmula molecular para hidroxilamina é geralmente escrita NH2OH em vez de NH3O para nos lembrar que dois H’s estão ligados a N e um A O. Supõe —se que a pessoa que lê a fórmula perceberá que N e o cada um tem um elétron de Valência para compartilhar uns com os outros, conectando —NH2 com-OH. Em alguns casos, mais de uma estrutura esqueleto irá satisfazer a valência de cada átomo e a Regra do octeto também. Por exemplo, você pode verificar que a fórmula molecular C2H6O corresponde a uma das seguintes:
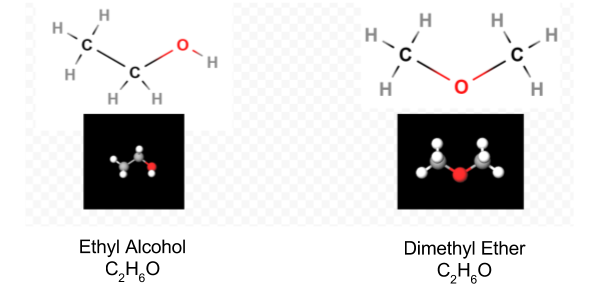
Em tal caso, só podemos decidir qual a estrutura molecular temos pela experiência. As propriedades do álcool etílico quando diluído com água e consumido são bem conhecidas. Éter dimetílico é um gás. Como o éter dietílico usado em salas de operações, é altamente explosivo e pode colocá-lo a dormir. Duas moléculas, tais como éter dimetílico e álcool etílico, que têm a mesma fórmula molecular, mas fórmulas estruturais diferentes são ditos ser isômeros.
de Volta para Escrever Estruturas de Lewis para as Moléculas
Agradecimentos:
O C2H6O moléculas e suas estruturas esqueléticas foram criados usando MolView.