introdução
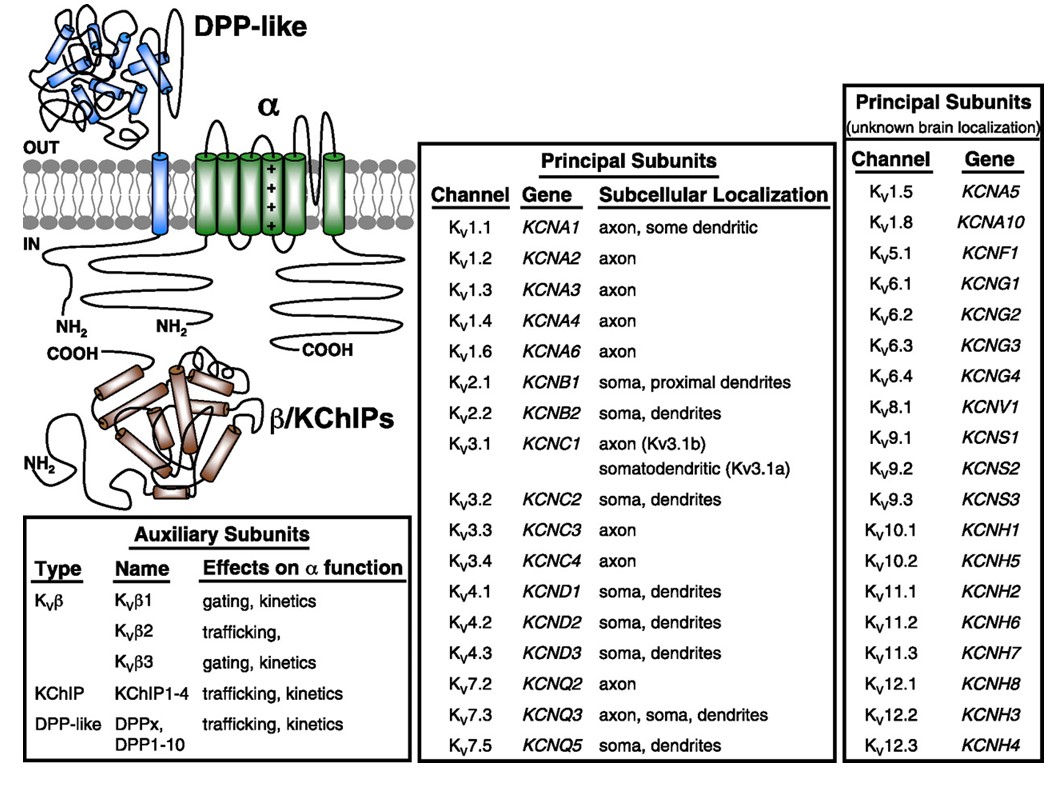
canais de potássio revestidos de Voltagem formam uma grande e diversa família que é conservada evolutivamente. Existem 40 genes do canal de potássio ligado à voltagem humana pertencentes a 12 subfamílias. Estes canais KV exibem amplas distribuições no sistema nervoso e outros tecidos. Para células excitáveis como neurônios, cardiomiócitos e músculos, os canais KV regulam a forma de onda e o padrão de disparo dos potenciais de ação. Os canais de KV também podem regular o volume de células, a proliferação e a migração de uma ampla gama de tipos de células.
os canais de potássio revestido por voltagem (KV) pertencem a uma das maiores e altamente conservadas famílias de canais de iões . Cada canal KV contém quatro subunidades α-formadoras de poros semelhantes ou idênticas, e também pode conter subunidades β-auxiliares que podem afetar a função do canal e/ou localização . Cada subunidade de formação de poros de canais KV contém seis segmentos transmembranares (S1-S6), com os primeiros quatro segmentos transmembranares (S1-S4) constituindo o sensor de tensão e os últimos dois segmentos transmembranares flanqueando um laço de poros (S5-P-S6) como o domínio de poros. Além do cromossomo localização de cada KV canal de genes em humanos, o rato e o rato, fisiológicas e farmacológicas propriedades do canal, e a sua distribuição tecidual e fisiopatologia foram fornecidos pelo Canal de Iões de Banco de dados pela Subcomissão de Tensão-gated canais de potássio do Comitê de Nomenclatura da União Internacional de Farmacologia (NC-IUPHAR). Este artigo apresenta uma introdução à diversidade e funções dos canais de potássio com voltagem.
conservação evolucionária dos canais de potássio
a selectividade K+que surgiu em procariontes é conservada em um grande número de canais de potássio com diversidade notável . Como mostrado na Figura 1, uma árvore evolutiva de tensão fechado cação do canal superfamily pode ser proposta com base na comparação do canal de genes no genoma humano com os genomas de outros metazoans incluindo o mouse, frango, baiacu, tunicate, frutas, mosca, mosquito, nematóide e a anêmona-do-mar . Esta árvore evolucionária prevê uma única origem da selectividade K+para retificar interiormente os canais de potássio (Kir), os canais de potássio revestido de voltagem (KV) e os canais de potássio de dois poros (K2P). É importante notar, no entanto, que uma seletividade K+distinta é provavelmente associada com o canal organelle K+ evolutivamente conservado que reside em endossomas e lisossomas .
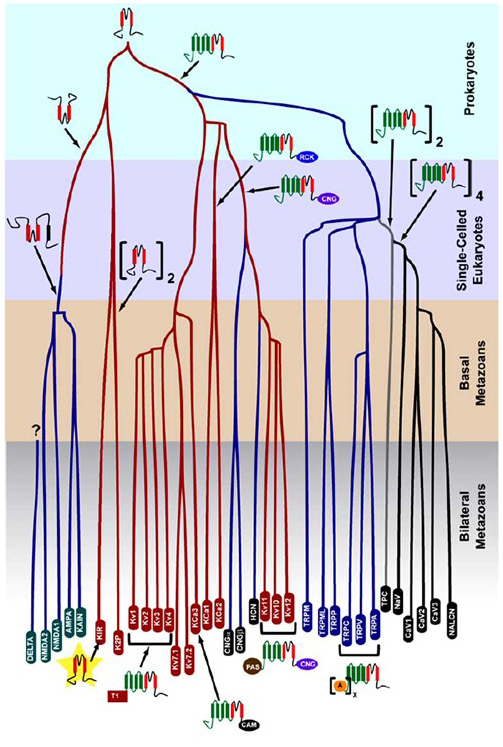
Figura 1. Uma árvore evolutiva para a gênese da superfamília do canal de catião fechado com voltagem. Com base em todo o genoma análises de canais de iões de cnidarians e bilaterais metazoans , esta árvore evolutiva retrata de uma origem comum para o K+-seletividade de canais de potássio (com nomes de família em vermelho ovais), que estão relacionados com tetrameric nucleotídeo cíclico-condomínio de cátions (GNV), canais por hiperpolarização-condomínio de cátions (HCN) canais e canais TRP, o dimeric TPC canais, e o monoméricos de Na+, Ca2+, e NALCN canais. Os comprimentos do ramo não refletem o tempo. Os nomes da família genética na marca inferior ramos individuais. Os receptores ionotrópicos de glutamato são incluídos com base na hipótese de que eles se originaram de uma inversão do domínio formador de poros do canal de potássio com dois segmentos transmembranares (vermelho). O domínio sensor de tensão tem quatro segmentos transmembranares (verde). A: repetições ankryin; CAM: domínio de ligação da calmodulina; GNC: domínio de ligação do nucleótido Cíclico; PAS: domínio Per-ARNT-Sim; RCK: regulador da condutância do domínio K+; T1: domínio de tetramerização.
diversidade dos canais de potássio dependentes da tensão
o genoma humano contém ~ 80 genes dos canais de potássio dos quais 40 genes codificam subunidades formadoras de poros de canais de potássio dependentes da tensão que caem em 12 subfamílias (Fig. 2). Fisiologicamente subdivididos em canais de potássio do tipo a que exibem uma rápida inactivação e canais de potássio retificadores atrasados sem uma rápida inactivação, estes canais KV são molecularmente e funcionalmente diversificados. A inactivação rápida, que pode afectar a duração do potencial de acção durante o disparo repetitivo, é evidente nos canais KV1 que contêm KV1.4 ou canais KVß1, KV3 e KV4 . A corrente de potássio retifier retardada originalmente caracterizada por Hodgkin e Huxley por seu papel no potencial de ação provavelmente corresponde aos canais lulas KV1 que podem contar com a edição de RNA para alcançar a diversidade funcional flexível como muitos pequenos axônios dos neurônios de fibra gigante fundem-se para formar o axônio gigante de lula com maior taxa de condução potencial de ação .
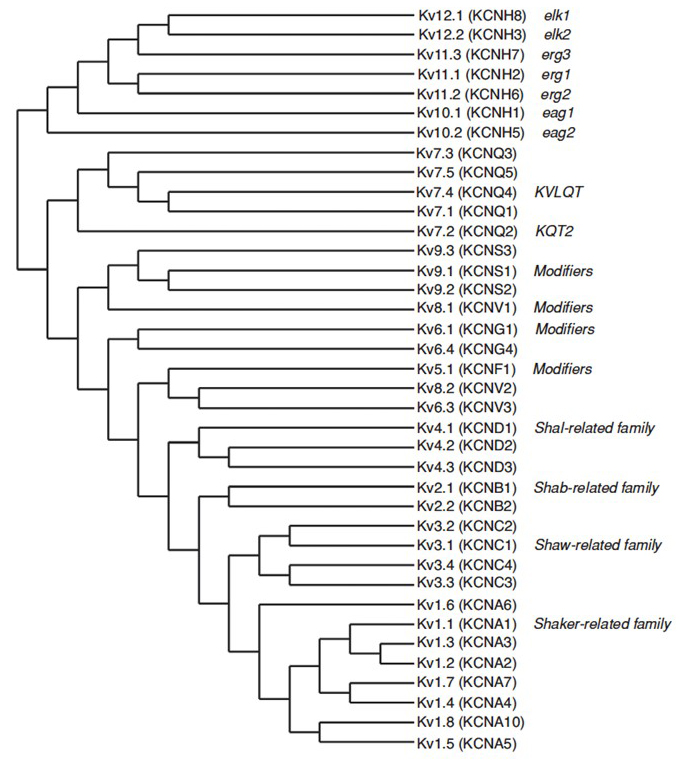
Figura 2. Árvore filogenética para as famílias KV1-12. Esta árvore filogenética é gerada com base em análises do domínio hidrofóbico contendo os seis segmentos transmembranares (S1-S6) . Ambos os nomes IUPHAR e HGNC (entre parênteses) são mostrados, juntamente com outros nomes comumente usados para estes canais de potássio de voltagem.
uma notável diversidade de canais de KV pode ser alcançada devido à mistura e combinação de subunidades de canais de KV. Dentro de cada uma das famílias KV1, KV2, KV3, KV4 e KV7, os canais homoméricos e heteroméricos podem formar-se com uma gama de propriedades funcionais . Os membros da família KV2 também podem se reunir com os membros da família KV5, KV6, KV8 ou KV9 com padrões de expressão mais restritos no sistema nervoso e músculos lisos , como ilustrado esquematicamente na figura. 3.

Figura 3. KV channel diversity via mix e match of pore-forming channel subunits. (A) O tetrameric KV canais com diferentes propriedades e distribuição englobam homomeric KV1, KV2, KV3, KV4, e KV7 canais, heteromeric de canais formados por membros diferentes dentro de cada uma destas KV canal famílias, e heteromeric canais formados pela assembleia da KV2 membros da família com KV5, KV6, KV8, ou KV9 membros da família . As famílias KV5, KV6 , KV8 e KV9 dão origem a canais homoméricos que são eletricamente silenciosos, provavelmente devido à sua retenção no retículo endoplasmático, portanto, eles são referidos como KVS. B) A reunião dos membros da família KV2 e KVS envolve os seus domínios citoplásmicos de terminais n e C; (C, D) A montagem de membros da família KV2 e KVS dá origem a canais heteroméricos com diferentes dependência de voltagem (C) e mecanismos de Gate (D) em comparação com canais homoméricos formados por membros da família KV2 .
diferenças funcionais na dependência de voltagem e cinética dos canais KV estão subjacentes às suas contribuições diferenciais para a modulação potencial de ação (Fig. 4). Enquanto os canais KV1, KV4 e KV7 requerem baixos níveis de despolarização de membrana para sua ativação, os canais KV2 e KV3 são ativados por uma maior despolarização. O primeiro, de baixa tensão ativada, canais KV podem afetar o limiar de geração potencial de ação e o número de potenciais de ação gerados durante a despolarização ou potenciais sinápticos excitatórios. Em contraste, os canais KV ativados de alta tensão podem modular a duração do potencial de ação e o padrão de disparo . A cinética dos canais KV também influencia as formas como contribuem para a geração potencial de ação. Enquanto os canais KV1 activados de baixa tensão com activação rápida podem afectar o limiar potencial de acção e a forma de onda, os canais KV3 activados de alta tensão e os canais KV2 podem ser activados sequencialmente durante um potencial de acção devido à diferença na sua cinética de activação, e os canais KV2 podem ter efeitos mais duradouros devido à sua cinética de inactivação lenta. Além disso, canais KV4 com inativação rápida poderia contribuir para a diferença na onda potencial de ação durante o disparo repetitivo, devido à supressão da atividade do canal KV4 pela despolarização .
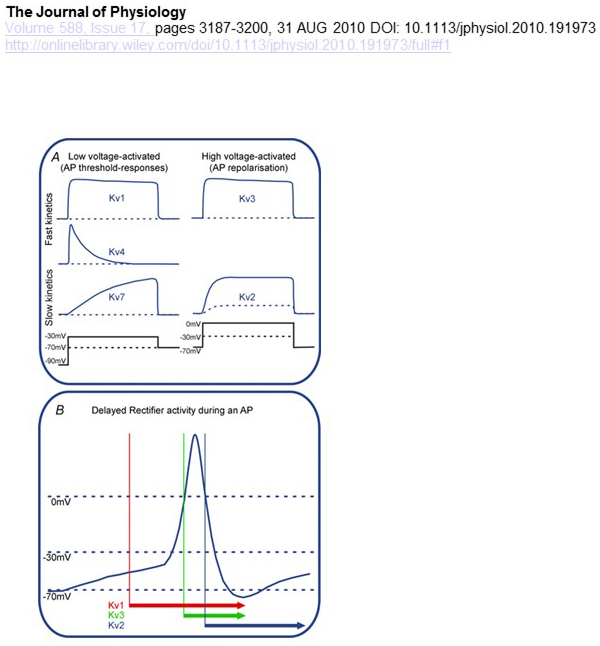
Figura 4. Diferenças funcionais dos canais KV e suas contribuições para o potencial de ação. A) os diferentes canais KV têm uma dependência de voltagem diferente para a activação e uma cinética diferente . B) os canais KV1 activados de baixa tensão com uma cinética rápida aberta à medida que a célula é despolarizada em direcção ao limiar para a geração potencial de Acção. Enquanto ambos os canais KV2 e KV3 são ativados de alta tensão, os canais KV3 abrem mais cedo que os canais KV2 durante um potencial de ação. Os canais KV2 também podem levar mais tempo para fechar após um potencial de ação .
potenciais aplicações terapêuticas de moduladores de canais de potássio
a capacidade dos moduladores de canais de potássio para alterar os padrões de disparo potencial de Acção levantou a questão de saber se poderiam ter valor terapêutico . Como indicado na Fig. 5, vários distúrbios neurológicos e psicológicos podem envolver alterações nos padrões de disparo potencial de ação, que podem ser modulados por Ativadores de canal KV e bloqueadores . Os canais de potássio com voltagem podem também desempenhar um papel na proliferação e migração celulares.; Por conseguinte, os moduladores de canal KV foram considerados para potenciais tratamentos do crescimento do cancro e metástases . Em Fig. 6, o KV1.2 estrutura de canal é utilizado para ilustrar esquematicamente que KV canal moduladores podem inibir a atividade do canal por obstruir o canal de permeação caminho, como no caso do exterior-poro-bloqueio de toxinas e interior dos poros bloqueadores, ou através de sua interação com o sensor de tensão para estabilizado o estado fechado do canal, como no caso de disparo do modificador de toxinas. Alternativamente, algumas moléculas pequenas agem ligando – se à máquina de gate como modificadores gativos, ou interagindo com a interface entre as subunidades α e β Para alterar a atividade do canal .
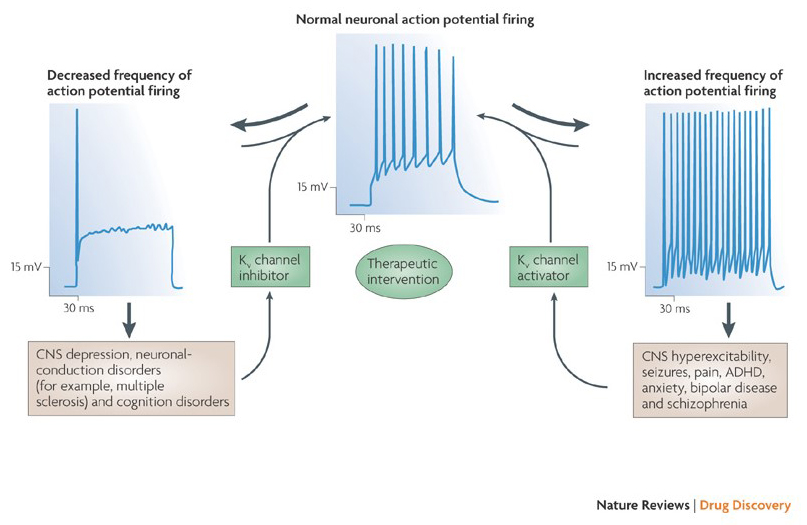
Figura 5. Aplicações potenciais dos moduladores de canais KV. Uma vez que os padrões de potencial de Acção anormal têm sido associados a doenças como epilepsia e esclerose múltipla, os activadores e inibidores do canal KV têm sido considerados para potenciais tratamentos terapêuticos de doenças que envolvem alteração da excitabilidade neuronal .
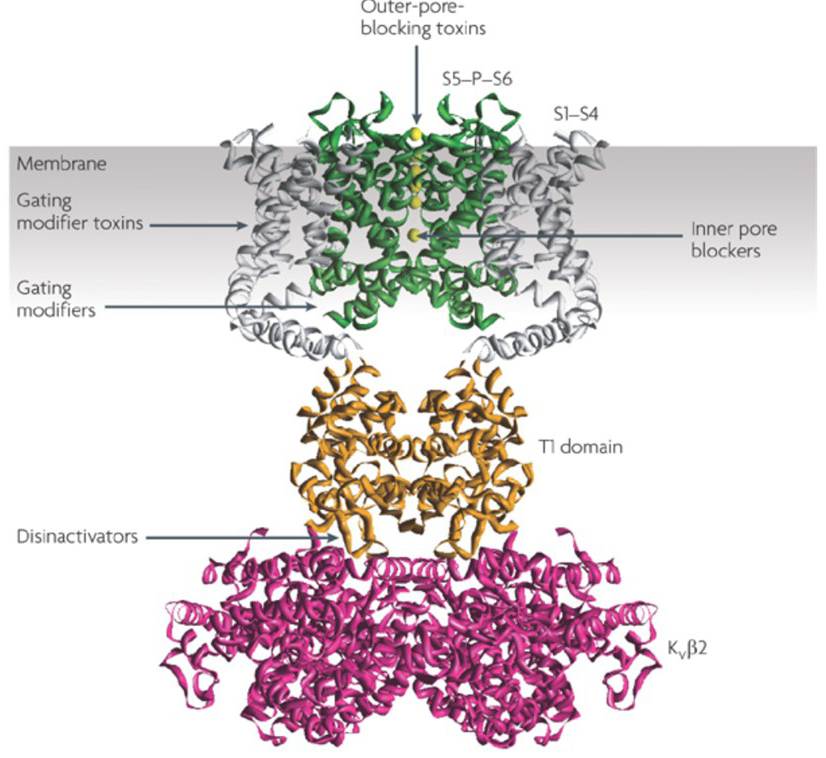
Figura 6. Exemplos de modos de acção dos moduladores de canais do KV. Existem várias maneiras diferentes para toxinas peptídicas e pequenas moléculas para modular a atividade do canal KV. A estrutura KV1.2 é mostrada com os domínios poros (S5-P-S6) em verde, os domínios sensores de tensão (S1-S4) em cinza, os domínios de tetramerização T1 em laranja, e as subunidades auxiliares KVß2 em magenta . As toxinas que bloqueiam poros exteriores de escorpiões, anemonas do mar, cobras e cones de caracóis podem ligar-se ao vestíbulo exterior e bloquear a permeação iónica. As toxinas modificadoras de aranhas como a hanatoxina podem interagir com o sensor de voltagem para aumentar a estabilidade do estado fechado, causando o deslocamento para a direita da curva de dependência de voltagem para ativação de canais. Existem também moduladores de pequenos canais moleculares que se ligam ao poro interno (bloqueadores de poros internos), às dobradiças de Gate (modificadores de gate), ou a interface entre as subunidades α – e β (desinativadores) .
Voltage-gated canal de potássio estrutura
O notável seletividade de canais de potássio, o que permite que K+ íons para atravessar o canal do poro com ordens de magnitude maior facilidade do que os mais de Na+ íons e com perto de difusão limitada a taxa , que é considerado na capacidade do backbone carbonilas da seletividade do filtro para coordenar K+ íons que são em grande parte despojado de sua hidratação conchas , para que mais de uma K+ ion irá mover-se através deste segmento mais estreito do poro em conjunto (Fig. 7) – um poro longo para a permeação de iões K+ em Ficheiro único, tal como previsto .
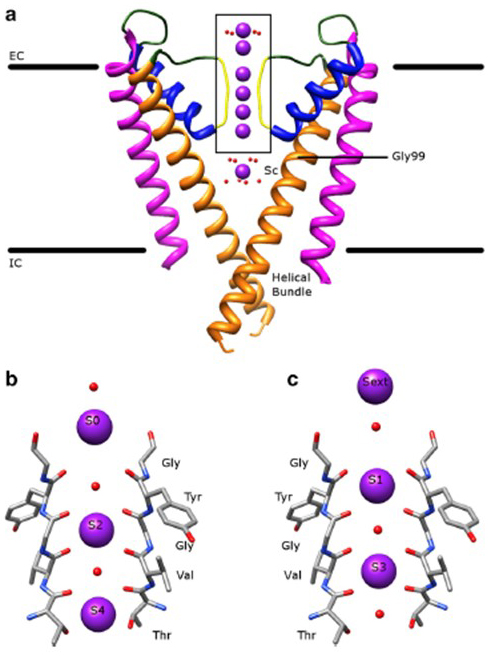
Figura 7. O domínio poro dos canais de potássio. a) estrutura do KcsA no estado condutor (PDB: 1K4C) , com as hélices exteriores em magenta, as hélices interiores em Laranja, as hélices de poro em azul e o filtro de selectividade em amarelo. K+ ions estão em roxo, enquanto suas moléculas de água circundantes estão em vermelho. EC: extracelular; IC: intracelular. (B, c) O filtro de selectividade na região de caixa da estrutura KcsA é mostrado com K+ iões ocupando as posições S2 e S4 (b) ou as posições S1 e S3 (C), para ilustrar a permeação de iões K+ em um único arquivo .
a dependência da tensão de ativação do canal KV deriva de seus domínios de sensor de tensão . Como mostrado na Fig. 8, canais KV e canais relacionados, tais como canais de sódio com voltagem e canais TRPV1 na mesma superfamília, têm arranjos semelhantes de seus domínios de poros e domínios de sensores de tensão. O domínio sensor de tensão de uma subunidade interage com o domínio poro de uma subunidade vizinha em uma configuração de troca de domínio, e dentro de um sensor de tensão os resíduos de arginina carregados positivamente em S4 podem interagir com resíduos ácidos carregados negativamente em hélices vizinhas (Fig. 9).
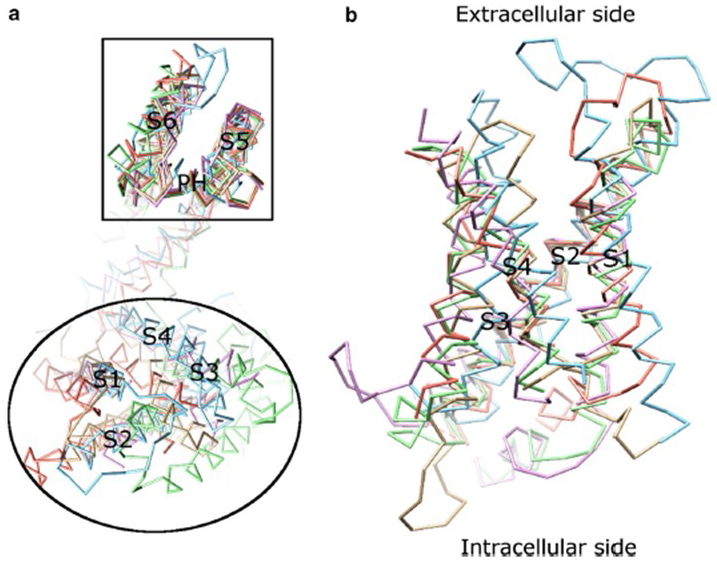
Figura 8. O domínio do sensor de tensão dos canais de potássio com voltagem. (a) alinhando o domínio poro (S5-P-S6) de diferentes canais iônicos revela que seus domínios de sensor de tensão (S1-S4) podem assumir uma variedade de orientações (vistas do lado extracelular). (b) Sobreposição de tensão do sensor de domínio de KV1.2 (PDB: 3LUT, magenta claro) com o sensor de tensão de domínios de MlotiK1 (PDB: 3BEH, luz-marrom) , NaVAb (PDB: 3RVY, luz verde) , NaVRh (PDB: 4DXW, laranja claro) e TRPV1 (PDB: 3J5P, a luz azul) (visto a partir da membrana) .
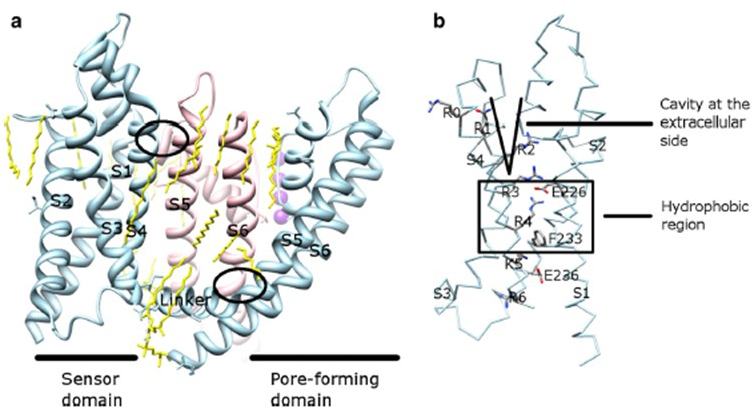
Figura 9. Contactos entre o domínio dos poros e o domínio do sensor de tensão dos canais KV. (a) The KV1.2-KV2.1 chimera (PDB: 2R9R) with the voltage sensor domain of one subunit (light blue) contacting the pore domain of a neighboring subunit (pink). Os contactos no lado intracelular envolvem a interacção do linker S4-S5 com o S6, e os contactos no lado extracelular envolvem a interacção entre o S1 e a hélice pore . Os lípidos (amarelos) que rodeiam o canal e entre o domínio dos poros e o domínio do sensor de tensão são detectáveis na estrutura do cristal. b) resíduos básicos de S4 e resíduos ácidos na sua proximidade no domínio dos sensores de tensão .Os canais de potássio por tensão são amplamente expressos em vários tecidos. Nos neurônios, eles são direcionados para vários compartimentos subcelulares(Fig. 10), e canais de diferentes composições subunitárias podem estar presentes em diferentes subpopulações de neurônios . Mutações dos genes do canal KV podem causar doenças neurológicas tais como ataxia episódica e epilepsias, doenças cardíacas e surdez . A conservação evolutiva da função do canal KV é evidente, por exemplo, a partir de distúrbios de movimento similares causados pela mutação de ortólogos KV1 em humanos, mouse e a mosca da fruta .
Figura 10. Distribuição subcelular dos canais de potássio com voltagem. O esquema no canto superior esquerdo mostra um canal KV4 com duas subunidades auxiliares diferentes. A localização subcelular de vários canais KV nos neurónios centrais dos mamíferos está indicada na caixa do meio .
referências e notas
1.Hille, B., canais iónicos de membranas excitáveis, 3rd, Ed. 2001: Sinauer Associates Inc.
2.Gonzalez, C., et al., K (+) canals: function-structural overview. Global Physiol, 2012. 2 (3): p. 2087-149.
3.Vacher, H., D. P. Mohapatra, and J. S. Aparador, localização e localização de canais iónicos dependentes de voltagem nos neurónios centrais dos mamíferos. Physiol Rev, 2008. 88 (4): p. 1407-47.
4.Jegla, T. J., et al., Evolution of the human ion channel set. Comb Chem High Throughput Screen, 2009. 12(1): p. 2-23.
5.Cang, C., et al., TMEM175 é uma organela K (+) que regula a função Lisossómica. Cell, 2015. 162 (5): p. 1101-12.
6.Hodgkin, A. L. and A. F. Huxley, Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J Physiol, 1952. 116 (4): p. 449-72.
7.Rosenthal, J. J., T. I. Liu, and W. F. Gilly, uma família de retificadores atrasados cDNAs KV1 mostrando a expressão específica do tipo de célula no complexo de gânglios de stellate de Lula/lóbulo de fibra gigante. J Neurosci, 1997. 17 (13): p. 5070-9.
8.Young, J. Z., neurônios fundidos e contatos sinápticos nas fibras nervosas gigantes dos cefalópodes. Phil Trans R Soc Lond B, 1939. 229: P. 465-503.
9.Rosenthal, J. J. and F. Bezanilla, Extensive editing of mRNAs for the squid delayed rectifier K+ channel regulates subunit tetramerization. Neuron, 2002. 34 (5): p. 743-57.
10.Jan, L. Y. E Y. N. Jan, canais de potássio com voltagem e a diversidade de sinalização elétrica. J Physiol, 2012. 590 (11): p. 2591-9.
11.Johnston, J., I. D. Forsythe, and C. Kopp-Scheinpflug, Going native: voltage-gated potassium channels controlling neuronal excitability. J Physiol, 2010. 588 (Pt 17): p. 3187-200.
12.Bocksteins, E., KV5, KV6, KV8, and KV9 subunits: No simple silent bystanders. J Gen Physiol, 2016. 147 (2): p. 105-25.
13.Wulff, H., N. A. Castle, and L. A. Pardo, Voltage-gated potassium channels as therapeutic targets. Nat Rev Drug Discov, 2009. 8 (12): p. 982-1001.
14.Bates, E., Canais iónicos em desenvolvimento e cancro. Annu Rev Cell Dev Biol, 2015. 31: p. 231-47.
15.Huang, X. E L. Y. Jan, visando canais de potássio no cancro. J Cell Biol, 2014. 206 (2): p. 151-62.
16.Huang, X., et al., Canal de potássio EAG2 com função evolutivamente conservada como alvo de tumor cerebral. Nat Neurosci, 2015. 18 (9): p. 1236-46.
17.Kunzelmann, K., canais iónicos e cancro. J Membr Biol, 2005. 205 (3): p. 159-73.
18.Li, M. and Z. G. Xiong, Ion channels as targets for cancer therapy. Int J Physiol Pathophysiol Pharmacol, 2011. 3 (2): p. 156-66.
19.Pardo, L. A., Canais de potássio com voltagem na proliferação celular. Physiology (Bethesda), 2004. 19: p. 285-92.
20.Urrego, D., et al., Canais de potássio no ciclo celular e proliferação celular. Philos Trans R Soc Lond B Biol Sci, 2014. 369 (1638): P. 20130094.
21.Zhou, Y., et al., Química de coordenação iônica e hidratação revelada por um complexo K+ de canal-Fab em resolução 2.0 A. Nature, 2001. 414( 6859): P. 43-8.
22.MacKinnon, R., canais de potássio. FEBS Lett, 2003. 555 (1): p. 62-5.
23.Kuang, Q., P. Purhonen, and H. Hebert, Structure of potassium channels. Cell Mol Life Sci, 2015. 72 (19): p. 3677-93.
24.Isacoff, E. Y., L. Y. Jan, and D. L. Minor, Jr., Conduits of life’s spark: a perspective on ion channel research since the birth of neuron. Neuron, 2013. 80 (3): p. 658-74.
25.Swartz, K. J., detectando tensão através das membranas lipídicas. Nature, 2008. 456 (7224): P. 891-7.
26.Nusser, Z., Differential subcelular distribution of ion channels and the diversity of neuronal function. Curr Opin Neurobiol, 2012. 22 (3): p. 366-71.
27.Lujan, R., organização dos canais de potássio na superfície neuronal. J Chem Neuroanat, 2010. 40(1): p. 1-20.
28.Abriel, H. E e. V. Zaklyazminskaya, Cardiac channelopaties: genetic and molecular mechanisms. Gene, 2013. 517( 1): p. 1-11.
29.Kullmann, D. M. E M. G. Hanna, distúrbios neurológicos causados por mutações herdadas de canais iónicos. Lancet Neurol, 2002. 1 (3): p. 157-66.
30.Lehmann-Horn, F. E K. Jurkat-Rott, canais iónicos voltados para a tensão e doenças hereditárias. Physiol Rev, 1999. 79 (4): p. 1317-72.
31.Villa, C. and R. Combi, Potassium Channels and Human Epileptic Phenotypes: An Updated Overview. Neuroci Da Frente, 2016. 10: p. 81.
32.Long, S. B., E. B. Campbell, and R. Mackinnon, estrutura cristalina de um canal K+ dependente de voltagem de mamíferos. Science, 2005. 309 (5736): P. 897-903.
33.Chen, X., et al., Estrutura do canal KV1.2 de potássio Shaker de comprimento total por refinamento cristalográfico baseado no modo normal. Proc Natl Acad Sci U S A, 2010. 107 (25): p. 11352-7.
34.Clayton, G. M., et al., Estrutura das regiões transmembranares de um canal bacteriano regulado por nucleótidos cíclicos. Proc Natl Acad Sci U S A, 2008. 105 (5): p. 1511-5.
35.Payandeh, J., et al., A estrutura cristalina de um canal de sódio com voltagem. Nature, 2011. 475( 7356): P. 353-8.
36.Zhang, X., et al., Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel. Nature, 2012. 486( 7401): P. 130-4.
37.Liao, M., et al., Estrutura do canal de íon TRPV1 determinada por crio-microscopia eletrônica. Nature, 2013. 504( 7478): P. 107-12.
38.Long, S. B., et al., Estrutura atômica de um canal K+ dependente de voltagem em um ambiente de membrana lipídica. Nature, 2007. 450 (7168): P. 376-82.