não é óbvio. Elétrons de Valência são aqueles que são importantes na ligação química. Para metais de transição, a palavra “importante” variará dependendo do contexto.
é mais fácil e mais prático descrever quais orbitais são orbitais de Valência quando se trata de metais de transição (embora se torne difícil com lantanídeos e actinídeos).
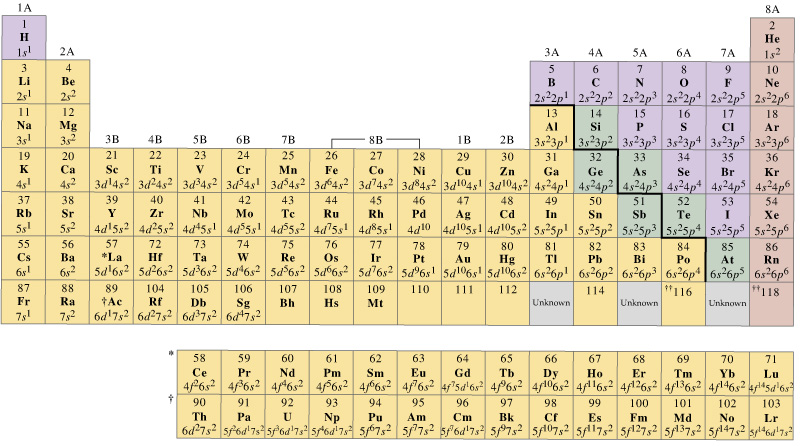
em geral, os metais de transição de primeira linha têm um conjunto de orbitais de Valência que incluem os seus #4s# e #3d#’s, mas o número de elétrons de Valência vai variar.
por exemplo…

- o Escândio faz sentido ter até três elétrons de Valência, uma vez que um #”Sc”^(+3)# estado de oxidação existe (por exemplo #”ScCl”_3#), mas não #”Sc”^(+4)# ou superior. Um estado de oxidação # + 3# teria exigido a transferência de três elétrons de Valência se formasse um catião puro.
- cromo poderia ter até seis elétrons de Valência, que incluiriam seus elétrons# 3d#, uma vez que pode realizar um estado de oxidação # + 6# (ou seja, em # ” Cr ” _2 ” O “_7^(2 -)#, ou em # “CrO”_4^(2-)#).
- cobre tende a ter um estado de oxidação # + 1# (por exemplo, #”CuCl”#), por isso faz sentido que ele usa seu um #4s# elétron na maioria das vezes como seu elétron de Valência (s). Mas um estado de oxidação # + 2# também é conhecido (por exemplo#”CuCl” _2#), e por isso é capaz de tirar de seus elétrons# bb(3d) # elétrons, bem como por seus elétrons de Valência.Por outro lado, poderíamos facilmente dizer que os orbitais de Valência dos metais de transição da primeira linha são os orbitais #4s# e #3d#.
assim, em geral, eu diria que o número de elétrons de Valência para metais de transição (e lantanídeos e actinídeos) variam de uma forma imprevisível, mas os orbitais de Valência às vezes podem ser previstos com suficiente intuição química.
DISCLAIMER: é, no entanto, em geral difícil para os lantanídeos e actinídeos prever quais orbitais são Valência.
por exemplo, os actinídeos têm #5f# e #6d# orbitais muito próximos em energia aos seus #7s# orbitais, então podemos adivinhar e incluir os #7s#, #6d#, e o #5f# no espaço de Valência (mesmo que os #6d# orbitais estejam vazios) ao realizar cálculos de energia atômica.