Objetivos
no final desta seção, você será capaz de:
- Escrever símbolos de Lewis para átomos neutros e íons
- Desenhar estruturas de Lewis, representando a ligação em moléculas simples
Nós discutimos os diferentes tipos de vínculos que se formam entre os átomos e/ou íons. Em todos os casos, estas ligações envolvem a partilha ou transferência de elétrons de concha de Valência entre átomos. Nesta seção, vamos explorar o método típico para representar elétrons de concha de Valência e ligações químicas, nomeadamente símbolos de Lewis e estruturas de Lewis.
Símbolos de Lewis
usamos símbolos de Lewis para descrever configurações de elétrons de valência de átomos e íons monatômicos. Um símbolo de Lewis consiste num símbolo elementar rodeado por um ponto para cada um dos seus electrões de Valência.:
Figura 1 mostra os símbolos de Lewis para os elementos do terceiro período da tabela periódica.

Figura 1. Símbolos de Lewis ilustrando o número de elétrons de Valência para cada elemento no terceiro período da tabela periódica.
Símbolos de Lewis também podem ser usados para ilustrar a formação de catiões a partir de átomos, como mostrado aqui para sódio e cálcio.:

da Mesma forma, eles podem ser usados para mostrar a formação de ânions de átomos, como mostrado a seguir para o cloro e o enxofre:

Figura 2 demonstra o uso de símbolos de Lewis para mostrar a transferência de elétrons durante a formação dos compostos iónicos.

Figura 2. Catiões são formados quando os átomos perdem elétrons, representados por menos pontos de Lewis, enquanto aniões são formados por átomos ganhando elétrons. O número total de elétrons não muda.
Estruturas de Lewis
Nós também usamos símbolos de Lewis para indicar a formação de ligações covalentes, que são apresentados em estruturas de Lewis, desenhos que descrevem a ligação em moléculas e polyatomic íons. Por exemplo, quando dois átomos de cloro formam uma molécula de cloro, eles compartilham um par de elétrons.:

A estrutura de Lewis indica que cada átomo de Cl tem três pares de elétrons que não são usados na ligação (chamada lone pares) e uma compartilhada par de elétrons (escrito entre os átomos). Um traço (ou linha) é às vezes usado para indicar um par compartilhado de elétrons:

um par de elétrons compartilhados é chamado de uma única ligação. Cada átomo de Cl interage com oito elétrons de Valência: os seis nos pares solitários e os dois na única ligação.
The Octet Rule
The other halogen molecules (F2, Br2, I2, and At2) form bonds like those in the chlorine molecule: one single bond between atoms and three lone pairs of electrons per atom. Isto permite que cada átomo de halogênio tenha uma configuração de elétrons de gás nobre. A tendência dos átomos do grupo principal para formar ligações suficientes para obter oito elétrons de Valência é conhecida como a regra dos octetos.
O número de ligações que um átomo pode formar-se muitas vezes pode ser prevista a partir do número de elétrons necessários para atingir um octeto (oito elétrons de valência); isto é especialmente verdadeiro para o nonmetals do segundo período da tabela periódica (C, N, O e F). Por exemplo, cada átomo de um elemento do grupo 14 tem quatro elétrons em sua concha externa e, portanto, requer mais quatro elétrons para alcançar um octeto. Estes quatro elétrons podem ser obtidos através da formação de quatro ligações covalentes, como ilustrado aqui para o carbono em CCl4 (tetracloreto de carbono) e silício em SiH4 (silano). Como o hidrogênio só precisa de dois elétrons para preencher sua concha de Valência, é uma exceção à Regra do octeto. Os elementos de transição e os elementos de transição internos também não seguem a regra octet:

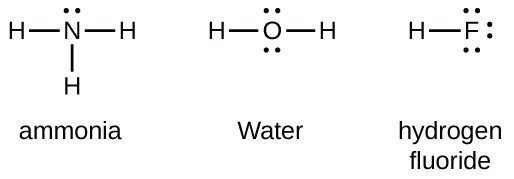
Grupo de 15 elementos como o nitrogênio tem cinco elétrons de valência no atômica Lewis símbolo: um par solitário e três electrões desemparelhados. Para obter um octeto, estes átomos formam três ligações covalentes, como em NH3 (amônia). O oxigénio e outros átomos do grupo 16 obtêm um octeto formando duas ligações covalentes:
Duplas e Triplas
Como mencionado anteriormente, quando um par de átomos de ações de um par de elétrons, nós chamamos isso de um título único. No entanto, um par de átomos pode precisar compartilhar mais de um par de elétrons, a fim de alcançar o octeto necessário. Uma dupla ligação forma-se quando dois pares de elétrons são compartilhados entre um par de átomos, como entre os átomos de carbono e oxigênio em CH2O (formaldeído) e entre os dois átomos de carbono em C2H4 (etileno):
Uma ligação tripla formas quando três pares de elétrons são compartilhados por um par de átomos, como em gás nitrogênio (N2):
Escrever Estruturas de Lewis com a Regra do Octeto
muito simples moléculas e íons moleculares, podemos escrever as estruturas de Lewis por apenas emparelhamento até os electrões desemparelhados na constituinte de átomos. Veja estes exemplos:

para moléculas e íons moleculares mais complicados, é útil seguir o procedimento passo a passo descrito aqui:
- determina o número total de elétrons de Valência (camada exterior).
- desenhar uma estrutura esqueleto da molécula, organizando os átomos em torno de um átomo central. (Geralmente, o elemento menos eletronegativo deve ser colocado no centro.) Ligar cada átomo ao átomo central com uma única ligação (um par de elétrons).
- distribui os restantes electrões como pares solitários nos átomos terminais (excepto hidrogénio), completando um octeto em torno de cada átomo.
- Coloque todos os electrões remanescentes no átomo central.
- Rearrange the electrons of the outer atoms to make multiple bonds with the central atom in order to obtain octets where possible.
vamos determinar a estrutura de Lewis Do PBr3 usando os passos acima:
- Passo 1: Determinar o número total de elétrons de Valência (concha exterior).
\grande \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{PBr}}_{3}\\ \phantom{\rule{0.8 em}{0ex}}\text{P: 5 elétrons de valência/atom}\times \text{1 átomo}=5\\ \underline{+\text{Br: 7 de elétrons de valência/atom}\times \text{3 átomos}=21}\\ \\ \phantom{\rule{15.95em}{0ex}}=\text{26 electrões de Valência}\end{array}
- Passo 2: desenhar uma estrutura esqueleto da molécula, organizando os átomos em torno de um átomo central. (Geralmente, o elemento menos eletronegativo deve ser colocado no centro.) Ligar cada átomo ao átomo central com uma única ligação (um par de elétrons).

- Passo 3: distribuir os elétrons restantes como pares solitários nos átomos terminais (exceto hidrogênio), completando um octeto em torno de cada átomo.
- Lewis doagram of PBr3. Um único átomo de fósforo ligado a três átomos de bromo. Cada átomo de bromo tem três pares solitários.Passo 4: Colocar todos os electrões remanescentes no átomo central.

Nota: Passo 5: não é necessário uma vez que todos os átomos têm um octeto.
vamos determinar a estrutura de Lewis de CH2O.
- Passo 1: Determinar o número total de elétrons de Valência (concha exterior).
\grande \begin{array}{l}\\ \phantom{\rule{0.8 em}{0ex}}{\text{H}_{2}}\text{CO}\\ \phantom{\rule{0.8 em}{0ex}}\text{H: 1 de elétrons de valência/atom}\times \text{2 átomo}=2\\\text{C: 4 elétrons de valência/atom}\times \text{1 átomo}=4\\ \underline{+\text{S: 6 elétrons de valência/atom}\times \text{1 átomos}=6}\\ \\ \phantom{\rule{15.95 em}{0ex}}=\text{12 elétrons de valência}\end{array}
- Passo 2: Desenhe um esqueleto estrutura da molécula, organizando os átomos ao redor de um átomo central. (Geralmente, o elemento menos eletronegativo deve ser colocado no centro.) Ligar cada átomo ao átomo central com uma única ligação (um par de elétrons).

- Passo 3: distribuir os elétrons restantes como pares solitários nos átomos terminais (exceto hidrogênio), completando um octeto em torno de cada átomo.

- Passo 4: não é necessário, uma vez que todos os elétrons foram colocados. No entanto, o carbono não tem um octeto,
- Passo 5: Reorganizar os elétrons dos átomos externos para fazer múltiplas ligações com o átomo central, a fim de obter octetos sempre que possível.

exemplo 1: escrevendo estruturas de Lewis
a missão Cassini-Huygens da NASA detectou uma grande nuvem de cianeto de hidrogênio tóxico (HCN) em Titã, uma das luas de Saturno. Quais são as estruturas de Lewis destas moléculas?
Verifique Seu Aprendizado
dióxido de Carbono, CO2, é um produto da combustão de combustíveis fósseis. O CO2 tem estado implicado nas alterações climáticas globais. Qual é a estrutura de Lewis do CO2?
Conceitos-Chave e Resumo
Valença eletrônica estruturas podem ser visualizadas através do desenho de símbolos de Lewis (por átomos e íons monoatômicos) e estruturas de Lewis (para moléculas e polyatomic íons). Pares solitários, elétrons não emparelhados e ligações únicas, duplas ou triplas são usados para indicar onde os elétrons de Valência estão localizados em torno de cada átomo em uma estrutura de Lewis. A maioria das estruturas—especialmente as que contêm elementos de segunda linha-obedecem à Regra do octeto, na qual cada átomo (exceto H) é cercado por oito elétrons. Exceções à regra dos octetos ocorrem para moléculas de elétrons ímpares (radicais livres), moléculas com deficiência de elétrons e moléculas hipervalentes.
Exercises
- Write the Lewis symbols for each of the following ions:
- As3–
- I
- Be2+
- O2
- Ga3+
- Li+
- N3–
- Muitos íons monoatômicos são encontrados na água do mar, incluindo os íons formados a partir da seguinte lista de elementos. Escrever os símbolos de Lewis para os íons monatómicos formados a partir dos seguintes elementos:
- Cl
- Na
- Mg
- Ca
- K
- Br
- Sr
- F
- Escreva o Lewis símbolos dos íons em cada um dos seguintes compostos iónicos e os símbolos de Lewis do que o átomo a partir do qual são formados:
- Gm
- Al2O3
- GaCl3
- K2O
- Li3N
- KF
- Nas estruturas de Lewis listados abaixo, M e X representam diversos elementos do terceiro período da tabela periódica. Escrever a fórmula de cada composto utilizando os símbolos químicos de cada elemento:
- Write the Lewis structure for the diatomic molecule P2, an unstable form of phosphorus found in high-temperature phosphorus vapor.
- Escrever estruturas de Lewis para os seguintes:
- H2
- HBr
- PCl3
- Escrever estruturas de Lewis para os seguintes:
- O2
- H2CO
- AsF3
- SiCl4
Glossário
dupla ligação: a ligação covalente ligação em que dois pares de elétrons são compartilhados entre dois átomos
free radical: molécula que contém um número ímpar de elétrons
hypervalent molécula: molécula que contém pelo menos um elemento de grupo que tem mais de oito elétrons na sua valence shell
estrutura de Lewis: diagrama mostrando solitário pares e pares de elétrons de ligação dos elétrons em uma molécula ou íon
Lewis símbolo: símbolo de um elemento ou íons monoatômicos que usa um ponto para representar cada valência elétrons no elemento ou íon
par solitário: dois (um par) de valência elétrons que não são usados para formar uma ligação covalente bond
regra do octeto: diretriz que indica principal grupo de átomos irão formar estruturas em que oito elétrons de valência interagir com cada núcleo, contando os elétrons de ligação, como interagir com os átomos ligados pelo vínculo
single bond: bond em que um único par de elétrons é compartilhado entre dois átomos
ligação tripla: ligação na qual três pares de electrões são partilhados entre dois átomos


 HCN: nenhum elétrons permanecem
HCN: nenhum elétrons permanecem




















